TRAITÉ
ÉLÉMENTAIRE
DE CHIMIE.
TOME PREMIER.
TRAITÉ
ÉLÉMENTAIRE
DE CHIMIE,
PRÉSENTÉ DANS UN ORDRE NOUVEAU
ET D'APRÈS LES DÉCOUVERTES MODERNES;
Avec Figures:
Par M. Lavoisier, de l'Académie des Sciences, de la Société Royale de Médecine, des Sociétés d'Agriculture de Paris & d'Orléans, de la Société Royale de Londres, de l'Institut de Bologne, de la Société Helvétique de Basle, de celles de Philadelphie, Harlem, Manchester, Padoue, &c.
TOME PREMIER.

A PARIS,
Chez Cuchet, Libraire, rue & hôtel Serpente.
M. DCC. LXXXIX.
Sous le Privilège de l'Académie des Sciences & de la Société Royale de Médecine.
v
DISCOURS
PRÉLIMINAIRE.
Je n'avois pour objet lorsque j'ai entrepris cet ouvrage, que de donner plus de développement au Mémoire que j'ai lu à la séance publique de l'Académie des Sciences du mois d'Avril 1787, sur la nécessité de réformer & de perfectionner la Nomenclature de la Chimie.
C'est en m'occupant de ce travail, que j'ai mieux senti que je ne l'avois encore fait jusqu'alors, l'évidence des principes qui ont été posés par l'Abbé de Condillac dans sa logique, & dans quelques autres de ses ouvrages. Il y établit que nous ne pensons qu'avec le secours des mots; que les langues sont de véritables méthodes analytiques; que l'algèbre la plus simple, la plus exacte & la mieux adaptée à son objet de toutes les manières de s'énoncer, est à-la-fois une langue & une méthode vj analytique; enfin que l'art de raisonner se réduit à une langue bien faite. Et en effet tandis que je croyois ne m'occuper que de Nomenclature, tandis que je n'avois pour objet que de perfectionner le langage de la Chimie, mon ouvrage s'est transformé insensiblement entre mes mains, sans qu'il m'ait été possible de m'en défendre, en un Traité élémentaire de Chimie.
L'impossibilité d'isoler la Nomenclature de la science & la science de la Nomenclature, tient à ce que toute science physique est nécessairement formée de trois choses: la série des faits qui constituent la science; les idées qui les rappellent; les mots qui les expriment. Le mot doit faire naître l'idée; l'idée doit peindre le fait: ce sont trois empreintes d'un même cachet; & comme ce sont les mots qui conservent les idées & qui les transmettent, il en résulte qu'on ne peut perfectionner le langage sans perfectionner la science, ni la science sans le langage, & que quelque certains que fussent vij les faits, quelque justes que fussent les idées qu'ils auroient fait naître, ils ne transmettroient encore que des impressions fausses, si nous n'avions pas des expressions exactes pour les rendre.
La première partie de ce Traité fournira à ceux qui voudront bien le méditer, des preuves fréquentes de ces vérités; mais comme je me suis vu forcé d'y suivre un ordre qui differe essentiellement de celui qui a été adopté jusqu'à présent dans tous les ouvrages de Chimie, je dois compte des motifs qui m'y ont déterminé.
C'est un principe bien constant, & dont la généralité est bien reconnue dans les mathématiques, comme dans tous les genres de connoissances, que nous ne pouvons procéder pour nous instruire, que du connu à l'inconnu. Dans notre première enfance nos idées viennent de nos besoins; la sensation de nos besoins fait naître l'idée des objets propres à les satisfaire, & insensiblement par une suite de sensations, d'observations & d'analyses, il se forme une génération successive viij d'idées toutes liées les unes aux autres, dont un observateur attentif peut même jusqu'à un certain point, retrouver le fil & l'enchaînement, & qui constituent l'ensemble de ce que nous savons.
Lorsque nous nous livrons pour la première fois à l'étude d'une science, nous sommes par rapport à cette science, dans un état très-analogue à celui dans lequel sont les enfans, & la marche que nous avons à suivre est précisément celle que suit la nature dans la formation de leurs idées. De même que dans l'enfant l'idée est un effet de la sensation, que c'est la sensation qui fait naître l'idée; de même aussi pour celui qui commence à se livrer à l'étude des sciences physiques, les idées ne doivent être qu'une conséquence, une suite immédiate d'une expérience ou d'une observation.
Qu'il me soit permis d'ajouter que celui qui entre dans la carrière des sciences, est dans une situation moins avantageuse que l'enfant même qui acquiert ses premières idées; si l'enfant s'est trompé sur ix les effets salutaires ou nuisibles des objets qui l'environnent, la nature lui donne des moyens multipliés de se rectifier. A chaque instant le jugement qu'il a porté se trouve redressé par l'expérience. La privation ou la douleur viennent à la suite d'un jugement faux; la jouissance & le plaisir à la suite d'un jugement juste. On ne tarde pas avec de tels maîtres à devenir conséquent, & on raisonne bientôt juste quand on ne peut raisonner autrement sous peine de privation ou de souffrance.
Il n'en est pas de même dans l'étude & dans la pratique des sciences; les faux jugemens que nous portons, n'intéressent ni notre existence, ni notre bien-être; aucun intérêt physique ne nous oblige de nous rectifier: l'imagination au contraire qui tend à nous porter continuellement au-delà du vrai; l'amour-propre & la confiance en nous-mêmes, qu'il sait si bien nous inspirer, nous sollicitent à tirer des conséquences qui ne dérivent pas immédiatement des faits: en sorte que nous sommes en quelque façon intéressés x à nous séduire nous-mêmes. Il n'est donc pas étonnant que dans les sciences physiques en général, on ait souvent supposé au lieu de conclure; que les suppositions transmises d'âge en âge, soient devenues de plus en plus imposantes par le poids des autorités qu'elles ont acquises, & qu'elles ayent enfin été adoptées & regardées comme des vérités fondamentales, même par de très-bons esprits.
Le seul moyen de prévenir ces écarts, consiste à supprimer ou au moins à simplifier autant qu'il est possible le raisonnement, qui est de nous & qui seul peut nous égarer; à le mettre continuellement à l'épreuve de l'expérience; à ne conserver que les faits qui ne sont que des données de la nature, & qui ne peuvent nous tromper; à ne chercher la vérité que dans l'enchaînement naturel des expériences & des observations, de la même manière que les Mathématiciens parviennent à la solution d'un problême par le simple arrangement des données, & en réduisant le raisonnement à des opérations si simples, xj à des jugemens si courts, qu'ils ne perdent jamais de vue l'évidence qui leur sert de guide.
Convaincu de ces vérités, je me suis imposé la loi de ne procéder jamais que du connu à l'inconnu, de ne déduire aucune conséquence qui ne dérive immédiatement des expériences & des observations, & d'enchaîner les faits & les vérités chimiques dans l'ordre le plus propre à en faciliter l'intelligence aux commençans. Il étoit impossible qu'en m'assujétissant à ce plan, je ne m'écartasse pas des routes ordinaires. C'est en effet un défaut commun à tous les cours & à tous les traités de Chimie, de supposer dès les premiers pas des connoissances que l'Elève ou le Lecteur ne doivent acquérir que dans les leçons subséquentes. On commence dans presque tous par traiter des principes des corps; par expliquer la table des affinités, sans s'appercevoir qu'on est obligé de passer en revue dès le premier jour les principaux phénomènes de la Chimie, de se servir d'expressions qui xij n'ont point été définies, & de supposer la science acquise par ceux auxquels on se propose de l'enseigner. Aussi est-il reconnu qu'on n'apprend que peu de chose dans un premier cours de Chimie; qu'une année suffit à peine pour familiariser l'oreille avec le langage, les yeux avec les appareils, & qu'il est presqu'impossible de former un Chimiste en moins de trois ou quatre ans.
Ces inconvéniens tiennent moins à la nature des choses qu'à la forme de l'enseignement, & c'est ce qui m'a déterminé à donner à la Chimie une marche qui me paroît plus conforme à celle de la nature. Je ne me suis pas dissimulé qu'en voulant éviter un genre de difficultés je me jettois dans un autre, & qu'il me seroit impossible de les surmonter toutes; mais je crois que celles qui restent n'appartiennent point à l'ordre que je me suis prescrit; qu'elles sont plutôt une suite de l'état d'imperfection où est encore la Chimie. Cette science présente des lacunes nombreuses qui interrompent la série xiij des faits, & qui exigent des raccordemens embarrassans & difficiles. Elle n'a pas, comme la Géométrie élémentaire, l'avantage d'être une science complette & dont toutes les parties sont étroitement liées entr'elles; mais en même tems sa marche actuelle est si rapide; les faits s'arrangent d'une manière si heureuse dans la doctrine moderne, que nous pouvons espérer, même de nos jours, de la voir s'approcher beaucoup du degré de perfection qu'elle est susceptible d'atteindre.
Cette loi rigoureuse, dont je n'ai pas dû m'écarter, de ne rien conclure au-delà de ce que les expériences présentent, & de ne jamais suppléer au silence des faits, ne m'a pas permis de comprendre dans cet Ouvrage la partie de la Chimie la plus susceptible, peut-être, de devenir un jour une science exacte: c'est celle qui traite des affinités chimiques ou attractions électives. M. Geoffroy, M. Gellert, M. Bergman, M. Schéele, M. de Morveau, M. Kirwan & beaucoup d'autres ont déjà rassemblé une multitude de faits xiv particuliers, qui n'attendent plus que la place qui doit leur être assignée; mais les données principales manquent, ou du moins celles que nous avons ne sont encore ni assez précises ni assez certaines, pour devenir la base fondamentale sur laquelle doit reposer une partie aussi importante de la Chimie. La science des affinités est d'ailleurs à la Chimie ordinaire ce que la Géométrie transcendante est à la Géométrie élémentaire, & je n'ai pas cru devoir compliquer par d'aussi grandes difficultés des Elémens simples & faciles qui seront, à ce que j'espère, à la portée d'un très-grand nombre de Lecteurs.
Peut-être un sentiment d'amour-propre a-t-il, sans que je m'en rendisse compte à moi-même, donné du poids à ces réflexions. M. de Morveau est au moment de publier l'article Affinité de l'Encyclopédie méthodique, & j'avois bien des motifs pour redouter de travailler en concurrence avec lui.
On ne manquera pas d'être surpris de xv ne point trouver dans un Traité élémentaire de Chimie, un Chapitre sur les parties constituantes & élémentaires des corps: mais je ferai remarquer ici que cette tendance que nous avons à vouloir que tous les corps de la nature ne soient composés que de trois ou quatre élémens, tient à un préjugé qui nous vient originairement des philosophes grecs. L'admission de quatre élémens qui, par la variété de leurs proportions, composent tous les corps que nous connoissons, est une pure hypothèse imaginée long tems avant qu'on eût les premières notions de la Physique expérimentale & de la Chimie. On n'avoit point encore de faits, & l'on formoit des systêmes; & aujourd'hui que nous avons rassemblé des faits, il semble que nous nous efforcions de les repousser, quand ils ne quadrent pas avec nos préjugés; tant il est vrai que le poids de l'autorité de ces pères de la philosophie humaine se fait encore sentir, & qu'elle pesera sans doute encore sur les générations à venir. xvj
Une chose très-remarquable, c'est que tout en enseignant la doctrine des quatre élémens, il n'est aucun Chimiste qui par la force des faits n'ait été conduit à en admettre un plus grand nombre. Les premiers Chimistes qui ont écrit depuis le renouvellement des Lettres, regardoient le soufre & le sel comme des substances élémentaires qui entroient dans la combinaison d'un grand nombre de corps: ils reconnoissoient donc l'existence de six élémens, au lieu de quatre. Beccher admettoit trois terres, & c'étoit de leur combinaison & de la différence des proportions que résultoit, suivant lui, la différence qui existe entre les substances métalliques. Stahl a modifié ce systême: tous les Chimistes qui lui ont succédé se sont permis d'y faire des changemens, même d'en imaginer d'autres, mais tous se sont laissé entraîner à l'esprit de leur siècle, qui se contentoit d'assertions sans preuves, ou du moins qui regardoit souvent comme telles de très-légères probabilités. xvij
Tout ce qu'on peut dire sur le nombre & sur la nature des élémens se borne suivant moi à des discussions purement métaphysiques: ce sont des problêmes indéterminés qu'on se propose de résoudre, qui sont susceptibles d'une infinité de solutions, mais dont il est très-probable qu'aucune en particulier n'est d'accord avec la nature. Je me contenterai donc de dire que si par le nom d'élémens, nous entendons désigner les molécules simples & indivisibles qui composent les corps, il est probable que nous ne les connoissons pas: que si au contraire nous attachons au nom d'élémens ou de principes des corps l'idée du dernier terme auquel parvient l'analyse, toutes les substances que nous n'avons encore pu décomposer par aucun moyen, sont pour nous des élémens; non pas que nous puissions assurer que ces corps que nous regardons comme simples, ne soient pas eux-mêmes composés de deux ou même d'un plus grand nombre de principes, mais puisque ces principes ne se séparent xviij jamais, ou plutôt puisque nous n'avons aucun moyen de les séparer, ils agissent à notre égard à la manière des corps simples, & nous ne devons les supposer composés qu'au moment où l'expérience & l'observation nous en auront fourni la preuve.
Ces réflexions sur la marche des idées, s'appliquent naturellement au choix des mots qui doivent les exprimer. Guidé par le travail que nous avons fait en commun en 1787, M. de Morveau, M. Berthollet, M. de Fourcroy & moi sur la Nomenclature de la Chimie; j'ai désigné autant que je l'ai pu les substances simples par des mots simples, & ce sont elles que j'ai été obligé de nommer les premières. On peut se rappeller que nous nous sommes efforcés de conserver à toutes ces substances les noms qu'elles portent dans la société: nous ne nous sommes permis de les changer que dans deux cas; le premier à l'égard des substances nouvellement découvertes & qui n'avoient point encore été nommées, ou xix du moins pour celles qui ne l'avoient été que depuis peu de tems, & dont les noms encore nouveaux n'avoient point été sanctionnés par une adoption générale: le second lorsque les noms adoptés soit par les anciens, soit par les modernes, nous ont paru entraîner des idées évidemment fausses; lorsqu'ils pouvoient faire confondre la substance qu'ils désignoient avec d'autres, qui sont douées de propriétés différentes ou opposées. Nous n'avons fait alors aucune difficulté de leur en substituer d'autres que nous avons empruntés principalement du Grec: nous avons fait en sorte qu'ils exprimassent la propriété la plus générale, la plus caractéristique de la substance; & nous y avons trouvé l'avantage de soulager la mémoire des commençans qui retiennent difficilement un mot nouveau lorsqu'il est absolument vuide de sens, & de les accoutumer de bonne heure à n'admettre aucun mot sans y attacher une idée.
A l'égard des corps qui sont formés de la réunion de plusieurs substances simples, xx nous les avons désignés par des noms composés comme le sont les substances elles-mêmes; mais comme le nombre des combinaisons binaires est déjà très-considérable, nous serions tombés dans le désordre & dans la confusion, si nous ne nous fussions pas attachés à former des classes. Le nom de classes & de genres est dans l'ordre naturel des idées, celui qui rappelle la propriété commune à un grand nombre d'individus: celui d'espèces au contraire, est celui qui ramène l'idée aux propriétés particulières à quelques individus.
Ces distinctions ne sont pas faites comme on pourroit le penser, seulement par la métaphysique; elles le sont par la nature. Un enfant, dit l'Abbé de Condillac, appelle du nom d'arbre le premier arbre que nous lui montrons. Un second arbre qu'il voit ensuite lui rappelle la même idée; il lui donne le même nom; de même à un troisième, à un quatrième, & voilà le mot d'arbre donné d'abord à un individu, qui devient pour lui un nom xxj de classe ou de genre, une idée abstraite qui comprend tous les arbres en général. Mais lorsque nous lui aurons fait remarquer que tous les arbres ne servent pas aux mêmes usages, que tous ne portent pas les mêmes fruits, il apprendra bientôt à les distinguer par des noms spécifiques & particuliers. Cette logique est celle de toutes les sciences; elle s'applique naturellement à la Chimie.
Les acides, par exemple, sont composés de deux substances de l'ordre de celles que nous regardons comme simples, l'une qui constitue l'acidité & qui est commune à tous; c'est de cette substance que doit être emprunté le nom de classe ou de genre: l'autre qui est propre à chaque acide, qui les différencie les uns des autres, & c'est de cette substance que doit être emprunté le nom spécifique.
Mais dans la plupart des acides, les deux principes constituans, le principe acidifiant & le principe acidifié, peuvent exister dans des proportions différentes, qui constituent toutes des points d'équilibre ou de xxij saturation; c'est ce qu'on observe dans l'acide sulfurique & dans l'acide sulfureux; nous avons exprimé ces deux états du même acide en faisant varier la terminaison du nom spécifique.
Les substances métalliques qui ont été exposées à l'action réunie de l'air & du feu, perdent leur éclat métallique, augmentent de poids & prennent une apparence terreuse; elles sont dans cet état composées, comme les acides, d'un principe qui est commun à toutes, & d'un principe particulier propre à chacune: nous avons dû également les classer sous un nom générique dérivé du principe commun, & le nom que nous avons adopté est celui d'oxide; nous les avons ensuite différenciées les unes des autres par le nom particulier du métal auquel elles appartiennent.
Les substances combustibles qui, dans les acides & dans les oxides métalliques, sont un principe spécifique & particulier, sont susceptibles de devenir à leur tour un principe commun à un grand nombre xxiij de substances. Les combinaisons sulfureuses ont été long-temps les seules connues en ce genre: on sait aujourd'hui, d'après les expériences de MM. Vandermonde, Monge & Berthollet, que le charbon se combine avec le fer, & peut-être avec plusieurs autres métaux; qu'il en résulte, suivant les proportions, de l'acier, de la plombagine, &c. On sait également, d'après les expériences de M. Pelletier, que le phosphore se combine avec un grand nombre de substances métalliques. Nous avons encore rassemblé ces différentes combinaisons sous des noms génériques dérivés de celui de la substance commune, avec une terminaison qui rappelle cette analogie, & nous les avons specifiées par un autre nom dérivé de leur substance propre.
La nomenclature des êtres composés de trois substances simples, présentoit un peu plus de difficultés en raison de leur nombre, & sur-tout parce qu'on ne peut exprimer la nature de leurs principes constituans, sans employer des noms plus composés. xxiv Nous avons eu à considérer dans les corps qui forment cette classe, tels que les sels neutres, par exemple, 1o. le principe acidifiant qui est commun à tous; 2o. le principe acidifiable qui constitue leur acide propre; 3o. la base saline, terreuse, ou métallique qui détermine l'espèce particulière de sel. Nous avons emprunté le nom de chaque classe de sels de celui du principe acidifiable, commun à tous les individus de la classe; nous avons ensuite distingué chaque espèce par le nom de la base saline, terreuse, ou métallique, qui lui est particulière.
Un sel, quoique composé des trois mêmes principes, peut être cependant dans des états très-différens, par la seule différence de leur proportion. La nomenclature que nous avons adoptée auroit été défectueuse si elle n'eût pas exprimé ces différens états, & nous y sommes principalement parvenus par des changemens de terminaison que nous avons rendu uniformes pour un même état des différens sels. xxv
Enfin nous sommes arrivés au point que par le mot seul, on reconnoît sur le champ quelle est la substance combustible qui entre dans la combinaison dont il est question; si cette substance combustible est combinée avec le principe acidifiant, & dans quelle proportion; dans quel état est cet acide; à quelle base il est uni; s'il y a saturation exacte; si c'est l'acide, ou bien la base qui est en excès.
On conçoit qu'il n'a pas été possible de remplir ces différentes vues sans blesser quelquefois des usages reçus, & sans adopter des dénominations qui ont paru dures & barbares dans le premier moment; mais nous avons observé que l'oreille s'accoutumoit promptement aux mots nouveaux, sur-tout lorsqu'ils se trouvoient liés à un systême général & raisonné. Les noms, au surplus, qui s'employoient avant nous, tels que ceux de poudre d'algaroth, de sel alembroth, de pompholix, d'eau phagédénique, de turbith minéral, de colcothar, & beaucoup d'autres, ne sont ni moins durs, ni moins extraordinaires; xxvj il faut une grande habitude & beaucoup de mémoire pour se rappeller les substances qu'ils expriment, & sur-tout pour reconnoître à quel genre de combinaison ils appartiennent. Les noms d'huile de tartre par défaillance, d'huile de vitriol, de beurre d'arsenic & d'antimoine, de fleurs de zinc, &c. sont plus impropres encore, parce qu'ils font naître des idées fausses; parce qu'il n'existe, à proprement parler, dans le règne minéral, & sur-tout dans le règne métallique, ni beurres, ni huiles, ni fleurs; enfin parce que les substances qu'on désigne sous ces noms trompeurs, sont de violens poisons.
On nous a reproché lorsque nous avons publié notre Essai de Nomenclature chimique, d'avoir changé la langue que nos maîtres ont parlée, qu'ils ont illustrée & qu'ils nous ont transmise; mais on a oublié que c'étoient Bergman & Macquer qui avoient eux-mêmes sollicité cette réforme. Le savant Professeur d'Upsal, M. Bergman, écrivoit à M. de Morveau, dans les derniers temps de sa vie: ne faites xxvij grace à aucune dénomination impropre: ceux qui savent déjà entendront toujours; ceux qui ne savent pas encore, entendront plus tôt.
Peut-être seroit-on plus fondé à me reprocher de n'avoir donné dans l'Ouvrage que je présente au Public, aucun historique de l'opinion de ceux qui m'ont précédé; de n'avoir présenté que la mienne sans discuter celle des autres. Il en est résulté que je n'ai pas toujours rendu à mes confrères, encore moins aux Chimistes étrangers, la justice qu'il étoit dans mon intention de leur rendre: mais je prie le Lecteur de considérer que si l'on accumuloit les citations dans un ouvrage élémentaire, si l'on s'y livroit à de longues discussions sur l'historique de la science & sur les travaux de ceux qui l'ont professée, on perdroit de vue le véritable objet qu'on s'est proposé, & l'on formeroit un ouvrage d'une lecture tout-à-fait fastidieuse pour les commençans. Ce n'est ni l'histoire de la science, ni celle de l'esprit humain qu'on doit faire dans xxviij un traité élémentaire: on ne doit y chercher que la facilité, la clarté; on en doit soigneusement écarter tout ce qui pourroit tendre à détourner l'attention. C'est un chemin qu'il faut continuellement applanir, dans lequel il ne faut laisser subsister aucun obstacle qui puisse apporter le moindre retard. Les sciences présentent déjà par elles-mêmes assez de difficultés, sans en appeller encore qui leur sont étrangères. Les Chimistes s'appercevront facilement d'ailleurs que je n'ai presque fait usage dans la première partie que des expériences qui me sont propres. Si quelquefois il a pu m'échapper d'adopter, sans les citer, les expériences ou les opinions de M. Berthollet, de M. de Fourcroy, de M. de la Place, de M. Monge, & de ceux en général qui ont adopté les mêmes principes que moi, c'est que l'habitude de vivre ensemble, de nous communiquer nos idées, nos observations, notre manière de voir, a établi entre nous une sorte de communauté d'opinions dans laquelle il nous est souvent difficile à nous-mêmes xxix de distinguer ce qui nous appartient plus particulièrement.
Tout ce que je viens d'exposer sur l'ordre que je me suis efforcé de suivre dans la marche des preuves & des idées, n'est applicable qu'à la première partie de cet ouvrage: c'est elle seule qui contient l'ensemble de la doctrine que j'ai adoptée; c'est à elle seule que j'ai cherché à donner la forme véritablement élémentaire.
La seconde partie est principalement formée des tableaux de la nomenclature des sels neutres. J'y ai joint seulement des explications très-sommaires, dont l'objet est de faire connoître les procédés les plus simples pour obtenir les différentes espèces d'acides connus: cette seconde partie ne contient rien qui me soit propre; elle ne présente qu'un abrégé très-concis de résultats extraits de différens ouvrages.
Enfin j'ai donné dans la troisième partie une description détaillée de toutes les opérations relatives à la Chimie moderne. Un ouvrage de ce genre paroissoit desiré xxx depuis long-temps, & je crois qu'il sera de quelqu'utilité. En général la pratique des expériences, & sur-tout des expériences modernes, n'est point assez répandue; & peut-être si, dans les différens Mémoires que j'ai donnés à l'Académie, je me fusse étendu davantage sur le détail des manipulations, me serois-je fait plus facilement entendre, & la science auroit-elle fait des progrès plus rapides. L'ordre des matières dans cette troisième partie m'a paru à-peu-près arbitraire, & je me suis seulement attaché à classer dans chacun des huit chapitres qui la composent, les opérations qui ont ensemble le plus d'analogie. On s'appercevra aisément que cette troisième partie n'a pu être extraite d'aucun ouvrage, & que dans les articles principaux, je n'ai pu être aidé que de ma propre expérience.
Je terminerai ce Discours préliminaire en transcrivant littéralement quelques passages de M. l'Abbé de Condillac, qui me paroissent peindre avec beaucoup de vérité l'état où étoit la Chimie dans des xxxj temps très-rapprochés du nôtre[1]. Ces passages qui n'ont point été faits exprès, n'en acquerront que plus de force, si l'application en paroît juste.
«Au lieu d'observer les choses que nous voulions connoître, nous avons voulu les imaginer. De supposition fausse en supposition fausse, nous nous sommes égarés parmi une multitude d'erreurs; & ces erreurs étant devenues des préjugés, nous les avons prises par cette raison pour des principes: nous nous sommes donc égarés de plus en plus. Alors nous n'avons su raisonner que d'après les mauvaises habitudes que nous avions contractées. L'art d'abuser des mots sans les bien entendre a été pour nous l'art de raisonner........ Quand les choses sont parvenues à ce point, quand les erreurs se sont ainsi accumulées, il n'y a qu'un moyen de remettre l'ordre dans la faculté de penser; c'est d'oublier tout ce que nous avons appris, xxxij de reprendre nos idées à leur origine, d'en suivre la génération, & de refaire, comme dit Bacon, l'entendement humain.
»Ce moyen est d'autant plus difficile, qu'on se croit plus instruit. Aussi des Ouvrages où les sciences seroient traitées avec une grande netteté, une grande précision, un grand ordre, ne seroient-ils pas à la portée de tout le monde. Ceux qui n'auroient rien étudié les entendroient mieux que ceux qui ont fait de grandes études, & sur-tout que ceux qui ont écrit beaucoup sur les sciences».
M. l'Abbé de Condillac ajoute à la fin du chapitre V:
«Mais enfin les sciences ont fait des progrès, parce que les Philosophes ont mieux observé, & qu'ils ont mis dans leur langage la précision & l'exactitude qu'ils avoient mises dans leurs observations; ils ont corrigé la langue, & l'on a mieux raisonné».
xxxiij
TABLE
DES CHAPITRES
DU TOME PREMIER.
| Discours préliminaire, | page v |
| PREMIERE PARTIE. De la formation des fluides aériformes & de leur décomposition; de la combustion des corps simples & de la formation des acides. |
|
| Chap. I. Des combinaisons du calorique & de la formation des fluides élastiques aériformes, | 1 |
| Chap. II. Vues générales sur la formation & la constitution de l'atmosphère de la terre, | 28 |
| Chap. III. Analyse de l'air de l'atmosphère: sa résolution en deux fluides élastiques, l'un respirable, l'autre non respirable, | 33 |
| xxxivChap. IV. Nomenclature des différentes parties constitutives de l'air de l'atmosphère, | 51 |
| Chap. V. De la décomposition du gaz oxigène par le soufre, le phosphore & le charbon, & de la formation des acides en général, | 57 |
| Chap. VI. De la nomenclature des Acides en général, & particulièrement de ceux tirés du salpêtre & du sel marin, | 70 |
| Chap. VII. De la décomposition du Gaz oxygène par les métaux, & de la formation des Oxides métalliques, | 82 |
| Chap. VIII. Du principe radical de l'Eau, & de sa décomposition par le charbon & par le fer, | 87 |
| Chap. IX. De la quantité de Calorique qui se dégage des différentes espèces de combustion, | 103 |
| Combustion du Phosphore, | 107 |
| Combustion du Charbon, | 108 |
| Combustion du Gaz hydrogène, | 109 |
| Formation de l'Acide nitrique, | ibid. |
| Combustion de la Bougie, | 112 |
| Combustion de l'Huile d'olive, | 113 |
| Chap. X. De la combinaison des Substances combustibles les unes avec les autres, | 116 |
| xxxvChap. XI. Considérations sur les Oxides & les Acides à plusieurs bases, & sur la composition des matières végétales & animales, | 123 |
| Chap. XII. De la décomposition des matières végétales & animales par l'action du feu, | 132 |
| Chap. XIII. De la décomposition des Oxides végétaux par la fermentation vineuse, | 139 |
| Chap. XIV. De la fermentation putride, | 153 |
| Chap. XV. De la fermentation acéteuse, | 159 |
| Chap. XVI. De la formation des Sels neutres, & des différentes bases qui entrent dans leur composition, | 162 |
| De la Potasse, | 164 |
| De la Soude, | 169 |
| De l'Ammoniaque, | 170 |
| De la Chaux, de la Magnésie, de la Baryte & de l'Alumine, | 172 |
| Des Substances métalliques, | 173 |
| Chap. XVII. Suite des réflexions sur les bases salifiables, & sur la formation des Sels neutres, | 176 |
| SECONDE PARTIE. De la Combinaison des Acides avec les bases salifiables, & de la Formation des Sels neutres. |
|
| xxxvjAvertissement, | 189 |
| Tableau des Substances simples, | 192 |
| Observations, | 193 |
| Tableau des Radicaux ou bases oxidables & acidifiables, composés, qui entrent dans les combinaisons à la manière des substances simples, | 196 |
| Observations, | 197 |
| Observations sur les combinaisons de la lumière & du calorique avec différentes substances, | 200 |
| Tableau des combinaisons binaires de l'oxygène avec les substances métalliques & non métalliques oxidables & acidifiables, | 203 |
| Observations, | ibid. |
| Tableau des combinaisons de l'Oxygène avec les radicaux composés, | 208 |
| Observations, | 209 |
| xxxvijTableau des combinaisons binaires de l'Azote avec les substances simples, | 212 |
| Observations, | 213 |
| Tableau des combinaisons binaires de l'Hydrogène avec les substances simples, | 216 |
| Observations, | 217 |
| Tableau des combinaisons binaires du Soufre non oxygéné avec les substances simples, | 220 |
| Observations, | 221 |
| Tableau des combinaisons binaires du Phosphore non oxygéné avec les substances simples, | 222 |
| Observations, | 223 |
| Tableau des combinaisons binaires du Charbon non oxygéné avec les substances simples, | 226 |
| Observations, | 227 |
| Observations sur les radicaux muriatique, fluorique & boracique, & sur leurs combinaisons, | 229 |
| Observations sur la combinaison des métaux les uns avec les autres, | 230 |
| Tableau des combinaisons de l'Azote ou Radical nitrique, porté à l'état d'acide nitreux par la combinaison d'une suffisante quantité d'oxygène, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 231 |
| xxxviijTableau des combinaisons de l'Azote complettement saturé d'oxigène, & porté à l'état d'acide nitrique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 232 |
| Observations, | 233 |
| Tableau des combinaisons de l'Acide sulfurique ou Soufre oxygéné avec les bases salifiables dans l'ordre de leur affinité avec cet acide, par la voie humide, | 238 |
| Observations, | 240 |
| Tableau des combinaisons de l'Acide sulfureux avec les bases salifiables dans l'ordre de leur affinité avec cet acide, | 243 |
| Observations, | 244 |
| Tableau des combinaisons du Phosphore qui a reçu un premier degré d'oxygénation, & qui a été porté à l'état d'Acide phosphoreux, avec les bases salifiables dans l'ordre de leur affinité avec cet acide, | 246 |
| Tableau des combinaisons du Phosphore saturé d'oxygène, ou Acide phosphorique avec les substances salifiables dans l'ordre de leur affinité avec cet acide, | 247 |
| Observations, | 248 |
| xxxixTableau des combinaisons du Radical carbonique oxygéné, ou Acide carbonique avec les bases salifiables dans l'ordre de leur affinité avec cet acide, | 250 |
| Observations, | 251 |
| Tableau des combinaisons du Radical muriatique oxygéné, ou Acide muriatique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 253 |
| Tableau des combinaisons de l'Acide muriatique oxigéné avec les différentes bases salifiables avec lesquelles il est susceptible de s'unir, | 254 |
| Observations, | 255 |
| Tableau des combinaisons de l'Acide nitro-muriatique avec les bases salifiables, rangées par ordre alphabétique, attendu que les affinités de cet acide ne sont point assez connues, | 258 |
| Observations, | 259 |
| Tableau des combinaisons du Radical fluorique oxigéné, ou Acide fluorique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 261 |
| Observations, | 262 |
| xlTableau des combinaisons du Radical boracique oxigéné, avec les différentes bases salifiables auxquelles il est susceptible de s'unir dans l'ordre de leur affinité avec cet acide, | 264 |
| Observations, | 265 |
| Tableau des combinaisons de l'Arsenic oxygéné, ou Acide arsenique avec les bases salifiables dans l'ordre de leur affinité avec cet acide, | 268 |
| Observations, | 269 |
| Tableau des combinaisons du Molybdène oxygéné, ou Acide molybdique avec les bases salifiables, par ordre alphabétique, | 272 |
| Observations, | 273 |
| Tableau des combinaisons du Tungstène oxygéné, ou Acide tungstique avec les bases salifiables, | 274 |
| Observations, | 275 |
| Tableau des combinaisons du Radical tartareux oxygéné, ou Acide tartareux avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 277 |
| Observations, | 278 |
| Tableau des combinaisons du Radical malique oxygéné, ou Acide malique avec les bases salifiables par ordre alphabétique, | 281 |
| Observations, | 282 |
| xljTableau des combinaisons du Radical citrique oxygéné, ou Acide citrique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 284 |
| Observations, | 285 |
| Tableau des combinaisons du Radical pyro-ligneux oxygéné, ou Acide pyro-ligneux avec les bases salifiables dans l'ordre de leur affinité avec cet acide, | 286 |
| Observations, | 287 |
| Tableau des combinaisons du Radical pyro-tartareux oxygéné, ou Acide pyro-tartareux avec les différentes bases salifiables dans l'ordre de leur affinité avec cet acide, | 288 |
| Observations, | 289 |
| Tableau des combinaisons du Radical pyro-muqueux oxygéné, ou Acide pyro-muqueux avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 290 |
| Observations, | 291 |
| Tableau des combinaisons du Radical oxalique oxygéné, ou Acide oxalique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 292 |
| Observations, | 293 |
| xlijTableau des combinaisons du Radical acéteux oxygéné, par un premier degré d'oxigénation avec les bases salifiables, suivant l'ordre de leur affinité avec cet acide, | 295 |
| Observations, | 295 |
| Tableau des combinaisons du Radical acéteux oxygéné par un second degré d'oxygénation, ou Acide acétique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 298 |
| Observations, | 299 |
| Tableau des combinaisons du Radical succinique oxygéné, ou Acide succinique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 300 |
| Observations, | 301 |
| Tableau des combinaisons du Radical benzoïque oxygéné, ou Acide benzoïque, avec les différentes bases salifiables, rangées par ordre alphabétique, | 302 |
| Observations, | 303 |
| Tableau des combinaisons du Radical camphorique oxygéné, ou Acide camphorique, avec les bases salifiables, par ordre alphabétique, | 304 |
| Observations, | 305 |
| xliijTableau des combinaisons du Radical gallique oxygéné, ou Acide gallique, avec les bases salifiables rangées par ordre alphabétique, | 306 |
| Observations, | 307 |
| Tableau des combinaisons du Radical lactique oxygéné, ou Acide lactique, avec les bases salifiables, par ordre alphabétique, | 308 |
| Observations, | 309 |
| Tableau des combinaisons du Radical saccholactique oxygéné, ou Acide saccholactique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 310 |
| Observations, | 311 |
| Tableau des combinaisons du Radical formique oxygéné, ou Acide formique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 312 |
| Observations, | 313 |
| Tableau des combinaisons du Radical bombique oxygéné, ou Acide bombique, avec les substances salifiables, par ordre alphabétique, | 314 |
| Observations, | 315 |
| xlivTableau des combinaisons du Radical sébacique oxygéné, ou Acide sébacique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 316 |
| Observations, | 317 |
| Tableau des combinaisons du Radical lithique oxygéné, ou Acide lithique, avec les bases salifiables, rangées par ordre alphabétique, | 318 |
| Observations, | 319 |
| Tableau des combinaisons du Radical prussique oxygéné, ou Acide prussique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide, | 320 |
| Observations, | 322 |

TRAITÉ
ÉLÉMENTAIRE
DE CHIMIE.
PREMIERE PARTIE.
De la formation des fluides aériformes & de leur décomposition; de la combustion des corps simples & de la formation des acides.
CHAPITRE PREMIER.
Des combinaisons du calorique & de la formation des fluides élastiques aériformes.
C'est un phénomène constant dans la nature & dont la généralité a été bien établie par Boerhaave, que lorsqu'on échauffe un corps 2 quelconque, solide ou fluide, il augmente de dimension dans tous les sens. Les faits sur lesquels on s'est fondé pour restreindre la généralité de ce principe, ne présentent que des résultats illusoires, ou du moins dans lesquels se compliquent des circonstances étrangères qui en imposent: mais lorsqu'on est parvenu à séparer les effets, & à les rapporter chacun à la cause à laquelle ils appartiennent, on s'apperçoit que l'écartement des molécules par la chaleur, est une loi générale & constante de la Nature.
Si après avoir échauffé jusqu'à un certain point un corps solide, & en avoir ainsi écarté de plus en plus toutes les molécules, on le laisse refroidir, ces mêmes molécules se rapprochent les unes des autres dans la même proportion, suivant laquelle elles avoient été écartées; le corps repasse par les mêmes degrés d'extension qu'il avoit parcourus; & si on le ramène à la même température qu'il avoit en commençant l'expérience, il reprend sensiblement le volume qu'il avoit d'abord. Mais comme nous sommes bien éloignés de pouvoir obtenir un degré de froid absolu, comme nous ne connoissons aucun degré de refroidissement que nous ne puissions supposer susceptible d'être augmenté, il en résulte que nous n'avons 3 pas encore pu parvenir à rapprocher le plus qu'il est possible, les molécules d'aucun corps, & que par conséquent les molécules d'aucun corps ne se touchent dans la Nature; conclusion très-singulière & à laquelle cependant il est impossible de se refuser.
On conçoit que les molécules des corps étant ainsi continuellement sollicitées par la chaleur à s'écarter les unes des autres, elles n'auroient aucune liaison entr'elles, & qu'il n'y auroit aucun corps solide, si elles n'étoient retenues par une autre force qui tendît à les réunir, & pour ainsi dire à les enchaîner; & cette force, quelle qu'en soit la cause, a été nommée attraction.
Ainsi les molécules des corps peuvent être considérées comme obéissant à deux forces, l'une répulsive, l'autre attractive, entre lesquelles elles sont en équilibre. Tant que la dernière de ces forces, l'attraction, est victorieuse, le corps demeure dans l'état solide; si au contraire l'attraction est la plus foible, si la chaleur a tellement écarté les unes des autres les molécules du corps, qu'elles soient hors de la sphère d'activité de leur attraction, elles perdent l'adhérence qu'elles avoient entr'elles & le corps cesse d'être un solide.
L'eau nous présente continuellement un 4 exemple de ces phénomènes: au-dessous de zéro du thermomètre françois, elle est dans l'état solide, & elle porte le nom de glace; au-dessus de ce même terme, ses molécules cessent d'être retenues par leur attraction réciproque, & elle devient ce qu'on appelle un liquide: enfin, au-dessus de 80 degrés, ses molécules obéissent à la répulsion occasionnée par la chaleur; l'eau prend l'état de vapeur ou de gaz, & elle se transforme en un fluide aériforme.
On en peut dire autant de tous les corps de la Nature; ils sont ou solides, ou liquides, ou dans l'état élastique & aériforme, suivant le rapport qui existe entre la force attractive de leurs molécules & la force répulsive de la chaleur, ou, ce qui revient au même, suivant le degré de chaleur auquel ils sont exposés.
Il est difficile de concevoir ces phénomènes sans admettre qu'ils sont l'effet d'une substance réelle & matérielle, d'un fluide très-subtil qui s'insinue à travers les molécules de tous les corps & qui les écarte: & en supposant même que l'existence de ce fluide fût une hypothèse, on verra dans la suite qu'elle explique d'une manière très-heureuse les phénomènes de la Nature.
Cette substance, quelle qu'elle soit, étant la cause de la chaleur; ou en d'autres termes 5 la sensation que nous appellons chaleur, étant l'effet de l'accumulation de cette substance, on ne peut pas, dans un langage rigoureux, la désigner par le nom de chaleur; parce que la même dénomination ne peut pas exprimer la cause & l'effet. C'est ce qui m'avoit déterminé, dans le Mémoire que j'ai publié en 1777, (Recueil de l'Académie, page 420,) à la désigner sous le nom de fluide igné & de matière de la chaleur. Depuis, dans le travail que nous avons fait en commun M. de Morveau, M. Berthollet, M. de Fourcroy & moi, sur la réforme du langage chimique, nous avons cru devoir bannir ces périphrases qui allongent le discours, qui le rendent plus traînant, moins précis, moins clair, & qui souvent même ne comportent pas des idées suffisamment justes. Nous avons en conséquence désigné la cause de la chaleur, le fluide éminemment élastique qui la produit, par le nom de calorique. Indépendamment de ce que cette expression remplit notre objet dans le systême que nous avons adopté, elle a encore un autre avantage, c'est de pouvoir s'adapter à toutes sortes d'opinions; puisque rigoureusement parlant, nous ne sommes pas même obligés de supposer que le calorique soit une matière réelle: il suffit, comme on le sentira mieux par la lecture de ce qui 6 va suivre, que ce soit une cause répulsive quelconque qui écarte les molécules de la matière, & on peut ainsi en envisager les effets d'une manière abstraite & mathématique.
La lumière est-elle une modification du calorique, ou bien le calorique est-il une modification de la lumière? C'est sur quoi il est impossible de prononcer dans l'état actuel de nos connoissances. Ce qu'il y a de certain, c'est que dans un systême où l'on s'est fait une loi de n'admettre que des faits, & où l'on évite autant qu'il est possible de rien supposer au-delà de ce qu'ils présentent, on doit provisoirement désigner par des noms différens, ce qui produit des effets différens. Nous distinguerons donc la lumière du calorique; mais nous n'en conviendrons pas moins que la lumière & le calorique ont des qualités qui leur sont communes, & que dans quelques circonstances ils se combinent à peu près de la même manière, & produisent une partie des mêmes effets.
Ce que je viens de dire suffiroit déjà pour bien déterminer l'idée qu'on doit attacher au mot de calorique. Mais il me reste une tâche plus difficile à remplir, c'est de donner des idées justes de la manière dont le calorique agit sur les corps. Puisque cette matière subtile pénètre à travers les pores de toutes les 7 substances que nous connoissons, puisqu'il n'existe pas de vases à travers lesquels elle ne s'échappe, & qu'il n'en est par conséquent aucun qui puisse la contenir sans perte; on ne peut en connoître les propriétés que par des effets qui, la plupart, sont fugitifs & difficiles à saisir. C'est sur les choses qu'on ne peut ni voir, ni palper, qu'il est sur-tout important de se tenir en garde contre les écarts de l'imagination, qui tend toujours à s'élancer au-delà du vrai, & qui a bien de la peine à se renfermer dans le cercle étroit que les faits lui circonscrivent.
Nous venons de voir que le même corps devenoit solide ou liquide, ou fluide aériforme, suivant la quantité de calorique dont il étoit pénétré, ou, pour parler d'une manière plus rigoureuse, suivant que la force répulsive du calorique étoit égale à l'attraction de ses molécules, ou qu'elle étoit plus forte, ou plus foible qu'elle.
Mais s'il n'existoit que ces deux forces, les corps ne seroient liquides qu'à un degré indivisible du thermomètre, & ils passeroient brusquement de l'état de solide à celui de fluide élastique aériforme. Ainsi l'eau, par exemple, à l'instant même où elle cesse d'être glace, commenceroit à bouillir; elle se transformeroit en un fluide aériforme, & ses molécules s'écarteroient 8 indéfiniment dans l'espace: s'il n'en est pas ainsi, c'est qu'une troisième force, la pression de l'atmosphère, met obstacle à cet écartement, & c'est par cette raison que l'eau demeure dans l'état fluide depuis zéro jusqu'à 80 degrés du thermomètre françois; la quantité de calorique qu'elle reçoit dans cet intervalle est insuffisante pour vaincre l'effort occasionné par la pression de l'atmosphère.
On voit donc que, sans la pression de l'atmosphère, nous n'aurions pas de liquide constant; nous ne verrions les corps dans cet état qu'au moment précis où ils se fondent: la moindre augmentation de chaleur qu'ils recevroient ensuite, en écarteroit sur le champ les parties & les disperseroit. Il y a plus, sans la pression de l'atmosphère, nous n'aurions pas, à proprement parler, de fluides aériformes. En effet, au moment où la force de l'attraction seroit vaincue par la force répulsive du calorique, les molécules s'éloigneroient indéfiniment, sans que rien limitât leur écartement, si ce n'est leur propre pesanteur qui les rassembleroit pour former une atmosphère.
De simples réflexions sur les expériences les plus connues, suffisent pour faire appercevoir la vérité de ce que je viens d'énoncer. Elle se trouve d'ailleurs confirmée d'une manière évidente 9 par l'expérience qui suit, dont j'ai déjà donné le détail à l'Académie en 1777. (Voyez Mém. page 426.)
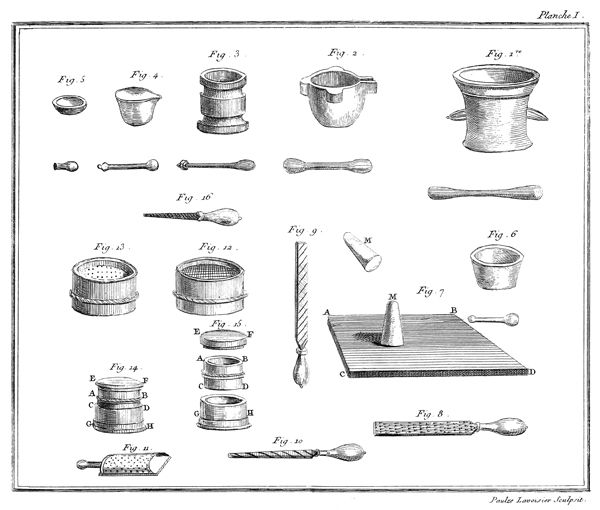
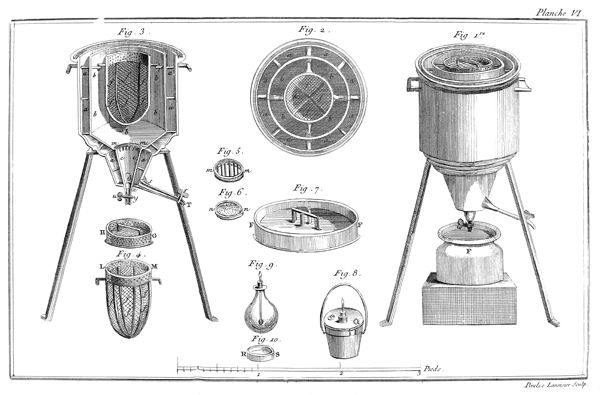
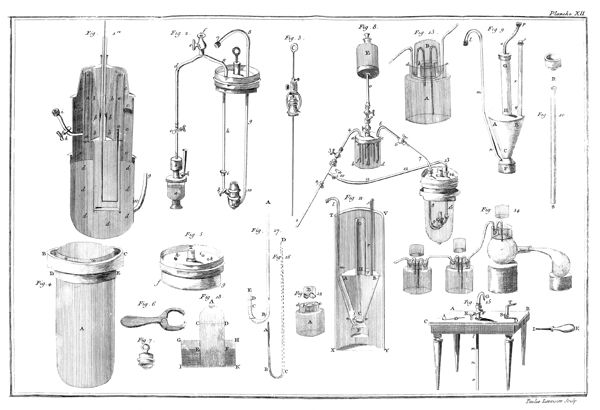
On remplit d'éther sulfurique[2] un petit vase de verre étroit, A, planche VII, fig. 17, monté sur son pied P. Ce vase ne doit pas avoir plus de douze à quinze lignes de diamètre & environ deux pouces de hauteur. On couvre ce vase avec une vessie humectée, qu'on assujettit autour du col du vase par un grand nombre de tours de gros fil bien serrés: pour plus grande sûreté, on remet une seconde vessie par-dessus la première, & on l'assujettit de la même manière. Ce vase doit être tellement rempli d'éther qu'il ne reste aucune portion d'air entre la liqueur & la vessie; on le place ensuite sous le récipient BCD, d'une machine pneumatique dont le haut B doit être garni d'une boëte à cuir, traversée par une tige EF, dont l'extrêmité F se termine en une pointe ou lame très-aigue: à ce même récipient doit être adapté un baromètre GH.
10
Lorsque tout est ainsi disposé, on fait le vuide sous le récipient; puis en faisant descendre la tige pointue EF, on crève la vessie. Aussi-tôt l'éther commence à bouillir avec une étonnante rapidité, il se vaporise & se transforme en un fluide élastique aériforme, qui occupe tout le récipient. Si la quantité d'éther est assez considérable pour que, la vaporisation finie, il en reste encore quelques goutes dans la fiole, le fluide élastique qui s'est produit est susceptible de soutenir le baromètre adapté à la machine pneumatique à huit ou dix pouces environ pendant l'hiver, & à vingt & vingt-cinq pendant les chaleurs de l'été. On peut, pour rendre cette expérience plus complette, introduire un petit thermomètre dans le vase A qui contient l'éther, & on s'apperçoit qu'il descend considérablement pendant tout le tems que dure la vaporisation.
On ne fait autre chose, dans cette expérience, que de supprimer le poids de l'atmosphère, qui, dans l'état ordinaire, pèse sur la surface de l'éther, & les effets qui en résultent prouvent évidemment deux choses: la première, qu'au degré de température dans lequel nous vivons, l'éther seroit constamment dans l'état d'un fluide aériforme, si la pression de l'atmosphère n'y mettoit obstacle. La seconde, que 11 ce passage de l'état liquide à l'état aériforme, est accompagné d'un refroidissement considérable, par la raison que pendant la vaporisation, une partie du calorique, qui étoit dans un état de liberté, ou au moins d'équilibre dans les corps environnans, se combine avec l'éther pour le porter à l'état de fluide aériforme.
La même expérience réussit avec tous les fluides évaporables, tels que l'esprit-de-vin ou alkool, l'eau & le mercure même; avec cette différence cependant que l'atmosphère d'alkool qui se forme sous le récipient, ne peut soutenir le baromètre adapté à la machine pneumatique, en hiver, qu'à un pouce au-dessus de son niveau, & à quatre ou cinq en été; que l'eau ne le soutient qu'à quelques lignes, & le mercure à quelques fractions de ligne. Il y a donc moins de fluide vaporisé lorsqu'on opère avec l'alkool, que lorsqu'on opère avec l'éther; moins encore avec l'eau, & sur-tout avec le mercure: par conséquent moins de calorique employé & moins de refroidissement; ce qui cadre parfaitement avec le résultat des expériences.
Un autre genre d'expérience prouve encore d'une manière aussi évidente que l'état aériforme est une modification des corps & qu'elle 12 dépend du degré de température & de pression qu'ils éprouvent.
Nous avons fait voir, M. de la Place & moi, dans un Mémoire que nous avons lu à l'Académie en 1777, mais qui n'a pas été imprimé, que lorsque l'éther étoit soumis à une pression de 28 pouces de mercure, c'est-à-dire, à une pression égale à celle de l'atmosphère, il entroit en ébullition à 32 ou 33 degrés du thermomètre de mercure. M. de Luc, qui a fait des recherches analogues sur l'esprit-de-vin, a reconnu qu'il entroit en ébullition à 67 degrés. Enfin, tout le monde sait que l'eau commence à bouillir à 80 degrés. L'ébullition n'étant autre chose que la vaporisation d'un fluide, ou le moment de son passage de l'état liquide à celui d'un fluide élastique aériforme, il étoit évident qu'en tenant constamment de l'éther à une température supérieure à 33 degrés & au degré habituel de pression de l'atmosphère, on devoit l'obtenir dans l'état d'un fluide aériforme; que la même chose devoit arriver à l'esprit-de-vin au-dessus de 67 degrés, & à l'eau au-dessus de 80, c'est ce qui s'est trouvé parfaitement confirmé par les expériences suivantes[3].
13
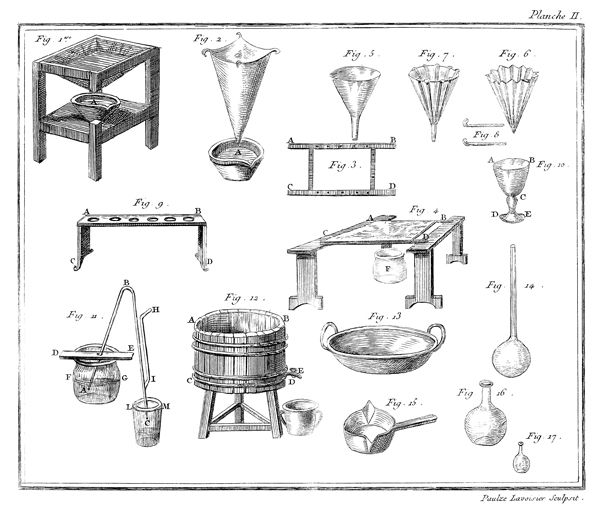
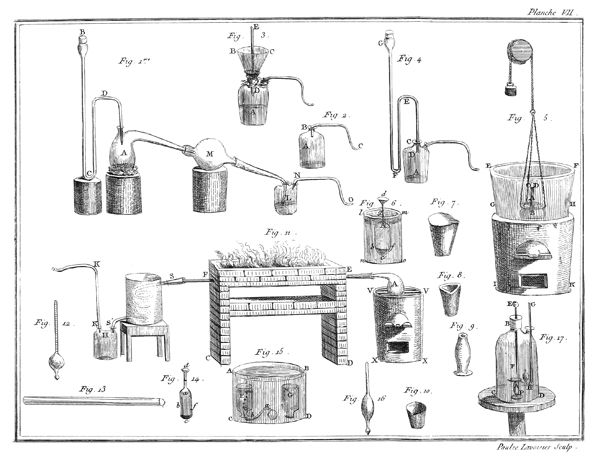
J'ai rempli avec de l'eau à 35 ou 36 degrés du thermomètre un grand vase ABCD, planche VII, figure 15; je le suppose transparent pour mieux faire sentir ce qui se passe dans son intérieur; on peut encore tenir les mains assez long-temps dans de l'eau à ce degré sans s'incommoder. J'y ai plongé des bouteilles à gouleau renversé F, G, qui s'y sont emplies, après quoi je les ai retournées de manière qu'elles eussent leur gouleau en en-bas, & appliqué contre le fond du vase.
Les choses étant ainsi disposées, j'ai introduit de l'éther sulfurique dans un très-petit matras, dont le col abc étoit doublement recourbé; j'ai plongé ce matras dans l'eau du vase ABCD, & j'ai engagé, comme on le voit représenté dans la figure 15, l'extrêmité de son col abc, dans le gouleau d'une des bouteilles F: dès que l'éther a commencé à ressentir l'impression de la chaleur, il est entré en ébullition; & le calorique qui s'est combiné avec lui, l'a transformé en un fluide élastique aériforme, dont j'ai rempli successivement plusieurs bouteilles F, G.
Ce n'est point ici le lieu d'examiner la nature & les propriétés de ce fluide aériforme, qui est très-inflammable; mais sans anticiper sur des connoissances que je ne dois pas supposer 14 au lecteur, j'observerai, en me fixant sur l'objet qui nous occupe dans ce moment, que l'éther, d'après cette expérience, est tout près de ne pouvoir exister dans la planette que nous habitons que dans l'état aériforme; que si la pesanteur de notre atmosphère n'équivaloit qu'à une colonne de 20 ou 24 pouces de mercure au lieu de 28, nous ne pourrions obtenir l'éther dans l'état liquide, au moins pendant l'été; que la formation de l'éther seroit par conséquent impossible sur les montagnes un peu élevées, & qu'il se convertiroit en gaz à mesure qu'il seroit formé, à moins qu'on n'employât des ballons très-forts pour le condenser & qu'on ne joignît le refroidissement à la pression. Enfin, que le degré de la chaleur du sang étant à peu près celui où l'éther passe de l'état liquide à l'état aériforme, il doit se vaporiser dans les premières voies, & qu'il est très-vraisemblable que les propriétés de ce médicament tiennent à cet effet, pour ainsi dire, mécanique.
Ces expériences réussissent encore mieux avec l'éther nitreux, parce qu'il se vaporise à un degré de chaleur moindre que l'éther sulfurique. A l'égard de l'alkool ou esprit-de-vin, l'expérience pour l'obtenir dans l'état aériforme, présente un peu plus de difficulté, parce que ce fluide n'étant susceptible de se vaporiser qu'à 15 67 degrés du thermomètre de Réaumur, il faut que l'eau du bain soit entretenue presque bouillante, & qu'à ce degré il n'est plus possible d'y plonger les mains.
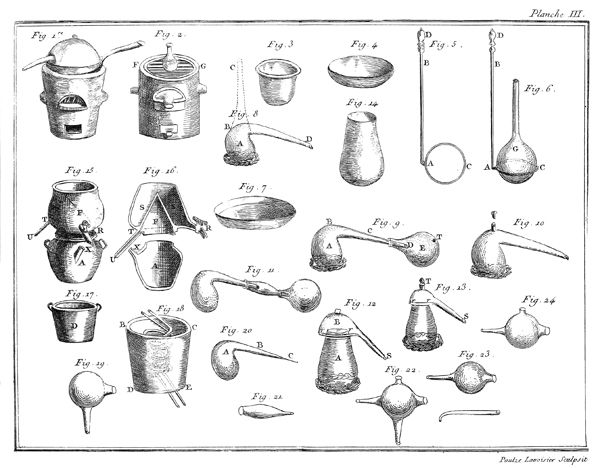
Il étoit évident que la même chose devoit arriver à l'eau; que ce fluide devoit également se transformer en gaz en l'exposant à un degré de chaleur supérieur à celui qui le fait bouillir; mais quoique convaincus de cette vérité, nous avons cru cependant, M. de la Place & moi, devoir la confirmer par une expérience directe, & en voici le résultat. Nous avons rempli de mercure une jarre de verre A, planche VII, figure 5, dont l'ouverture étoit retournée en en-bas, & nous avons passé dessous une soucoupe B, également remplie de mercure. Nous avons introduit dans cette jarre environ deux gros d'eau, qui ont gagné le haut CD de la jarre, & qui se sont rangés au-dessus de la surface du mercure; puis nous avons plongé le tout dans une grande chaudière de fer EFGH, placée sur un fourneau GHIK: cette chaudière étoit remplie d'eau salée en ébullition, dont la température excédoit 85 degrés du thermomètre; on sait, en effet, que l'eau chargée de sels est susceptible de prendre un degré de chaleur supérieur de plusieurs degrés à celui 16 de l'eau bouillante. Dès que les 2 gros d'eau, placés dans la partie supérieure CD de la jarre ou tube, ont eu atteint la température de 80 degrés ou environ, ils sont entrés en ébullition, & au lieu d'occuper, comme ils le faisoient, le petit espace ACD, ils se sont convertis en un fluide aériforme, qui l'a remplie toute entière: le mercure est même descendu un peu au-dessous de son niveau, & la jarre auroit été renversée si elle n'avoit été très-épaisse, par conséquent fort pesante, & si elle n'avoit d'ailleurs été assujettie à la soucoupe par du fil de fer. Si-tôt qu'on retiroit la jarre du bain d'eau salée, l'eau se condensoit & le mercure remontoit; mais elle reprenoit l'état aériforme quelques instans après que l'appareil avoit été replongé.
Voilà donc un certain nombre de substances qui se transforment en fluides aériformes à des degrés de chaleur très-voisins de ceux dans lesquels nous vivons. Nous verrons bientôt qu'il en est d'autres, tels que l'acide marin ou muriatique, l'alkali volatil ou ammoniaque, l'acide carbonique ou air fixe, l'acide sulfureux, &c. qui demeurent constamment dans l'état aériforme, au degré habituel de chaleur & de pression de l'atmosphère.
Tous ces faits particuliers, dont il me seroit 17 facile de multiplier les exemples, m'autorisent à faire un principe général de ce que j'ai déjà annoncé plus haut, que presque tous les corps de la Nature sont susceptibles d'exister dans trois états différens; dans l'état de solidité, dans l'état de liquidité, & dans l'état aériforme, & que ces trois états d'un même corps dépendent de la quantité de calorique qui lui est combinée. Je désignerai dorénavant ces fluides aériformes sous le nom générique de gaz; & je dirai en conséquence que, dans toute espèce de gaz, on doit distinguer le calorique, qui fait en quelque façon l'office de dissolvant, & la substance qui est combinée avec lui & qui forme sa base.
C'est à ces bases des différens gaz qui sont encore peu connues, que nous avons été obligés de donner des noms. Je les indiquerai dans le Chapitre IV de cet Ouvrage, après que j'aurai rendu compte de quelques phénomènes qui accompagnent l'échauffement & le refroidissement des corps, & que j'aurai donné des idées plus précises sur la constitution de notre atmosphère.
Nous avons vu que les molécules de tous les corps de la Nature étoient dans un état d'équilibre entre l'attraction, qui tend à les rapprocher & à les réunir, & les efforts du calorique 18 qui tend à les écarter. Ainsi non-seulement le calorique environne de toutes parts les corps, mais encore il remplit les intervalles que leurs molécules laissent entr'elles. On se formera une idée de ces dispositions, si l'on se figure un vase rempli de petites balles de plomb & dans lequel on verse une substance en poudre très-fine, telle que du sablon: on conçoit que cette substance se répandra uniformément dans les intervalles que les balles laissent entr'elles & les remplira. Les balles, dans cet exemple, sont au sablon ce que les molécules des corps sont au calorique; avec cette différence que, dans l'exemple cité, les balles se touchent, au lieu que les molécules des corps ne se touchent pas, & qu'elles sont toujours maintenues à une petite distance les unes des autres par l'effort du calorique.
Si à des balles dont la figure est ronde, on substituoit des hexaèdres, des octaèdres, ou des corps d'une figure régulière quelconque & d'une égale solidité, la capacité des vuides qu'ils laisseroient entr'eux ne seroit plus la même & l'on ne pourroit plus y loger une aussi grande quantité de sablon. La même chose arrive à l'égard de tous les corps de la Nature; les intervalles que leurs molécules laissent entr'elles ne sont pas tous d'une égale capacité: cette capacité 19 dépend de la figure de ces molécules, de leur grosseur, & de la distance les unes des autres à laquelle elles sont maintenues, suivant le rapport qui existe entre leur force d'attraction, & la force répulsive qu'exerce le calorique.
C'est dans ce sens qu'on doit entendre cette expression: capacité des corps pour contenir la matière de la chaleur; expression fort juste, introduite par les Physiciens Anglois, qui ont eu les premiers des notions exactes à cet égard. Un exemple de ce qui se passe dans l'eau & quelques réflexions sur la manière dont ce fluide mouille & pénètre les corps, rendra ceci plus intelligible: on ne sauroit trop s'aider dans les choses abstraites de comparaisons sensibles.
Si l'on plonge dans l'eau des morceaux de différens bois, égaux en volume, d'un pied cube, par exemple; ce fluide s'introduira peu à peu dans leurs pores; ils se gonfleront & augmenteront de poids: mais chaque espèce de bois admettra dans ses pores une quantité d'eau différente; les plus légers & les plus poreux en logeront davantage; ceux qui seront compactes & serrés, n'en laisseront pénétrer qu'une très-petite quantité: enfin, la proportion d'eau qu'ils recevront dépendra encore de la nature des molécules constituantes du bois, de l'affinité plus ou moins grande qu'elles auront 20 avec l'eau, & les bois très-résineux, par exemple, quoique très-poreux, en admettront très-peu. On pourra donc dire que les différentes espèces de bois ont une capacité différente pour recevoir de l'eau; on pourra même connoître, par l'augmentation de poids, la quantité qu'ils en auront absorbée; mais comme on ignorera la quantité d'eau qu'ils contenoient avant leur immersion, il ne sera pas possible de connoître la quantité absolue qu'ils en contiendront en en sortant.
Les mêmes circonstances ont lieu à l'égard des corps qui sont plongés dans le calorique; en observant cependant que l'eau est un fluide incompressible, tandis que le calorique est doué d'une grande élasticité, ce qui signifie en d'autres termes que les molécules du calorique ont une grande tendance à s'écarter les unes des autres, quand une force quelconque les a obligées de se rapprocher, & l'on conçoit que cette circonstance doit apporter des changemens très-notables dans les résultats.
Les choses amenées à ce point de clarté & de simplicité, il me sera aisé de faire entendre quelles sont les idées qu'on doit attacher à ces expressions; calorique libre, & calorique combiné, quantité spécifique de calorique contenue dans les différens corps, capacité pour 21 contenir le calorique, chaleur latente, chaleur sensible, toutes expressions qui ne sont point synonimes; mais qui, d'après ce que je viens d'exposer, ont un sens strict & déterminé. C'est ce sens que je vais chercher encore à fixer par quelques définitions.
Le calorique libre est celui qui n'est engagé dans aucune combinaison. Comme nous vivons au milieu d'un systême de corps avec lesquels le calorique a de l'adhérence, il en résulte que nous n'obtenons jamais ce principe dans l'état de liberté absolue.
Le calorique combiné est celui qui est enchaîné dans les corps par la force d'affinité ou d'attraction, & qui constitue une partie de leur substance, même de leur solidité.
On entend par cette expression calorique spécifique des corps, la quantité de calorique respectivement nécessaire pour élever d'un même nombre de degrés la température de plusieurs corps égaux en poids. Cette quantité de calorique dépend de la distance des molécules des corps, de leur adhérence plus ou moins grande; & c'est cette distance, ou plutôt l'espace qui en résulte, qu'on a nommé, comme je l'ai déjà observé, capacité pour contenir le calorique.
La chaleur, considérée comme sensation, ou en d'autres termes, la chaleur sensible, 22 n'est que l'effet produit sur nos organes par le passage du calorique qui se dégage des corps environnans. En général nous n'éprouvons de sensation que par un mouvement quelconque, & l'on pourroit poser comme un axiome, point de mouvement, point de sensation. Ce principe général s'applique naturellement au sentiment du froid & du chaud: lorsque nous touchons un corps froid, le calorique qui tend à se mettre en équilibre dans tous les corps, passe de notre main dans le corps que nous touchons, & nous éprouvons la sensation du froid. L'effet contraire arrive lorsque nous touchons un corps chaud; le calorique passe du corps à notre main, & nous avons la sensation de la chaleur. Si le corps & la main sont du même degré de température, ou à peu près, nous n'éprouvons aucune sensation, ni de froid, ni de chaud, parce qu'alors il n'y a point de mouvement, point de transport de calorique, & qu'encore une fois il n'y a pas de sensation sans un mouvement qui l'occasionne.
Lorsque le thermomètre monte, c'est une preuve qu'il y a du calorique libre qui se répand dans les corps environnans: le thermomètre, qui est au nombre de ces corps, en reçoit sa part, en raison de sa masse, & de la capacité qu'il a lui-même pour contenir le 23 calorique. Le changement qui arrive dans le thermomètre, n'annonce donc qu'un déplacement de calorique, qu'un changement arrivé à un systême de corps dont il fait partie; il n'indique tout au plus que la portion de calorique qu'il a reçue, mais il ne mesure pas la quantité totale qui a été dégagée, déplacée ou absorbée. Le moyen le plus simple & le plus exact pour remplir ce dernier objet est celui imaginé par M. de la Place, & qui est décrit dans les Mémoires de l'Académie, année 1780, page 364. On en trouve aussi une explication sommaire à la fin de cet Ouvrage. Il consiste à placer le corps, ou la combinaison d'où se dégage le calorique, au milieu d'une sphère creuse de glace: la quantité de glace fondue est une expression exacte de la quantité de calorique qui s'est dégagée. On peut, à l'aide de l'appareil que nous avons fait construire d'après cette idée, connoître, non pas comme on l'a prétendu, la capacité qu'ont les corps pour contenir le calorique, mais le rapport des augmentations ou diminutions que reçoivent ces capacités, par des nombres déterminés de degrés du thermomètre. Il est facile, avec le même appareil, & par diverses combinaisons d'expériences, de connoître la quantité de calorique nécessaire pour convertir les 24 corps solides en liquides & ceux-ci en fluides aériformes, & réciproquement, ce que les fluides élastiques abandonnent de calorique quand ils redeviennent liquides, & ceux-ci quand ils redeviennent solides. On pourra donc parvenir un jour, lorsque les expériences auront été assez multipliées, à déterminer le rapport de calorique qui constitue chaque espèce de gaz. Je rendrai compte, dans un Chapitre particulier, des principaux résultats que nous avons obtenus en ce genre.
Il me reste, en finissant cet article, à dire un mot sur la cause de l'élasticité des gaz & des fluides en vapeurs. Il n'est pas difficile d'appercevoir que cette élasticité tient à celle du calorique, qui paroît être le corps éminemment élastique de la nature. Rien de plus simple que de concevoir qu'un corps devient élastique en se combinant avec un autre qui est lui-même doué de cette propriété. Mais il faut convenir que c'est expliquer l'élasticité par l'élasticité; qu'on ne fait par-là que reculer la difficulté, & qu'il reste toujours à expliquer ce que c'est que l'élasticité, & pourquoi le calorique est élastique. En considérant l'élasticité dans un sens abstrait, elle n'est autre chose que la propriété qu'ont les molécules d'un corps de s'éloigner les unes des autres, lorsqu'on les a forcées de 25 s'approcher. Cette tendance qu'ont les molécules du calorique à s'écarter, a lieu même à de fort grandes distances. On en sera convaincu si l'on considère que l'air est susceptible d'un grand degré de compression; ce qui suppose que ses molécules sont déjà très-éloignées les unes des autres: car la possibilité de se rapprocher, suppose une distance au moins égale à la quantité du rapprochement. Or ces molécules de l'air qui sont déjà très-éloignées entr'elles tendent encore à s'éloigner davantage: en effet, si on fait le vuide de Boyle dans un très-vaste récipient, les dernières portions d'air qui y restent se répandent uniformément dans toute la capacité du vase, quelque grand qu'il soit, elles le remplissent en entier & pressent contre ses parois: or cet effet ne peut s'expliquer qu'en supposant que les molécules font un effort en tout sens pour s'écarter, & l'on ne connoît point la distance à laquelle ce phénomène s'arrête.
Il y a donc une véritable répulsion entre les molécules des fluides élastiques; ou du moins les choses se passent de la même manière que si cette répulsion avoit lieu, & on auroit quelque droit d'en conclure que les molécules du calorique se repoussent les unes les autres. Cette force de répulsion une fois admise, les 26 explications relatives à la formation des fluides aériformes ou gaz deviendroient fort simples: mais il faut convenir en même temps qu'une force répulsive, entre des molécules très-petites, qui agit à de grandes distances est difficile à concevoir.
Il paroîtroit peut-être plus naturel de supposer que les molécules du calorique s'attirent plus entr'elles que ne le font les molécules des corps, & qu'elles ne les écartent que pour obéir à la force d'attraction qui les oblige de se réunir. Il se passe quelque chose d'analogue à ce phénomène, quand on plonge une éponge sèche dans de l'eau: elle se gonfle; ses molécules s'écartent les unes des autres, & l'eau remplit tous les intervalles. Il est clair que cette éponge en se gonflant a acquis plus de capacité pour contenir de l'eau, qu'elle n'en avoit auparavant. Mais peut-on dire que l'introduction de l'eau entre ses molécules leur ait communiqué une force répulsive qui tende à les écarter les unes des autres? Non, sans doute: il n'y a au contraire que des forces attractives qui agissent dans ce cas, & ces forces sont, 1o. la pesanteur de l'eau & l'action qu'elle exerce en tout sens, comme tous les fluides; 2o. la force attractive des molécules de l'eau les unes à l'égard des autres; 3o. la force 27 attractive des molécules de l'éponge entr'elles; enfin, l'attraction réciproque des molécules de l'eau & de celles de l'éponge. Il est aisé de concevoir que c'est de l'intensité & du rapport de toutes ces forces, que dépend l'explication du phénomène. Il est probable que l'écartement des molécules des corps par le calorique, tient de même à une combinaison de différentes forces attractives, & c'est le résultat de ces forces que nous cherchons à exprimer d'une manière plus concise & plus conforme à l'état d'imperfection de nos connoissances, lorsque nous disons que le calorique communique une force répulsive aux molécules des corps.
28
CHAPITRE II.
Vues générales sur la formation & la constitution de l'atmosphère de la terre.
Les considérations que je viens de présenter sur la formation des fluides élastiques aériformes ou gaz, jettent un grand jour sur la manière dont se sont formées, dans l'origine des choses, les atmosphères des planètes, & notamment celle de la terre. On conçoit que cette dernière doit être le résultat & le mélange 1o. de toutes les substances susceptibles de se vaporiser ou plutôt de rester dans l'état aériforme, au degré de température dans lequel nous vivons, & à une pression égale au poids d'une colonne de mercure de 28 pouces de hauteur; 2o. de toutes les substances fluides ou concrètes susceptibles de se dissoudre dans cet assemblage de différens gaz.
Pour mieux fixer nos idées relativement à cette matière sur laquelle on n'a point encore assez réfléchi, considérons un moment ce qui arriveroit aux différentes substances qui composent le globe, si la température en étoit brusquement changée. Supposons, par exemple, que la terre se trouvât transportée tout à coup dans une région 29 beaucoup plus chaude du systême solaire; dans la région de mercure, par exemple, où la chaleur habituelle est probablement fort supérieure à celle de l'eau bouillante: bientôt l'eau, tous les fluides susceptibles de se vaporiser à des degrés voisins de l'eau bouillante, & le mercure lui-même, entreroient en expansion; ils se transformeroient en fluides aériformes ou gaz, qui deviendroient parties de l'atmosphère. Ces nouvelles espèces d'air se mêleroient avec celles déjà existantes, & il en résulteroit des décompositions réciproques, des combinaisons nouvelles, jusqu'à ce que les différentes affinités se trouvant satisfaites, les principes qui composeroient ces différens airs ou gaz, arrivassent à un état de repos. Mais une considération qui ne doit pas échapper, c'est que cette vaporisation même auroit des bornes: en effet à mesure que la quantité des fluides élastiques augmenteroit, la pesanteur de l'atmosphère s'accroîtroit en proportion: or, puisqu'une pression quelconque est un obstacle à la vaporisation, puisque les fluides les plus évaporables peuvent résister, sans se vaporiser, à une chaleur très-forte, quand on y oppose une pression proportionnellement plus forte encore; enfin, puisque l'eau elle-même & tous les liquides, peuvent éprouver dans la machine de 30 Papin, une chaleur capable de les faire rougir, on conçoit que la nouvelle atmosphère arriveroit à un degré de pesanteur tel, que l'eau qui n'auroit pas été vaporisée jusqu'alors, cesseroit de bouillir, & resteroit dans l'état de liquidité; en sorte que même dans cette supposition, comme dans toute autre de même genre, la pesanteur de l'atmosphère seroit limitée & ne pourroit pas excéder un certain terme. On pourroit porter ces réflexions beaucoup plus loin, & examiner ce qui arriveroit aux pierres, aux sels, & à la plus grande partie des substances fusibles qui composent le globe: on conçoit qu'elles se ramolliroient, qu'elles entreroient en fusion & formeroient des fluides; mais ces dernières considérations sortent de mon objet, & je me hâte d'y rentrer.
Par un effet contraire, si la terre se trouvoit tout à coup placée dans des régions très-froides, l'eau qui forme aujourd'hui nos fleuves & nos mers, & probablement le plus grand nombre des fluides que nous connoissons, se transformeroit en montagnes solides, en rochers très-durs, d'abord diaphanes, homogènes & blancs comme le cristal de roche; mais qui, avec le temps, se mêlant avec des substances de différente nature, deviendroient des pierres opaques diversement colorées. 31
L'air, dans cette supposition, ou au moins une partie des substances aériformes qui le composent, cesseroient sans doute d'exister dans l'état de vapeurs élastiques, faute d'un degré de chaleur suffisant; elles reviendroient donc à l'état de liquidité, & il en résulteroit de nouveaux liquides dont nous n'avons aucune idée.
Ces deux suppositions extrêmes font voir clairement 1o. que solidité, liquidité, élasticité, sont trois états différens de la même matière, trois modifications particulières, par lesquelles presque toutes les substances peuvent successivement passer, & qui dépendent uniquement du degré de chaleur auquel elles sont exposées, c'est-à-dire, de la quantité de calorique dont elles sont pénétrées; 2o. qu'il est très-probable que l'air est un fluide naturellement en vapeurs, ou pour mieux dire, que notre atmosphère est un composé de tous les fluides susceptibles d'exister dans un état de vapeurs & d'élasticité constante, au degré habituel de chaleur & de pression que nous éprouvons; 3o. qu'il ne seroit pas par conséquent impossible qu'il se rencontrât dans notre atmosphère des substances extrêmement compactes, des métaux même, & qu'une substance métallique, par exemple, qui seroit un peu plus volatile que le mercure, seroit dans ce cas. 32
On sait que parmi les fluides que nous connoissons, les uns, comme l'eau & l'alkool ou esprit-de-vin, sont susceptibles de se mêler les uns avec les autres dans toutes proportions: les autres, au contraire, comme le mercure, l'eau & l'huile, ne peuvent contracter que des adhérences momentanées, ils se séparent les uns des autres lorsqu'ils ont été mêlangés, & se rangent en raison de leur gravité spécifique. La même chose doit, ou au moins peut arriver dans l'atmosphère: il est possible, il est même probable qu'il s'est formé dans l'origine & qu'il se forme tous les jours des gaz qui ne sont que difficilement miscibles à l'air de l'atmosphère & qui s'en séparent; si ces gaz sont plus légers, ils doivent se rassembler dans les régions élevées, & y former des couches qui nagent sur l'air atmosphérique. Les phénomènes qui accompagnent les météores ignés me portent à croire qu'il existe ainsi dans le haut de l'atmosphère une couche d'un fluide inflammable, & que c'est au point de contact de ces deux couches d'air que s'opèrent les phénomènes de l'aurore boréale & des autres météores ignés. Je me propose de développer mes idées à cet égard dans un Mémoire particulier.
33
CHAPITRE III.
Analyse de l'air de l'atmosphère: sa résolution en deux fluides élastiques, l'un respirable, l'autre non-respirable.
Telle est donc à priori la constitution de notre atmosphère; elle doit être formée de la réunion de toutes les substances susceptibles de demeurer dans l'état aériforme au degré habituel de température & de pression que nous éprouvons. Ces fluides forment une masse de nature à peu près homogène, depuis la surface de la terre jusqu'à la plus grande hauteur à laquelle on soit encore parvenu, & dont la densité décroît en raison inverse des poids dont elle est chargée; mais comme je l'ai dit, il est possible que cette première couche soit recouverte d'une ou de plusieurs autres de fluides très-différens.
Il nous reste maintenant à déterminer quel est le nombre & quelle est la nature des fluides élastiques qui composent cette couche inférieure que nous habitons; & c'est sur quoi l'expérience va nous éclairer. La Chimie moderne a fait à cet égard un grand pas; & les détails dans lesquels je vais entrer feront connoître 34 que l'air de l'atmosphère est peut-être de toutes les substances de cet ordre, celle dont l'analyse est la plus exactement & la plus rigoureusement faite.
La Chimie présente en général deux moyens pour déterminer la nature des parties constituantes d'un corps, la composition & la décomposition. Lors, par exemple, que l'on a combiné ensemble de l'eau & de l'esprit-de-vin ou alkool, & que par le résultat de ce mêlange on a formé l'espèce de liqueur qui porte le nom d'eau-de-vie dans le commerce, on a droit d'en conclure que l'eau-de-vie est un composé d'alkool & d'eau: mais on peut arriver à la même conclusion par voie de décomposition, & en général on ne doit être pleinement satisfait en Chimie qu'autant qu'on a pu réunir ces deux genres de preuves.
On a cet avantage dans l'analyse de l'air de l'atmosphère; on peut le décomposer & le recomposer; & je me bornerai à rapporter ici les expériences les plus concluantes qui aient été faites à cet égard. Il n'en est presque aucunes qui ne me soient devenues propres, soit parce que je les ai faites le premier, soit parce que je les ai répétées sous un point de vue nouveau, sous celui d'analyser l'air de l'atmosphère.
35
J'ai pris, planche II, figure 14, un matras A de 36 pouces cubiques environ de capacité dont le col BCDE étoit très-long, & avoit six à sept lignes de grosseur intérieurement. Je l'ai courbé, comme on le voit représenté, planche IV, figure 2, de manière qu'il pût être placé dans un fourneau MMNN, tandis que l'extrêmité E de son col iroit s'engager sous la cloche FG, placée dans un bain de mercure RRSS. J'ai introduit dans ce matras quatre onces de mercure très-pur, puis en suçant avec un siphon que j'ai introduit sous la cloche FG, j'ai élevé le mercure jusqu'en LL: j'ai marqué soigneusement cette hauteur avec une bande de papier collé, & j'ai observé exactement le baromètre & le thermomètre.
Les choses ainsi préparées, j'ai allumé du feu dans le fourneau MMNN, & je l'ai entretenu presque continuellement pendant douze jours, de manière que le mercure fut échauffé presqu'au degré nécessaire pour le faire bouillir.
Il ne s'est rien passé de remarquable pendant tout le premier jour: le mercure quoique non bouillant, étoit dans un état d'évaporation continuelle; il tapissoit l'intérieur des vaisseaux de goutelettes, d'abord très-fines, qui alloient ensuite en augmentant, & qui, lorsqu'elles avoient acquis un certain volume, retomboient 36 d'elles-mêmes au fond du vase, & se réunissoient au reste du mercure. Le second jour, j'ai commencé à voir nager sur la surface du mercure de petites parcelles rouges, qui, pendant quatre ou cinq jours ont augmenté en nombre & en volume, après quoi elles ont cessé de grossir & sont restées absolument dans le même état. Au bout de douze jours voyant que la calcination du mercure ne faisoit plus aucun progrès, j'ai éteint le feu & j'ai laissé refroidir les vaisseaux. Le volume de l'air contenu tant dans le matras que dans son col & sous la partie vuide de la cloche, réduit à une pression de 28 pouces & à 10 degrés du thermomètre, étoit avant l'opération de 50 pouces cubiques environ. Lorsque l'opération a été finie, ce même volume à pression & à température égale, ne s'est plus trouvé que de 42 à 43 pouces: il y avoit eu par conséquent une diminution de volume d'un sixième environ. D'un autre côté ayant rassemblé soigneusement les parcelles rouges qui s'étoient formées, & les ayant séparées autant qu'il étoit possible du mercure coulant dont elles étoient baignées, leur poids s'est trouvé de 45 grains.
J'ai été obligé de répéter plusieurs fois cette calcination du mercure en vaisseaux clos, parce qu'il est difficile, dans une seule & même expérience, 37 de conserver l'air dans lequel on a opéré, & les molécules rouges ou chaux de mercure qui s'est formé. Il m'arrivera souvent de confondre ainsi, dans un même récit, le résultat de deux ou trois expériences de même genre.
L'air qui restoit après cette opération & qui avoit été réduit aux cinq sixièmes de son volume, par la calcination du mercure, n'étoit plus propre à la respiration ni à la combustion; car les animaux qu'on y introduisoit y périssoient en peu d'instans, & les lumières s'y éteignoient sur le champ, comme si on les eût plongées dans de l'eau.
D'un autre côté, j'ai pris les 45 grains de matière rouge qui s'étoit formée pendant l'opération; je les ai introduits dans une très-petite cornue de verre à laquelle étoit adapté un appareil propre à recevoir les produits liquides & aériformes qui pourroient se séparer: ayant allumé du feu dans le fourneau, j'ai observé qu'à mesure que la matière rouge étoit échauffée sa couleur augmentoit d'intensité. Lorsqu'ensuite la cornue a approché de l'incandescence, la matière rouge a commencé à perdre peu à peu de son volume, & en quelques minutes elle a entièrement disparu; en même temps il s'est condensé dans le petit récipient 41 grains 1/2 de mercure coulant, & il a passé sous la cloche 38 7 à 8 pouces cubiques d'un fluide élastique beaucoup plus propre que l'air de l'atmosphère à entretenir la combustion & la respiration des animaux.
Ayant fait passer une portion de cet air dans un tube de verre d'un pouce de diamètre & y ayant plongé une bougie, elle y répandoit un éclat éblouissant; le charbon au lieu de s'y consommer paisiblement comme dans l'air ordinaire, y brûloit avec flamme & une sorte de décrépitation, à la manière du phosphore, & avec une vivacité de lumière que les yeux avoient peine à supporter. Cet air que nous avons découvert presque en même temps, M. Priestley, M. Schéele & moi, a été nommé par le premier, air déphlogistiqué; par le second, air empiréal. Je lui avois d'abord donné le nom d'air éminemment respirable: depuis, on y a substitué celui d'air vital. Nous verrons bientôt ce qu'on doit penser de ces dénominations.
En réfléchissant sur les circonstances de cette expérience, on voit que le mercure en se calcinant absorbe la partie salubre & respirable de l'air, ou, pour parler d'une manière plus rigoureuse, la base de cette partie respirable; que la portion d'air qui reste est une espèce de mofète, incapable d'entretenir la combustion 39 & la respiration: l'air de l'atmosphère est donc composé de deux fluides élastiques de nature différente & pour ainsi dire opposée.
Une preuve de cette importante vérité, c'est qu'en recombinant les deux fluides élastiques qu'on a ainsi obtenus séparément, c'est-à-dire, les 42 pouces cubiques de mofète, ou air non respirable, & les 8 pouces cubiques d'air respirable, on reforme de l'air, en tout semblable à celui de l'atmosphère, & qui est propre à peu près au même degré, à la combustion, à la calcination des métaux, & à la respiration des animaux.
Quoique cette expérience fournisse un moyen infiniment simple d'obtenir séparément les deux principaux fluides élastiques qui entrent dans la composition de notre atmosphère, elle ne nous donne pas des idées exactes sur la proportion de ces deux fluides. L'affinité du mercure pour la partie respirable de l'air, ou plutôt pour sa base, n'est pas assez grande pour qu'elle puisse vaincre entièrement les obstacles qui s'opposent à cette combinaison. Ces obstacles sont l'adhérence des deux fluides constitutifs de l'air de l'atmosphère & la force d'affinité qui unit la base de l'air vital au calorique: en conséquence la calcination du mercure finie, ou au moins portée aussi loin qu'elle 40 peut l'être, dans une quantité d'air déterminée, il reste encore un peu d'air respirable combiné avec la mofète, & le mercure ne peut en séparer cette dernière portion. Je ferai voir dans la suite que la proportion d'air respirable & d'air non respirable qui entre dans la composition de l'air atmosphérique est dans le rapport de 27 à 73, au moins dans les climats que nous habitons: je discuterai en même temps les causes d'incertitude qui existent encore sur l'exactitude de cette proportion.
Puisqu'il y a décomposition de l'air dans la calcination du mercure, puisqu'il y a fixation & combinaison de la base de la partie respirable avec le mercure, il résulte des principes que j'ai précédemment exposés, qu'il doit y avoir dégagement de calorique & de lumière; & l'on ne sauroit douter que ce dégagement n'ait lieu en effet: mais deux causes empêchent qu'il ne soit rendu sensible dans l'expérience dont je viens de rendre compte. La première, parce que la calcination durant pendant plusieurs jours, le dégagement de chaleur & de lumière, réparti sur un aussi long intervalle de temps, est infiniment foible pour chaque instant en particulier: la seconde, parce que l'opération se faisant dans un fourneau & à l'aide du feu, la chaleur occasionnée par la calcination 41 se confond avec celle du fourneau. Je pourrois ajouter que la partie respirable de l'air, ou plutôt sa base, en se combinant avec le mercure, n'abandonne pas la totalité du calorique qui lui étoit uni, qu'une partie demeure engagée dans la nouvelle combinaison; mais cette discussion & les preuves que je serois obligé de rapporter, ne seroient pas à leur place ici.
Il est au surplus aisé de rendre sensible le dégagement de la chaleur & de la lumière en opérant d'une manière plus prompte la décomposition de l'air. Le fer, qui a beaucoup plus d'affinité que le mercure avec la base de la partie respirable de l'air, en fournit un moyen. Tout le monde connoît aujourd'hui la belle expérience de M. Ingenhouz sur la combustion du fer. On prend un bout de fil de fer très-fin BC, planche IV, figure 17, tourné en spirale, on fixe l'une de ses extrêmités B, dans un bouchon de liége A, destiné à boucher la bouteille DEFG. On attache à l'autre extrêmité de ce fil de fer, un petit morceau d'amadoue C. Les choses ainsi disposées, on emplit avec de l'air dépouillé de sa partie non respirable, la bouteille DEFG. On allume l'amadoue C, puis on l'introduit promptement, ainsi que le fil de fer BC dans la bouteille, & on la bouche 42 comme on le voit dans la figure que je viens de citer.
Aussi-tôt que l'amadoue est plongée dans l'air vital, elle commence à brûler avec un éclat éblouissant; elle communique l'inflammation au fer, qui brûle lui même en répandant de brillantes étincelles, lesquelles tombent au fond de la bouteille, en globules arrondis qui deviennent noirs en se refroidissant, & qui conservent un reste de brillant métallique. Le fer ainsi brûlé, est plus cassant & plus fragile, que ne le seroit le verre lui-même; il se réduit facilement en poudre & est encore attirable à l'aimant, moins cependant qu'il ne l'étoit avant sa combustion.
M. Ingenhouz n'a examiné ni ce qui arrivoit au fer, ni ce qui arrivoit à l'air dans cette opération, en sorte que je me suis trouvé obligé de la répéter avec des circonstances différentes & dans un appareil plus propre à répondre à mes vues.
J'ai rempli une cloche A, planche IV, fig. 3, de six pintes environ de capacité d'air pur, autrement dit, de la partie éminemment respirable de l'air. J'ai transporté, à l'aide d'un vase très-plat, cette cloche sur un bain de mercure contenu dans le bassin BC; après quoi j'ai séché soigneusement avec du papier gris la surface du mercure, 43 tant dans l'intérieur qu'à l'extérieur de la cloche. Je me suis muni, d'un autre côté, d'une petite capsule de porcelaine D, plate & évasée, dans laquelle j'ai placé de petits coupeaux de fer tournés en spirale, & que j'ai arrangés de la manière qui m'a paru la plus favorable pour que la combustion se communiquât à toutes les parties. A l'extrêmité d'un de ces coupeaux, j'ai attaché un petit morceau d'amadoue, & j'y ai ajouté un fragment de phosphore, qui pesoit à peine un seizième de grain. J'ai introduit la capsule sous la cloche en soulevant un peu cette dernière. Je n'ignore pas que par cette manière de procéder, il se mêle une petite portion d'air commun avec l'air de la cloche; mais ce mêlange, qui est peu considérable lorsqu'on opère avec adresse, ne nuit point au succès de l'expérience.
Lorsque la capsule D est introduite sous la cloche, on succe une partie de l'air qu'elle contient, afin d'élever le mercure dans son intérieur jusqu'en EF; on se sert à cet effet d'un siphon GHI, qu'on passe par-dessous, & pour qu'il ne se remplisse pas de mercure, on tortille un petit morceau de papier à son extrêmité. Il y a un art pour élever ainsi en suçant le mercure sous la cloche: si on se contentoit d'aspirer l'air avec le poumon, on n'atteindroit qu'à une 44 très-médiocre élévation, par exemple, d'un pouce ou d'un pouce & demi tout au plus, tandis que par l'action des muscles de la bouche on élève, sans se fatiguer, ou au moins sans risquer de s'incommoder, le mercure jusqu'à 6 à 7 pouces.
Après que tout a été ainsi préparé, on fait rougir au feu un fer recourbé MN, planche IV, figure 16, destiné à ces sortes d'expériences; on le passe par-dessous la cloche & avant qu'il ait eu le temps de se refroidir, on l'approche du petit morceau de phosphore contenu dans la capsule de porcelaine D: aussi-tôt le phosphore s'allume, il communique son inflammation à l'amadoue, & celle-ci la communique au fer. Quand les copeaux ont été bien arrangés, tout le fer brûle jusqu'au dernier atôme, en répandant une lumière blanche, brillante, & semblable à celle qu'on observe dans les étoiles d'artifice Chinois. La grande chaleur qui s'opère pendant cette combustion, liquéfie le fer, & il tombe en globules ronds de grosseur différente, dont le plus grand nombre reste dans la capsule, & dont quelques-uns sont lancés au dehors & nagent sur la surface du mercure.
Dans le premier instant de la combustion il y a une légère augmentation dans le volume de l'air, en raison de la dilatation occasionnée 45 par la chaleur: mais bientôt une diminution rapide succède à la dilatation; le mercure remonte dans la cloche, & lorsque la quantité de fer est suffisante, & que l'air avec lequel on opère est bien pur, on parvient à l'absorber presqu'en entier.
Je dois avertir ici qu'à moins qu'on ne veuille faire des expériences de recherches, il vaut mieux ne brûler que des quantités médiocres de fer. Quand on veut pousser trop loin l'expérience & absorber presque tout l'air, la capsule D qui nage sur le mercure, se rapproche trop de la voûte de la cloche, & la grande chaleur jointe au refroidissement subit, occasionné par le contact du mercure, fait éclater le verre: le poids de la colonne de mercure qui vient à tomber rapidement, dès qu'il s'est fait une félure à la cloche, occasionne un flot qui fait jaillir une grande partie de ce fluide hors du bassin. Pour éviter ces inconvéniens & être sûr du succès de l'expérience, on ne doit guère brûler plus d'un gros & demi de fer sous une cloche de huit pintes de capacité. Cette cloche doit être forte, afin de résister au poids de mercure qu'elle est destinée à contenir.
Il n'est pas possible de déterminer à la fois dans cette expérience, le poids que le fer acquiert, & les changemens arrivés à l'air. Si c'est 46 l'augmentation de poids du fer & son rapport avec l'absorption de l'air, dont on cherche à connoître la quantité, on doit avoir soin de marquer très-exactement sur la cloche, avec un trait de diamant, la hauteur du mercure avant & après l'expérience; on passe ensuite sous la cloche le siphon GH, planche IV, figure 3, garni d'un papier qui empêche qu'il ne s'emplisse de mercure. On met le pouce sur l'extrêmité G, & on rend l'air peu à peu en soulevant le pouce. Lorsque le mercure est descendu à son niveau, on enlève doucement la cloche; on détache de la capsule les globules de fer qui y sont contenus; on rassemble soigneusement ceux qui pourroient s'être éclaboussés & qui nagent sur le mercure, & on pèse le tout. Ce fer est dans l'état de ce que les anciens Chimistes ont nommé éthiops martial; il a une sorte de brillant métallique; il est très-cassant, très-friable, & se réduit en poudre sous le marteau & sous le pilon. Lorsque l'opération a bien réussi, avec 100 grains de fer on obtient 135 à 136 grains d'éthiops. On peut donc compter sur une augmentation de poids au moins de 35 livres par quintal.
Si l'on a donné à cette expérience toute l'attention qu'elle mérite, l'air se trouve diminué d'une quantité en poids exactement égale à celle dont le fer est augmenté. Si donc on a 47 brûlé 100 grains de fer & que l'augmentation de poids que ce métal a acquise ait été de 35 grains, la diminution du volume de l'air est assez exactement de 70 pouces cubiques à raison d'un demi-grain par pouce cube. On verra dans la suite de ces Mémoires, que le poids de l'air vital est en effet, assez exactement, d'un demi-grain par pouce cube.
Je rappellerai ici une dernière fois que dans toutes les expériences de ce genre, on ne doit point oublier de ramener par le calcul le volume de l'air au commencement & à la fin de l'expérience à celui qu'on auroit eu à 10 degrés du thermomètre, & à une pression de 28 pouces: j'entrerai dans quelques détails sur la manière de faire ces corrections, à la fin de cet Ouvrage.
Si c'est sur la qualité de l'air restant dans la cloche, qu'on se propose de faire des expériences, on opère d'une manière un peu différente. On commence alors, après que la combustion est faite & que les vaisseaux sont refroidis, par retirer le fer & la capsule qui le contenoit en passant la main sous la cloche à travers le mercure: ensuite on introduit sous cette même cloche, de la potasse ou alkali caustique, dissous dans l'eau, du sulfure de potasse, ou telle autre substance qu'on juge à propos, pour examiner l'action qu'elles exercent 48 sur l'air. Je reviendrai dans la suite sur ces moyens d'analyse de l'air, quand j'aurai fait connoître la nature de ces différentes substances, dont je ne parle qu'accidentellement dans ce moment. On finit par introduire sous cette même cloche, autant d'eau qu'il est nécessaire pour déplacer tout le mercure; après quoi on passe dessous un vaisseau ou espèce de capsule très-platte avec laquelle on la transporte dans l'appareil pneumato-chimique ordinaire à l'eau, où l'on opère plus en grand & avec plus de facilité.
Lorsqu'on a employé du fer très-doux & très-pur, & que la portion respirable de l'air dans lequel s'est faite la combustion, étoit exempte de tout mêlange d'air non respirable, l'air qui reste après la combustion, se trouve aussi pur qu'il l'étoit avant la combustion; mais il est rare que le fer ne contienne pas une petite quantité de matière charbonneuse: l'acier sur-tout en contient toujours. Il est de même extrêmement difficile d'obtenir la portion respirable de l'air parfaitement pure, elle est presque toujours mêlée d'une petite portion de la partie non respirable, mais cette espèce de mofète ne trouble en rien le résultat de l'expérience, & elle se retrouve à la fin en même quantité qu'au commencement.
49
J'ai annoncé qu'on pouvoit déterminer de deux manières la nature des parties constituantes de l'air de l'atmosphère; par voie de décomposition & par voie de composition. La calcination du mercure nous a fourni l'exemple de l'une & de l'autre, puisqu'après avoir enlevé à la partie respirable sa base par le mercure, nous la lui avons rendue pour reformer de l'air en tout semblable à celui de l'atmosphère. Mais on peut également opérer cette composition de l'air en empruntant de différens règnes les matériaux qui doivent le former. On verra dans la suite que lorsqu'on dissout des matières animales dans de l'acide nitrique, il se dégage une grande quantité d'un air qui éteint les lumières, qui est nuisible pour les animaux, & qui est en tout semblable à la partie non respirable de l'air de l'atmosphère. Si à 73 parties de ce fluide élastique on en ajoute 27 d'air éminemment respirable tiré du mercure, réduit en chaux rouge par la calcination, on forme un fluide élastique parfaitement semblable à celui de l'atmosphère & qui en a toutes les propriétés.
Il y a beaucoup d'autres moyens de séparer la partie respirable de l'air de la partie non respirable; mais je ne pourrois les exposer ici sans emprunter des notions, qui, dans 50 l'ordre des connoissances, appartiennent aux Chapitres suivans. Les expériences d'ailleurs que j'ai rapportées, suffisent pour un Traité Elémentaire; & dans ces sortes de matières, le choix des preuves est plus important que leur nombre.
Je terminerai cet article en indiquant une propriété qu'a l'air de l'atmosphère & qu'ont en général tous les fluides élastiques ou gaz que nous connoissons; c'est celle de dissoudre l'eau. La quantité d'eau qu'un pied cube d'air de l'atmosphère peut dissoudre, est suivant les expériences de M. de Saussure, de 12 grains: d'autres fluides élastiques, tels que l'acide carbonique, paroissent en dissoudre davantage; mais on n'a point fait encore d'expériences exactes pour en déterminer la quantité. Cette eau que contiennent les fluides élastiques aériformes, donne lieu dans quelques expériences à des phénomènes particuliers qui méritent beaucoup d'attention, & qui ont souvent jetté les Chimistes dans de grandes erreurs.

51
CHAPITRE IV.
Nomenclature des différentes parties constitutives de l'air de l'atmosphère.
Jusqu'ici j'ai été forcé de me servir de périphrases pour désigner la nature des différentes substances qui composent notre atmosphère, & j'ai adopté provisoirement ces expressions, partie respirable, partie non respirable de l'air. Les détails dans lesquels je vais entrer, exigent que je prenne une marche plus rapide, & qu'après avoir cherché à donner des idées simples des différentes substances qui entrent dans la composition de l'air de l'atmosphère, je les exprime également par des mots simples.
La température de la planette que nous habitons se trouvant très-voisine du degré où l'eau passe de l'état liquide à l'état solide, & réciproquement, & ce phénomène s'opérant fréquemment sous nos yeux, il n'est pas étonnant que dans toutes les langues, au moins dans les climats où l'on éprouve une sorte d'hiver, on ait donné un nom à l'eau devenue solide par l'absence du calorique.
Mais il n'a pas dû en être de même de l'eau réduite à l'état de vapeur par une plus grande 52 addition de calorique. Ceux qui n'ont pas fait une étude particulière de ces objets, ignorent encore, qu'à un degré un peu supérieur à celui de l'eau bouillante, l'eau se transforme en un fluide élastique aériforme, susceptible comme tous les gaz, d'être reçu & contenu dans des vaisseaux, & qui conserve sa forme gazeuse tant qu'il éprouve une température supérieure à 80 degrés, jointe à une pression égale à celle d'une colonne de 28 pouces de mercure. Ce phénomène ayant échappé à la multitude, aucune langue n'a désigné l'eau dans cet état par un nom particulier; & il en est de même de tous les fluides, & en général, de toutes les substances qui ne sont point susceptibles de se vaporiser au degré habituel de température & de pression dans lequel nous vivons.
Par une suite de la même cause on n'a point donné de nom à la plupart des fluides aériformes dans l'état liquide ou concret; on ignoroit que ces fluides fussent le résultat de la combinaison d'une base avec le calorique; & comme on ne les avoit jamais vus dans l'état de liquide ni de solide, leur existence sous cette forme étoit inconnue même des Physiciens.
Nous n'avons pas jugé qu'il nous fût permis de changer des noms reçus & consacrés dans la société par un antique usage. Nous avons 53 donc attaché au mot d'eau & de glace, leur signification vulgaire; nous avons de même exprimé par le mot d'air la collection des fluides élastiques qui composent notre atmosphère; mais nous ne nous sommes pas cru obligés au même respect pour des dénominations très-modernes nouvellement proposées par les Physiciens. Nous avons pensé que nous étions en droit de les rejetter & de leur en substituer d'autres moins propres à induire en erreur; & lors même que nous nous sommes déterminés à les adopter, nous n'avons fait aucune difficulté de les modifier & d'y attacher des idées mieux arrêtées & plus circonscrites.
C'est principalement du Grec que nous avons tiré les mots nouveaux, & nous avons fait en sorte que leur étymologie rappelât l'idée des choses que nous nous proposions d'indiquer; nous nous sommes attachés sur-tout à n'admettre que des mots courts, & autant qu'il étoit possible, qui fussent susceptibles de former des adjectifs & des verbes.
D'après ces principes, nous avons conservé à l'exemple de M. Macquer, le nom de gaz employé par Vanhelmont, & nous avons rangé sous cette dénomination, la classe nombreuse des fluides élastiques aériformes, en faisant cependant une exception pour l'air de l'atmosphère. 54 Le mot gaz est donc pour nous un nom générique, qui désigne le dernier degré de saturation d'une substance quelconque par le calorique; c'est l'expression d'une manière d'être des corps. Il s'agissoit ensuite de spécifier chaque espèce de gaz, & nous y sommes parvenus en empruntant un second nom de celui de sa base. Nous appellerons donc gaz aqueux, l'eau combinée avec le calorique, & dans l'état de fluide élastique aériforme: la combinaison de l'éther avec le calorique, sera le gaz éthéré; celle de l'esprit-de-vin avec le calorique, sera le gaz alkoolique; nous aurons de même le gaz acide muriatique, le gaz ammoniaque, & ainsi de tous les autres. Je m'étendrai davantage sur cet article quand il sera question de nommer les différentes bases.
On a vu que l'air de l'atmosphère étoit principalement composé de deux fluides aériformes ou gaz, l'un respirable, susceptible d'entretenir la vie des animaux, dans lequel les métaux se calcinent & les corps combustibles peuvent brûler; l'autre qui a des propriétés absolument opposées, que les animaux ne peuvent respirer, qui ne peut entretenir la combustion, &c. Nous avons donné à la base de la portion respirable de l'air le nom d'oxygène, en le dérivant de deux mots Grecs οξυς, 55 acide, & γεινομαι, j'engendre, parce qu'en effet une des propriétés les plus générales de cette base est de former des acides, en se combinant avec la plupart des substances. Nous appellerons donc gaz oxygène la réunion de cette base avec le calorique: sa pesanteur dans cet état est assez exactement d'un demi-grain poids de marc, par pouce cube, ou d'une once & demie par pied cube, le tout à 10 degrés de température, & à 28 pouces du baromètre.
Les propriétés chimiques de la partie non respirable de l'air de l'atmosphère n'étant pas encore très-bien connues, nous nous sommes contentés de déduire le nom de sa base de la propriété qu'a ce gaz de priver de la vie les animaux qui le respirent: nous l'avons donc nommé azote, de l'α privatif des Grecs, & de ζοη, vie, ainsi la partie non respirable de l'air sera le gaz azotique. Sa pesanteur est d'une once, 2 gros, 48 grains le pied cube, ou de 0,4444 grain le pouce cube.
Nous ne nous sommes pas dissimulé que ce nom présentoit quelque chose d'extraordinaire; mais c'est le sort de tous les noms nouveaux; ce n'est que par l'usage qu'on se familiarise avec eux. Nous en avons d'ailleurs cherché long-temps un meilleur, sans qu'il nous ait été possible de le rencontrer: nous avions été 56 tentés d'abord de le nommer gaz alkaligène, parce qu'il est prouvé, par les expériences de M. Berthollet, comme on le verra dans la suite, que ce gaz entre dans la composition de l'alkali volatil ou ammoniaque: mais d'un autre côté, nous n'avons point encore la preuve qu'il soit un des principes constitutifs des autres alkalis: il est d'ailleurs prouvé qu'il entre également dans la combinaison de l'acide nitrique; on auroit donc été tout aussi fondé à le nommer principe nitrigène. Enfin nous avons dû rejetter un nom qui comportoit une idée systématique, & nous n'avons pas risqué de nous tromper en adoptant celui d'azote & de gaz azotique, qui n'exprime qu'un fait ou plutôt qu'une propriété, celle de priver de la vie les animaux qui respirent ce gaz.
J'anticiperois sur des notions réservées pour des articles subséquens, si je m'étendois davantage sur la nomenclature des différentes espèces de gaz. Il me suffit d'avoir donné ici, non la dénomination de tous, mais la méthode de les nommer tous. Le mérite de la nomenclature que nous avons adoptée, consiste principalement en ce que la substance simple étant nommée, le nom de tous ses composés découle nécessairement de ce premier mot.
57
CHAPITRE V.
De la décomposition du gaz oxygène par le soufre, le phosphore & le charbon, & de la formation des acides en général.
Un des principes qu'on ne doit jamais perdre de vue dans l'art de faire des expériences, est de les simplifier le plus qu'il est possible & d'en écarter toutes les circonstances qui peuvent en compliquer les effets. Nous n'opérerons donc pas, dans les expériences qui vont faire l'objet de ce Chapitre, sur de l'air de l'atmosphère, qui n'est point une substance simple. Il est bien vrai que le gaz azotique, qui fait une partie du mêlange qui le constitue, paroît être purement passif dans les calcinations & les combustions: mais, comme il les rallentit, & comme il n'est pas impossible même qu'il en altère les résultats dans quelques circonstances, il m'a paru nécessaire de bannir cette cause d'incertitude.
J'exposerai donc, dans les expériences dont je vais rendre compte, le résultat des combustions tel qu'il a lieu dans l'air vital ou gaz oxigène pur, & j'avertirai seulement des différences 58 qu'elles présentent quand le gaz oxygène est mêlé de différentes proportions de gaz azotique.
J'ai pris une cloche de cristal A, planche IV, figure 3, de cinq à six pintes de capacité; je l'ai emplie de gaz oxygène sur de l'eau, après quoi je l'ai transportée sur le bain de mercure au moyen d'une capsule de verre que j'ai passée par dessous; j'ai ensuite seché la surface du mercure & j'y ai introduit 61 grains 1/4 de phosphore de Kunkel, que j'ai divisés dans deux capsules de porcelaine, semblables à celle qu'on voit en D, figure 3, sous la cloche A; & pour pouvoir allumer chacune de ces deux portions séparément, & que l'inflammation ne se communiquât pas de l'une à l'autre, j'ai recouvert l'une des deux avec un petit carreau de verre. Lorsque tout a été ainsi préparé, j'ai élevé le mercure dans la cloche à la hauteur EF, en suçant avec un siphon de verre GHI, même figure, qu'on introduit par-dessous la cloche: pour qu'il ne se remplisse pas en passant à travers le mercure, on tortille à son extrêmité I, un petit morceau de papier. Puis avec un fer recourbé rougi au feu, représenté figure 16, j'ai allumé successivement le phosphore des deux capsules, en commençant par celle qui n'étoit point recouverte avec un carreau de verre. 59
La combustion s'est faite avec une grande rapidité, avec une flamme brillante & un dégagement considérable de chaleur & de lumière. Il y a eu dans le premier instant une dilatation considérable du gaz oxygène, occasionnée par la chaleur; mais bientôt le mercure a remonté au-dessus de son niveau, & il y a eu une absorption considérable: en même temps tout l'intérieur de la cloche s'est tapissé de flocons blancs, légers, qui n'étoient autre chose que de l'acide phosphorique concret.
La quantité de gaz oxygène employée, étoit, toutes corrections faites, au commencement de l'expérience, de 162 pouces cubiques; elle s'est trouvée à la fin seulement de 23 pouces 1/4: la quantité de gaz oxygène absorbée avoit donc été de 138 pouces 3/4 ou de 69,375 grains.
La totalité du phosphore n'étoit pas brûlée; il en restoit dans les capsules quelques portions, qui, lavées, pour en séparer l'acide, & séchées, se sont trouvées peser environ 16 grains 1/4: ce qui réduit à peu près à 45 grains la quantité de phosphore brûlée: je dis à peu près, parce qu'il ne seroit pas impossible qu'il n'y eût eu un ou deux grains d'erreur sur le poids du phosphore restant après la combustion.
Ainsi dans cette opération, 45 grains de 60 phosphore se sont combinés avec 69,375 grains d'oxygène; & comme rien de pesant ne passe à travers le verre, on a droit d'en conclure que le poids de la substance quelconque qui a résulté de cette combinaison & qui s'étoit rassemblée en flocons blancs, devoit s'élever à la somme du poids de l'oxygène & de celui du phosphore, c'est-à-dire, à 114,375 grains. On verra bientôt que ces flocons blancs ne sont autre chose qu'un acide concret. En réduisant ces quantités au quintal, on trouve qu'il faut employer 154 liv. d'oxygène pour saturer 100 liv. de phosphore, & qu'il en résulte 254 liv. de flocons blancs ou acide phosphorique concret.
Cette expérience prouve d'une manière évidente, qu'à un certain degré de température, l'oxygène a plus d'affinité avec le phosphore qu'avec le calorique; qu'en conséquence le phosphore décompose le gaz oxygène, qu'il s'empare de sa base, & qu'alors le calorique, qui devient libre, s'échappe & se dissipe en se répartissant dans les corps environnans.
Mais quelque concluante que fût cette expérience, elle n'étoit pas encore suffisamment rigoureuse: en effet, dans l'appareil que j'ai employé & que je viens de décrire, il n'est pas possible de vérifier le poids des flocons 61 blancs ou de l'acide concret qui s'est formé; on ne peut le conclure que par voie de calcul & en le supposant égal à la somme du poids de l'oxygène & du phosphore: or quelqu'évidente que fût cette conclusion, il n'est jamais permis en Physique & en Chimie, de supposer ce qu'on peut déterminer par des expériences directes. J'ai donc cru devoir refaire cette expérience un peu plus en grand, & avec un appareil différent.
J'ai pris un grand ballon de verre A, planche IV, figure 4, dont l'ouverture EF avoit trois pouces de diamètre. Cette ouverture se recouvroit avec une plaque de cristal usée à l'émeril, laquelle étoit percée de deux trous pour le passage des tuyaux yyy, xxx.
Avant de fermer le ballon avec sa plaque, j'y ai introduit un support BC surmonté d'une capsule de porcelaine D, qui contenoit 150 grains de phosphore: tout étant ainsi disposé, j'ai adapté la plaque de cristal sur l'ouverture du matras, & j'ai lutté avec du lut gras, que j'ai recouvert avec des bandes de linge imbibées de chaux & de blanc d'œuf: lorsque ce lut a été bien séché, j'ai suspendu tout cet appareil au bras d'une balance, & j'en ai déterminé le poids à un grain ou un grain & demi près. J'ai ensuite adapté le tuyau xxx, 62 à une petite pompe pneumatique, & j'ai fait le vuide; après quoi ouvrant un robinet adapté au tuyau yyy, j'ai introduit du gaz oxygène dans le ballon. J'observerai que ce genre d'expérience se fait avec assez de facilité & sur-tout avec beaucoup d'exactitude, au moyen de la machine hydro-pneumatique dont nous avons donné la description, M. Meusnier & moi, dans les Mémoires de l'Académie, année 1782, page 466, & dont on trouvera une explication dans la dernière Partie de cet Ouvrage; qu'on peut à l'aide de cet instrument, auquel M. Meusnier a fait depuis des additions & des corrections importantes, connoître d'une manière rigoureuse, la quantité de gaz oxygène introduite dans le ballon, & celle qui s'est consommée pendant le cours de l'opération.
Lorsque tout a été ainsi disposé, j'ai mis le feu au phosphore avec un verre ardent. La combustion a été extrêmement rapide, accompagnée d'une grande flamme & de beaucoup de chaleur: à mesure qu'elle s'opéroit, il se formoit une grande quantité de flocons blancs qui s'attachoient sur les parois intérieures du vase, & qui bientôt l'ont obscurci entièrement. L'abondance des vapeurs étoit même telle, que quoiqu'il rentrât continuellement de nouveau gaz oxygène qui auroit dû entretenir la 63 combustion, le phosphore s'est bientôt éteint. Ayant laissé refroidir parfaitement tout l'appareil, j'ai commencé par m'assurer de la quantité de gaz oxygène qui avoit été employée, & par peser le ballon avant de l'ouvrir. J'ai ensuite lavé, séché & pesé la petite quantité de phosphore qui étoit restée dans la capsule, & qui étoit de couleur jaune d'ocre, afin de la déduire de la quantité totale de phosphore employée dans l'expérience. Il est clair qu'à l'aide de ces différentes précautions, il m'a été facile de constater, 1o. le poids du phosphore brûlé; 2o. celui des flocons blancs obtenus par la combustion; 3o. le poids du gaz oxygène qui s'étoit combiné avec le phosphore. Cette expérience m'a donné à peu près les mêmes résultats que la précédente: il en a également résulté que le phosphore en brûlant, absorboit un peu plus d'une fois & demie son poids d'oxygène, & j'ai acquis de plus la certitude que le poids de la nouvelle substance produite étoit égal à la somme du poids du phosphore brûlé & de l'oxygène qu'il avoit absorbé: ce qu'il étoit au surplus facile de prévoir à priori.
Si le gaz oxygène qu'on a employé dans cette expérience étoit pur, le résidu qui reste après la combustion est également pur; ce qui prouve qu'il ne s'échappe rien du phosphore 64 qui puisse altérer la pureté de l'air, & qu'il n'agit qu'en enlevant au calorique sa base, c'est-à-dire, l'oxygène qui y étoit uni.
J'ai dit plus haut que si on brûloit un corps combustible quelconque dans une sphère creuse de glace ou dans tout autre appareil construit sur le même principe, la quantité de glace fondue pendant la combustion, étoit une mesure exacte de la quantité de calorique dégagé. On peut consulter à cet égard le Mémoire que nous avons donné en commun à l'Académie, M. de la Place & moi, année 1780, page 355. Ayant soumis la combustion du phosphore à cette épreuve, nous avons reconnu qu'une livre de phosphore en brûlant, fondoit un peu plus de 100 liv. de glace.
La combustion du phosphore réussit également dans l'air de l'atmosphère, avec ces deux différences seulement, 1o. que la combustion est beaucoup moins rapide, attendu qu'elle est rallentie par la grande proportion de gaz azotique qui se trouve mêlé avec le gaz oxygène: 2o. que le cinquième de l'air, tout au plus, est seulement absorbé, parce que cette absorption se faisant toute aux dépens du gaz oxygène, la proportion du gaz azotique devient telle vers la fin de l'opération, que la combustion ne peut plus avoir lieu. 65
Le phosphore par sa combustion, soit dans l'air ordinaire, soit dans le gaz oxygène, se transforme, comme je l'ai déjà dit, en une matière blanche floconneuse très-légère, & il acquiert des propriétés toutes nouvelles: d'insoluble qu'il étoit dans l'eau, non-seulement il devient soluble, mais il attire l'humidité contenue dans l'air avec une étonnante rapidité, & il se résout en une liqueur beaucoup plus dense que l'eau, & d'une pesanteur spécifique beaucoup plus grande. Dans l'état de phosphore, & avant sa combustion, il n'avoit presqu'aucun goût; par sa réunion avec l'oxygène il prend un goût extrêmement aigre & piquant: enfin, de la classe des combustibles, il passe dans celle des substances incombustibles, & il devient ce qu'on appelle un acide.
Cette conversibilité d'une substance combustible en un acide par l'addition de l'oxygène, est, comme nous le verrons bientôt, une propriété commune à un grand nombre de corps: or en bonne logique, on ne peut se dispenser de désigner sous un nom commun toutes les opérations qui présentent des résultats analogues; c'est le seul moyen de simplifier l'étude des Sciences, & il seroit impossible d'en retenir tous les détails, si on ne s'attachoit à les classer. Nous nommerons donc oxygénation la 66 conversion du phosphore en un acide, & en général la combinaison d'un corps combustible quelconque avec l'oxygène.
Nous adopterons également l'expression d'oxygéner, & je dirai en conséquence qu'en oxygénant le phosphore, on le convertit en un acide.
Le soufre est également un corps combustible, c'est-à-dire, qui a la propriété de décomposer l'air, & d'enlever l'oxygène au calorique. On peut s'en assurer aisément par des expériences toutes semblables à celles que je viens de détailler pour le phosphore; mais je dois avertir qu'il est impossible, en opérant de la même manière sur le soufre, d'obtenir des résultats aussi exacts que ceux qu'on obtient avec le phosphore; par la raison que l'acide qui se forme par la combustion du soufre est difficile à condenser, que le soufre lui-même brûle avec beaucoup de difficulté, & qu'il est susceptible de se dissoudre dans les différens gaz. Mais ce que je puis assurer, d'après mes expériences, c'est que le soufre en brûlant, absorbe de l'air; que l'acide qui se forme est beaucoup plus pesant que n'étoit le soufre; que son poids est égal à la somme du poids du soufre, & de l'oxygène qu'il a absorbé; enfin, que cet acide est pesant, incombustible, susceptible de se combiner avec 67 l'eau en toutes proportions: il ne reste d'incertitude que sur la quantité de soufre & d'oxygène qui constituent cet acide.
Le charbon, que tout jusqu'à présent porte à faire regarder comme une substance combustible simple, a également la propriété de décomposer le gaz oxygène & d'enlever sa base au calorique: mais l'acide qui résulte de cette combustion ne se condense pas au degré de pression & de température dans lequel nous vivons; il demeure dans l'état de gaz, & il faut une grande quantité d'eau pour l'absorber. Cet acide, au surplus, a toutes les propriétés communes aux acides, mais dans un degré plus foible, & il s'unit comme eux à toutes les bases susceptibles de former des sels neutres.
On peut opérer la combustion du charbon, comme celle du phosphore, sous une cloche de verre A, planche IV, figure 3, remplie de gaz oxygène, & renversée dans du mercure: mais comme la chaleur d'un fer chaud & même rouge, ne suffiroit pas pour l'allumer, on ajoute par-dessus le charbon, un petit fragment d'amadoue & un petit atome de phosphore. On allume facilement le phosphore avec un fer rouge; l'inflammation se communique ensuite à l'amadoue, puis au charbon.
On trouve le détail de cette expérience, 68 Mémoires de l'Académie, année 1781, page 448. On y verra qu'il faut 72 parties d'oxygène en poids, pour en saturer 28 de charbon, & que l'acide aériforme qui est produit, a une pesanteur justement égale à la somme des poids du charbon & de l'oxygène qui ont servi à le former. Cet acide aériforme a été nommé air fixe, ou air fixé par les premiers Chimistes qui l'ont découvert; ils ignoroient alors si c'étoit de l'air semblable à celui de l'atmosphère ou un autre fluide élastique, vicié & gâté par la combustion; mais puisqu'il est constant aujourd'hui que cette substance aériforme est un acide, qu'il se forme comme tous les autres acides, par l'oxygénation d'une base, il est aisé de voir que le nom d'air fixe ne lui convient point.
Ayant essayé, M. de la Place & moi, de brûler du charbon dans l'appareil propre à déterminer la quantité de calorique dégagée, nous avons trouvé qu'une livre de charbon en brûlant, fondoit 96 liv. 6 onces de glace: 2 liv. 9 onces, 1 gros, 10 grains d'oxygène se combinent avec le charbon dans cette opération, & il se forme 3 liv. 9 onces, 1 gros, 10 grains de gaz acide: ce gaz pèse 0,695 grain le pouce cube, ce qui donne 34242 pouces cubiques pour le volume total de gaz acide qui se 69 forme par la combustion d'une livre de charbon.
Je pourrois multiplier beaucoup plus les exemples de ce genre, & faire voir par une suite de faits nombreux, que la formation des acides s'opère par l'oxygénation d'une substance quelconque; mais la marche que je me suis engagé à suivre & qui consiste à ne procéder que du connu à l'inconnu, & à ne présenter au Lecteur que des exemples puisés dans des choses qui lui ont été précédemment expliquées, m'empêche d'anticiper ici sur les faits. Les trois exemples d'ailleurs que je viens de citer, suffisent pour donner une idée claire & précise de la manière dont se forment les acides. On voit que l'oxigène est un principe commun à tous, & que c'est lui qui constitue leur acidité; qu'ils sont ensuite différenciés les uns des autres par la nature de la substance acidifiée. Il faut donc distinguer dans tout acide, la base acidifiable à laquelle M. de Morveau a donné le nom de radical, & le principe acidifiant, c'est-à-dire, l'oxigène.
70
CHAPITRE VI.
De la nomenclature des Acides en général, & particulièrement de ceux tirés du salpêtre & du sel marin.
Rien n'est plus aisé, d'après les principes posés dans le Chapitre précédent, que d'établir une nomenclature méthodique des acides: le mot acide sera le nom générique; chaque acide sera ensuite différencié dans le langage comme il l'est dans la nature, par le nom de sa base ou de son radical. Nous nommerons donc acides en général, le résultat de la combustion ou de l'oxygénation du phosphore, du soufre & du charbon. Nous nommerons le premier de ces résultats acide phosphorique, le second acide sulfurique, le troisième acide carbonique. De même, dans toutes les occasions qui pourront se présenter, nous emprunterons du nom de la base la désignation spécifique de chaque acide.
Mais une circonstance remarquable que présente l'oxygénation des corps combustibles, & en général, d'une partie des corps qui se transforment en acides, c'est qu'ils sont susceptibles 71 de différens degrés de saturation; & les acides qui en résultent, quoique formés de la combinaison des deux mêmes substances, ont des propriétés fort différentes, qui dépendent de la différence de proportion. L'acide phosphorique, & sur-tout l'acide sulfurique, en fournissent des exemples. Si le soufre est combiné avec peu d'oxygène, il forme à ce premier degré d'oxigénation un acide volatil, d'une odeur pénétrante, & qui a des propriétés toutes particulières. Une plus grande proportion d'oxygène le convertit en un acide fixe, pesant, sans odeur, & qui donne dans les combinaisons des produits fort différens du premier. Ici le principe de notre méthode de nomenclature sembloit se trouver en défaut, & il paroissoit difficile de tirer du nom de la base acidifiable deux dénominations qui exprimassent, sans circonlocution & sans périphrase, les deux degrés de saturation. Mais la réflexion, & plus encore peut-être la nécessité, nous ont ouvert de nouvelles ressources, & nous avons cru pouvoir nous permettre d'exprimer les variétés des acides par de simples variations dans les terminaisons. L'acide volatil du soufre avoit été désigné par Stahl sous le nom d'acide sulfureux: nous lui avons conservé ce nom, & nous avons donné celui de sulfurique à l'acide du soufre 72 complettement saturé d'oxygène. Nous dirons donc, en nous servant de ce nouveau langage, que le soufre, en se combinant avec l'oxygène, est susceptible de deux degrés de saturation; le premier constitue l'acide sulfureux, qui est pénétrant & volatil; le second constitue l'acide sulfurique, qui est inodore & fixe. Nous adopterons ce même changement de terminaison pour tous les acides qui présenteront plusieurs degrés de saturation; nous aurons donc également un acide phosphoreux & un acide phosphorique, un acide acéteux & un acide acétique, & ainsi des autres.
Toute cette partie de la chimie auroit été extrêmement simple, & la nomenclature des acides n'auroit rien présenté d'embarrassant, si, lors de la découverte de chacun d'eux, on eût connu son radical ou sa base acidifiable. L'acide phosphorique, par exemple, n'a été découvert que postérieurement à la découverte du phosphore, & le nom qui lui a été donné a été dérivé en conséquence de celui de la base acidifiable dont il est formé. Mais lorsqu'au contraire l'acide a été découvert avant la base, ou plutôt lorsqu'à l'époque où l'acide a été découvert, on ignoroit quelle étoit la base acidifiable à laquelle il appartenoit, alors on a donné à l'acide & à la base des noms qui n'avoient 73 aucun rapport entr'eux, & non-seulement on a surchargé la mémoire de dénominations inutiles, mais encore on a porté dans l'esprit des commençans & même des Chimistes consommés, des idées fausses que le tems seul & la réflexion peuvent effacer.
Nous citerons pour exemple l'acide du soufre. C'est du vitriol de fer qu'on a retiré cet acide dans le premier âge de la Chimie; & on l'a nommé acide vitriolique, en empruntant son nom de celui de la substance dont il étoit tiré. On ignoroit alors que cet acide fût le même que celui qu'on obtenoit du soufre par la combustion.
Il en est de même de l'acide aériforme auquel on a donné originairement le nom d'air fixe; on ignoroit que cet acide fût le résultat de la combinaison du carbone avec l'oxygène. De-là une infinité de dénominations qui lui ont été données & dont aucune ne transmet des idées justes. Rien ne nous a été plus facile que de corriger & de modifier l'ancien langage à l'égard de ces acides: nous avons converti le nom d'acide vitriolique en celui d'acide sulfurique, & celui d'air fixe en celui d'acide carbonique; mais il ne nous a pas été possible de suivre le même plan à l'égard des acides dont la base nous étoit inconnue. Nous nous sommes 74 trouvés alors forcés de prendre une marche inverse; & au lieu de conclure le nom de l'acide de celui de la base, nous avons nommé au contraire la base d'après la dénomination de l'acide. C'est ce qui nous est arrivé pour l'acide qu'on retire du sel marin ou sel de cuisine. Il suffit, pour dégager cet acide, de verser de l'acide sulfurique sur du sel marin; aussitôt il se fait une vive effervescence, il s'élève des vapeurs blanches d'une odeur très-pénétrante, & en faisant légèrement chauffer, on dégage tout l'acide. Comme il est naturellement dans l'état de gaz au degré de température & de pression dans lequel nous vivons, il faut des précautions particulières pour le retenir. L'appareil le plus commode & le plus simple pour les expériences en petit, consiste en une petite cornue G, planche V, fig. 5, dans laquelle on introduit du sel marin bien sec; on verse dessus de l'acide sulfurique concentré, & aussi-tôt on engage le bec de la cornue sous de petites jarres ou cloches de verre A, même figure, qu'on a préalablement remplies de mercure. A mesure que le gaz acide se dégage, il passe dans la jarre & gagne le haut en déplaçant le mercure. Lorsque le dégagement se rallentit, on chauffe légèrement & on augmente le feu jusqu'à ce qu'il ne passe 75 plus rien. Cet acide a une grande affinité avec l'eau, & cette dernière en absorbe une énorme quantité. On peut s'en assurer en introduisant une petite couche d'eau dans la jarre de verre qui le contient; en un instant l'acide se combine avec elle & disparoît en entier. On profite de cette circonstance dans les laboratoires & dans les arts, pour obtenir l'acide du sel marin sous la forme de liqueur. On se sert à cet effet de l'appareil représenté planche IV, figure première. Il consiste 1o. dans une cornue A, où l'on introduit le sel marin, & dans laquelle on verse de l'acide sulfurique par la tubulure H; 2o. dans le ballon CB destiné à recevoir la petite quantité de liqueur qui se dégage; 3o. dans une suite de bouteilles à deux gouleaux LL'L''L''', qu'on remplit d'eau à moitié. Cette eau est destinée à absorber le gaz acide qui se dégage pendant la distillation. Cet appareil est plus amplement décrit dans la dernière partie de cet Ouvrage.
Quoiqu'on ne soit encore parvenu ni à composer, ni à décomposer l'acide qu'on retire du sel marin, on ne peut douter cependant qu'il ne soit formé, comme tous les autres, de la réunion d'une base acidifiable avec l'oxygène. Nous avons nommé cette base inconnue base muriatique, radical muriatique, en empruntant ce 76 nom, à l'exemple de M. Bergman & de M. de Morveau, du mot latin muria, donné anciennement au sel marin. Ainsi, sans pouvoir déterminer quelle est exactement la composition de l'acide muriatique, nous désignerons sous cette dénomination un acide volatil, dont l'état naturel est d'être sous forme gazeuse au degré de chaleur & de pression que nous éprouvons, qui se combine avec l'eau en très-grande quantité & avec beaucoup de facilité; enfin dans lequel le radical acidifiable tient si fortement à l'oxygène, qu'on ne connoît jusqu'à présent aucun moyen de les séparer.
Si un jour on vient à rapporter le radical muriatique à quelque substance connue, il faudra bien alors changer sa dénomination & lui donner un nom analogue à celui de la base dont la nature aura été découverte.
L'acide muriatique présente au surplus une circonstance très-remarquable; il est, comme l'acide du soufre & comme plusieurs autres, susceptible de différens degrés d'oxygénation; mais l'excès d'oxygène produit en lui un effet tout contraire à celui qu'il produit dans l'acide du soufre. Un premier degré d'oxygénation transforme le soufre en un acide gazeux volatil, qui ne se mêle qu'en petite quantité avec l'eau: c'est celui que nous désignons avec Stahl 77 sous le nom d'acide sulfureux. Une dose plus forte d'oxygène le convertit en acide sulfurique, c'est-à-dire en un acide qui présente des qualités acides plus marquées, qui est beaucoup plus fixe, qui ne peut exister dans l'état de gaz qu'à une haute température, qui n'a point d'odeur & qui s'unit à l'eau en très-grande quantité. C'est le contraire dans l'acide muriatique; l'addition d'oxygène le rend plus volatil, d'une odeur plus pénétrante, moins miscible à l'eau, & diminue ses qualités acides. Nous avions d'abord été tentés d'exprimer ces deux degrés de saturation, comme nous l'avions fait pour l'acide du soufre, en faisant varier les terminaisons. Nous aurions nommé l'acide le moins saturé d'oxygène acide muriateux, & le plus saturé acide muriatique; mais nous avons cru que cet acide qui présente des résultats particuliers, & dont on ne connoît aucun autre exemple en Chimie, demandoit une exception, & nous nous sommes contentés de le nommer acide muriatique oxygéné.
Il est un autre acide que nous nous contenterons de définir, comme nous l'avons fait pour l'acide muriatique, quoique sa base soit mieux connue: c'est celui que les Chimistes ont désigné jusqu'ici sous le nom d'acide nitreux. Cet acide se tire du nitre ou salpêtre par des 78 procédés analogues à ceux qu'on emploie pour obtenir l'acide muriatique. C'est également par l'intermède de l'acide sulfurique qu'on le chasse de la base à laquelle il est uni, & l'on se sert de même à cet effet de l'appareil représenté planche IV, fig. 1. A mesure que l'acide passe, une partie se condense dans le ballon, l'autre est absorbée par l'eau des bouteilles LL'L''L''' qui devient d'abord verte, puis bleue, & enfin jaune, suivant le degré de concentration de l'acide. Il se dégage pendant cette opération une grande quantité de gaz oxygène mêlé d'un peu de gaz azotique.
L'acide qu'on tire ainsi du salpêtre, est composé, comme tous les autres, d'oxygène uni à une base acidifiable, & c'est même le premier dans lequel l'existence de l'oxygène ait été bien démontrée. Les deux principes qui le constituent tiennent peu ensemble, & on les sépare aisément en présentant à l'oxygène une substance avec laquelle il ait plus d'affinité qu'il n'en a avec la base acidifiable qui constitue l'acide du nitre. C'est par des expériences de ce genre qu'on est parvenu à reconnoître que l'azote ou base de la mofète entroit dans sa composition, qu'elle étoit sa base acidifiable. L'azote est donc véritablement le radical nitrique, ou l'acide du nitre est un véritable acide azotique. On voit donc que pour être d'accord 79 avec nous-mêmes & avec nos principes, nous aurions dû adopter l'une ou l'autre de ces manières de nous énoncer. Nous en avons été détournés cependant par différens motifs; d'abord il nous a paru difficile de changer le nom de nitre ou de salpêtre généralement adopté dans les arts, dans la société & dans la Chimie. Nous n'avons pas cru, d'un autre côté, devoir donner à l'azote le nom de radical nitrique, parce que cette substance est également la base de l'alkali volatil ou ammoniaque, comme l'a découvert M. Berthollet. Nous continuerons donc de désigner sous le nom d'azote la base de la partie non respirable de l'air atmosphérique, qui est en même tems le radical nitrique & le radical ammoniaque. Nous conserverons également le nom de nitreux & de nitrique à l'acide tiré du nitre ou salpêtre. Plusieurs Chimistes d'un grand poids ont désapprouvé notre condescendance pour les anciennes dénominations; ils auroient préféré que nous eussions dirigé uniquement nos efforts vers la perfection de la nomenclature, que nous eussions reconstruit l'édifice du langage chimique de fond en comble, sans nous embarrasser de le raccorder avec d'anciens usages dont le tems effacera insensiblement le souvenir: & c'est ainsi que nous nous sommes 80 trouvés exposés à la fois à la critique & aux plaintes des deux partis opposés.
L'acide du nitre est susceptible de se présenter dans un grand nombre d'états qui dépendent du degré d'oxygénation qu'il a éprouvé, c'est-à-dire, de la proportion d'azote & d'oxygène qui entre dans sa composition. Un premier degré d'oxygénation de l'azote constitue un gaz particulier que nous continuerons de désigner sous le nom de gaz nitreux: il est composé d'environ 2 parties en poids d'oxygène & d'une d'azote, & dans cet état il est immiscible à l'eau. Il s'en faut beaucoup que l'azote dans ce gaz soit saturé d'oxygène, il lui reste au contraire une grande affinité pour ce principe, & il l'attire avec une telle activité, qu'il l'enlève même à l'air de l'atmosphère sitôt qu'il est en contact avec lui. La combinaison du gaz nitreux avec l'air de l'atmosphère est même devenue un des moyens qu'on emploie pour déterminer la quantité d'oxigène contenu dans ce dernier, & pour juger de son degré de salubrité. Cette addition d'oxygène convertit le gaz nitreux en un acide puissant qui a une grande affinité avec l'eau, & qui est susceptible lui-même de différens degrés d'oxygénation. Si la proportion de l'oxygène & de l'azote est au-dessous de trois parties contre une, l'acide est 81 rouge & fumant: dans cet état nous le nommons acide nitreux; on peut en le faisant légèrement chauffer, en dégager du gaz nitreux. Quatre parties d'oxygène contre une d'azote donnent un acide blanc & sans couleur, plus fixe au feu que le précédent, qui a moins d'odeur, & dont les deux principes constitutifs sont plus solidement combinés: nous lui avons donné, d'après les principes exposés ci-dessus, le nom d'acide nitrique.
Ainsi l'acide nitrique est l'acide du nitre surchargé d'oxygène; l'acide nitreux est l'acide du nitre surchargé d'azote, ou, ce qui est la même chose, de gaz nitreux; enfin le gaz nitreux est l'azote qui n'est point assez saturée d'oxygène pour avoir les propriétés des acides. C'est ce que nous nommerons plus bas un oxide.

82
CHAPITRE VII.
De la décomposition du Gaz oxygène par les métaux, & de la formation des Oxides métalliques.
Lorsque les substances métalliques sont échauffées à un certain degré de température, l'oxygène a plus d'affinité avec elles qu'avec le calorique: en conséquence toutes les substances métalliques, si on en excepte l'or, l'argent & le platine, ont la propriété de décomposer le gaz oxygène, de s'emparer de sa base & d'en dégager le calorique. On a déjà vu plus haut comment s'opéroit cette décomposition de l'air par le mercure & par le fer; on a observé que la première ne pouvoit être regardée que comme une combustion lente; que la dernière au contraire étoit très-rapide & accompagnée d'une flamme brillante. S'il est nécessaire d'employer un certain degré de chaleur dans ces opérations, c'est pour écarter les unes des autres les molécules du métal, & diminuer leur affinité d'aggrégation, ou ce qui est la même chose, l'attraction qu'elles exercent les unes sur les autres.
Les substances métalliques pendant leur calcination 83 augmentent de poids à proportion de l'oxygène qu'elles absorbent; en même-tems elles perdent leur éclat métallique & se réduisent en une poudre terreuse. Les métaux dans cet état ne doivent point être considérés comme entièrement saturés d'oxygène, par la raison que leur action sur ce principe est balancée par la force d'attraction qu'exerce sur lui le calorique. L'oxygène dans la calcination des métaux, obéit donc réellement à deux forces, à celle exercée par le calorique, à celle exercée par le métal; il ne tend à s'unir à ce dernier qu'en raison de la différence de ces deux forces, de l'excès de l'une sur l'autre, & cet excès en général n'est pas fort considérable. Aussi les substances métalliques, en s'oxygénant dans l'air & dans le gaz oxygène, ne se convertissent-elles point en acides, comme le soufre, le phosphore & le charbon: il se forme des substances intermédiaires qui commencent à se rapprocher de l'état salin, mais qui n'ont pas encore acquis toutes les propriétés salines. Les anciens ont donné le nom de chaux, non-seulement aux métaux amenés à cet état, mais encore à toute substance qui avoit été exposée long-tems à l'action du feu sans se fondre. Ils ont fait en conséquence du mot chaux un nom générique, & ils ont confondu sous ce nom, & la pierre calcaire, 84 qui d'un sel neutre qu'elle étoit avant la calcination, se convertit au feu en un alkali terreux, en perdant moitié de son poids, & les métaux qui s'associent par la même opération une nouvelle substance dont la quantité excède quelquefois moitié de leur poids, & qui les rapproche de l'état d'acide. Il auroit été contraire à nos principes de classer sous un même nom des substances si différentes, & sur-tout de conserver aux métaux une dénomination si propre à faire naître des idées fausses. Nous avons en conséquence proscrit l'expression de chaux métalliques, & nous y avons substitué celui d'oxides, du grec οξυς.
On voit d'après cela combien le langage que nous avons adopté est fécond & expressif; un premier degré d'oxygénation constitue les oxides; un second degré constitue les acides terminés en eux, comme l'acide nitreux, l'acide sulfureux; un troisième degré constitue les acides en ique, tels que l'acide nitrique, l'acide sulfurique; enfin nous pouvons exprimer un quatrième degré d'oxigénation des substances, en ajoutant l'épithète d'oxygéné, comme nous l'avons admis pour l'acide muriatique oxygéné.
Nous ne nous sommes pas contentés de désigner sous le nom d'oxides la combinaison des métaux avec l'oxygène; nous n'avons fait aucune 85 difficulté de nous en servir pour exprimer le premier degré d'oxygénation de toutes les substances, celui qui, sans les constituer acides, les rapproche de l'état salin. Nous appellerons donc oxide de soufre, le soufre devenu mou par un commencement de combustion; nous appellerons oxide de phosphore la substance jaune que laisse le phosphore quand il a brûlé.
Nous dirons de même que le gaz nitreux, qui est le premier degré d'oxygénation de l'azote, est un oxide d'azote. Enfin le règne végétal & le règne animal auront leurs oxides, & je ferai voir dans la suite combien ce nouveau langage jettera de lumières sur toutes les opérations de l'art & de la nature.
Les oxides métalliques ont, comme nous l'avons déjà fait observer, presque tous des couleurs qui leur sont propres, & ces couleurs varient non-seulement pour les différens métaux, mais encore suivant le degré d'oxygénation du même métal. Nous nous sommes donc trouvés obligés d'ajouter à chaque oxide deux épithètes, l'une qui indiquât le métal oxidé, l'autre sa couleur; ainsi nous dirons oxide noir de fer, oxide rouge de fer, oxide jaune de fer; & ces expressions répondront à celles d'éthiops martial, de colcothar, de rouille de fer ou d'ocre.
86
Nous dirons de même oxide gris de plomb, oxide jaune de plomb, oxide rouge de plomb; & ces expressions désigneront la cendre de plomb, le massicot & le minium.
Ces dénominations seront quelquefois un peu longues, sur-tout quand on voudra exprimer si le métal a été oxidé à l'air, s'il l'a été par la détonation avec le nitre ou par l'action des acides; mais au moins elles seront toujours justes & feront naître l'idée précise de l'objet qui y correspond.
Les tables jointes à cet Ouvrage, rendront ceci plus sensible.

87
CHAPITRE VIII.
Du principe radical de l'Eau, & de sa décomposition par le charbon & par le fer.
Jusqu'a ces derniers tems on avoit regardé l'eau comme une substance simple, & les anciens n'avoient fait aucune difficulté de la qualifier du nom d'élément: c'étoit sans doute une substance élémentaire pour eux, puisqu'ils n'étoient point parvenus à la décomposer, ou au moins puisque les décompositions de l'eau qui s'opéroient journellement sous leurs yeux, avoient échappé à leurs observations: mais on va voir que l'eau n'est plus un élément pour nous. Je ne donnerai point ici l'histoire de cette découverte qui est très-moderne, & qui même est encore contestée. On peut consulter à cet égard les Mémoires de l'Académie des Sciences, année 1781.
Je me contenterai de rapporter les principales preuves de la décomposition & de la recomposition de l'eau; j'ose dire que quand on voudra bien les peser sans partialité, on les trouvera démonstratives.
88
EXPÉRIENCE PREMIÈRE.
Préparation.
On prend un tube de verre EF, planche VII, fig. 11, de 8 à 12 lignes de diamètre, qu'on fait passer à travers un fourneau, en lui donnant une légère inclinaison de E en F. A l'extrêmité supérieure E de ce tube, on ajuste une cornue de verre A, qui contient une quantité d'eau distillée bien connue, & à son extrêmité inférieure F, un serpentin SS' qui s'adapte en S' au gouleau d'un flacon H à deux tubulures; enfin à l'une des deux tubulures du flacon s'adapte un tube de verre recourbé KK, destiné à conduire les fluides aériformes ou gaz dans un appareil propre à en déterminer la qualité & la quantité.
Il est nécessaire, pour assurer le succès de cette expérience, que le tube EF soit de verre vert bien cuit & d'une fusion difficile; on l'enduit en outre d'un lut d'argile mêlée avec du ciment fait avec des poteries de grès réduites en poudre; & dans la crainte qu'il ne fléchisse par le ramollissement, on le soutient dans son milieu avec une barre de fer qui traverse le fourneau. Des tuyaux de porcelaine sont préférables à ceux de verre; mais il est difficile de s'en procurer 89 qui ne soient pas poreux, & presque toujours on y découvre quelques trous qui donnent passage à l'air ou aux vapeurs.
Lorsque tout a été ainsi disposé, on allume du feu dans le fourneau EFCD, & on l'entretient de manière à faire rougir le tube de verre EF, sans le fondre; en même tems on allume assez de feu dans le fourneau VVXX, pour entretenir toujours bouillante l'eau de la cornue A.
Effet.
A mesure que l'eau de la cornue A se vaporise par l'ébullition, elle remplit l'intérieur du tube EF, & elle en chasse l'air commun qui s'évacue par le tube KK; le gaz aqueux est ensuite condensé par le refroidissement dans le serpentin SS', & il tombe de l'eau goutte à goutte dans le flacon tubulé H.
En continuant cette opération jusqu'à ce que toute l'eau de la cornue A soit évaporée, & en laissant bien égoutter les vaisseaux, on retrouve dans le flacon H une quantité d'eau rigoureusement égale à celle qui étoit dans la cornue A, sans qu'il y ait eu dégagement d'aucun gaz; en sorte que cette opération se réduit à une simple distillation ordinaire, dont le résultat est absolument le même que si l'eau 90 n'eût point été portée à l'état incandescent, en traversant le tube intermédiaire EF.
Expérience seconde.
Preparation.
On dispose tout comme dans l'expérience précédente, avec cette différence seulement qu'on introduit dans le tube EF vingt-huit grains de charbon concassé en morceaux de médiocre grosseur, & qui préalablement a été long-tems exposé à une chaleur incandescente dans des vaisseaux fermés. On fait, comme dans l'expérience précédente, bouillir l'eau de la cornue A jusqu'à évaporation totale.
Effet.
L'eau de la cornue A se distille dans cette expérience comme dans la précédente; elle se condense dans le serpentin, & coule goutte à goutte dans le flacon H; mais en même tems il se dégage une quantité considérable de gaz, qui s'échappe par le tuyau KK, & qu'on recueille dans un appareil convenable.
L'opération finie, on ne retrouve plus dans le tube EF que quelques atômes de cendre; les vingt-huit grains de charbon ont totalement disparu.
91
Les gaz qui se sont dégagés examinés avec soin, se trouvent peser ensemble 113 grains 7/10[4]; ils sont de deux espèces, savoir 144 pouces cubiques de gaz acide carbonique, pesant 100 grains, & 380 pouces cubiques d'un gaz extrêmement léger, pesant 13 grains 7/10, & qui s'allume par l'approche d'un corps enflammé lorsqu'il a le contact de l'air. Si on vérifie ensuite le poids de l'eau passée dans le flacon, on la trouve diminuée de 85 grains 7/10.
Ainsi dans cette expérience, 85 grains 7/10 d'eau, plus 28 grains de charbon ont formé 100 grains d'acide carbonique, plus 13 grains 7/10 d'un gaz particulier susceptible de s'enflammer.
Mais j'ai fait voir plus haut, que pour former 100 grains de gaz acide carbonique, il falloit unir 72 grains d'oxygène à 28 grains de charbon; donc les 28 grains de charbon placés dans le tube de verre ont enlevé à l'eau 72 grains d'oxygène; donc 85 grains 7/10 d'eau sont composés de 72 grains d'oxygène & de 13 grains 7/10 d'un gaz susceptible de s'enflammer. On verra bientôt qu'on ne peut pas supposer que ce gaz ait été dégagé du charbon, 92 & qu'il est conséquemment un produit de l'eau.
J'ai supprimé dans l'exposé de cette expérience quelques détails qui n'auroient servi qu'à la compliquer & à jetter de l'obscurité dans les idées des lecteurs: le gaz inflammable, par exemple, dissout un peu de charbon, & cette circonstance en augmente le poids & diminue au contraire celui de l'acide carbonique; l'altération qui en résulte dans les quantités n'est pas très-considérable; mais j'ai cru devoir les rétablir par calcul, & présenter l'expérience dans toute sa simplicité, & comme si cette circonstance n'avoit pas lieu. Au surplus, s'il restoit quelques nuages sur la vérité des conséquences que je tire de cette expérience, ils seroient bientôt dissipés par les autres expériences que je vais rapporter à l'appui.
Troisième Expérience.
Préparation.
On dispose tout l'appareil comme dans l'expérience précédente, avec cette différence seulement, qu'au lieu des 28 grains de charbon, on met dans le tube EF, planche VII, fig. 11, 274 grains de petites lames de fer très-doux roulées en spirales. On fait rougir le tube comme dans les expériences précédentes; on allume 93 du feu sous la cornue A, & on entretient l'eau qu'elle contient toujours bouillante, jusqu'à ce qu'elle soit entièrement évaporée, qu'elle ait passé en totalité dans le tube EF, & qu'elle se soit condensée dans le flacon H.
Effet.
Il ne se dégage point de gaz acide carbonique dans cette expérience, mais seulement un gaz inflammable 13 fois plus léger que l'air de l'atmosphère: le poids total qu'on en obtient est de 15 grains, & son volume est d'environ 416 pouces cubiques. Si on compare la quantité d'eau primitivement employée avec celle restante dans le flacon H, on trouve un déficit de 100 grains. D'un autre côté, les 274 grains de fer renfermés dans le tube EF se trouvent peser 85 grains de plus que lorsqu'on les y a introduits; & leur volume se trouve considérablement augmenté: ce fer n'est presque plus attirable à l'aimant, il se dissout sans effervescence dans les acides; en un mot, il est dans l'état d'oxide noir, précisément comme celui qui a été brûlé dans le gaz oxygène.
Réflexions.
Le résultat de cette expérience présente une véritable oxidation du fer par l'eau; oxidation 94 toute semblable à celle qui s'opère dans l'air à l'aide de la chaleur. Cent grains d'eau ont été décomposés; 85 d'oxygène se sont unis au fer pour le constituer dans l'état d'oxide noir, & il s'est dégagé 15 grains d'un gaz inflammable particulier: donc l'eau est composée d'oxygène & de la base d'un gaz inflammable, dans la proportion de 85 parties contre 15.
Ainsi l'eau indépendamment de l'oxygène qui est un de ses principes, & qui lui est commun avec beaucoup d'autres substances, en contient un autre qui lui est propre, qui est son radical constitutif, & auquel nous nous sommes trouvés forcés de donner un nom. Aucun ne nous a paru plus convenable que celui d'hydrogène, c'est-à-dire, principe générateur de l'eau, de υδορ eau, & de γεινομαι j'engendre. Nous appellerons gaz hydrogène la combinaison de ce principe avec le calorique, & le mot d'hydrogène seul exprimera la base de ce même gaz, le radical de l'eau[A].
Voilà donc un nouveau corps combustible, c'est-à-dire, un corps qui a assez d'affinité avec l'oxygène pour l'enlever au calorique & pour décomposer l'air ou le gaz oxygène. Ce corps combustible a lui-même une telle affinité avec le calorique, qu'à moins qu'il ne soit engagé dans une combinaison, il est toujours dans 95 l'état aériforme ou de gaz au degré habituel de pression & de température dans lequel nous vivons. Dans cet état de gaz, il est environ 13 fois plus léger que l'air de l'atmosphère, il n'est point absorbable par l'eau, mais il est susceptible d'en dissoudre une petite quantité; enfin il ne peut servir à la respiration des animaux.
La propriété de brûler & de s'enflammer n'étant pour ce gaz comme pour tous les autres combustibles, que la propriété de décomposer l'air & d'enlever l'oxygène au calorique, on conçoit qu'il ne peut brûler qu'avec le contact de l'air ou du gaz oxygène. Aussi lorsqu'on emplit une bouteille de ce gaz & qu'on l'allume, il brûle paisiblement au gouleau de la bouteille & ensuite dans son intérieur, à mesure que l'air extérieur y pénètre; mais la combustion est successive & lente, elle n'a lieu qu'à la surface où le contact des deux airs ou gaz s'opère. Il n'en est pas de même lorsqu'on mêle ensemble les deux airs avant de les allumer: si par exemple après avoir introduit dans une bouteille à gouleau étroit une partie de gaz oxygène, & ensuite deux de gaz hydrogène, on approche de son orifice un corps enflammé, tel qu'une bougie ou un morceau de papier allumé, la combustion des deux gaz se fait 96 d'une manière instantanée & avec une forte explosion. On ne doit faire cette expérience que dans une bouteille de verre vert très-forte qui n'excède pas une pinte de capacité & qu'on enveloppe même d'un linge, autrement on s'exposeroit à des accidens funestes par la rupture de la bouteille dont les fragmens pourroient être lancés à de grandes distances.
Si tout ce que je viens d'exposer sur la décomposition de l'eau est exact & vrai, si réellement cette substance est composée, comme j'ai cherché à l'établir, d'un principe qui lui est propre, d'hydrogène combiné avec l'oxygène, il en résulte qu'en réunissant ces deux principes, on doit refaire de l'eau, & c'est ce qui arrive en effet, comme on va en juger par l'expérience suivante.
Quatrième Expérience.
Recomposition de l'eau.
Préparation.
On prend un ballon A de cristal, planche IV, fig. 5, à large ouverture, & dont la capacité soit de 30 pintes environ; on y mastique une platine de cuivre BC percée de quatre trous auxquels aboutissent quatre tuyaux. Le premier 97 Hh est destiné à s'adapter par son extrêmité h à une pompe pneumatique par le moyen de laquelle on peut faire le vuide dans le ballon. Un second tuyau gg communique par son extrêmité MM avec un réservoir de gaz oxygène, & est destiné à l'amener dans le ballon. Un troisième dDd' communique par son extrêmité dNN avec un réservoir de gaz hydrogène: l'extrêmité d' de ce tuyau se termine par une ouverture très-petite & à travers laquelle une très-fine aiguille peut à peine passer. C'est par cette petite ouverture que doit sortir le gaz hydrogène contenu dans le réservoir; & pour qu'il ait une vîtesse suffisante, on doit lui faire éprouver une pression de un ou deux pouces d'eau. Enfin la platine BC est percée d'un quatrième trou, lequel est garni d'un tube de verre mastiqué, à travers lequel passe un fil de métal GL, à l'extrémité L duquel est adaptée une petite boule, afin de pouvoir tirer une étincelle électrique de L en d' pour allumer, comme on le verra bientôt, le gaz hydrogène. Le fil de métal GL est mobile dans le tube de verre afin de pouvoir éloigner la boule L de l'extrémité d' de l'ajutoir Dd'. Les trois tuyaux dDd', gg, Hh sont chacun garnis de leur robinet.
Pour que le gaz hydrogène & le gaz oxygène 98 arrivent bien secs par les tuyaux respectifs qui doivent les amener au ballon A, & qu'ils soient dépouillés d'eau autant qu'ils le peuvent être, on les fait passer à travers des tubes MM, NN d'un pouce environ de diamètre qu'on remplit d'un sel très-déliquescent, c'est-à-dire, qui attire l'humidité de l'air avec beaucoup d'avidité, tels que l'acétite de potasse, le muriate ou le nitrate de chaux. Voyez quelle est la composition de ces sels dans la seconde partie de cet Ouvrage. Ces sels doivent être en poudre grossière afin qu'ils ne puissent pas faire masse, & que le gaz passe facilement à travers les interstices que laissent les morceaux.
On doit s'être prémuni d'avance d'une provision suffisante de gaz oxygène bien pur; & pour s'assurer qu'il ne contient point d'acide carbonique, on doit le laisser long-tems en contact avec de la potasse dissoute dans de l'eau, & qu'on a dépouillée de son acide carbonique par de la chaux: on donnera plus bas quelques détails sur les moyens d'obtenir cet alkali.
On prépare avec le même soin le double de gaz hydrogène. Le procédé le plus sûr pour l'obtenir exempt de mêlange, consiste à le tirer de la décomposition de l'eau par du fer bien ductile & bien pur.
Lorsque ces deux gaz sont ainsi préparés, on 99 adapte la pompe pneumatique au tuyau Hh, & on fait le vuide dans le grand ballon A: on y introduit ensuite l'un ou l'autre des deux gaz, mais de préférence le gaz oxygène par le tuyau gg, puis on oblige par un certain degré de pression le gaz hydrogène à entrer dans le même ballon par le tuyau dDd', dont l'extrémité d' se termine en pointe. Enfin on allume ce gaz à l'aide d'une étincelle électrique. En fournissant ainsi de chacun des deux airs, on parvient à continuer très-long-tems la combustion. J'ai donné ailleurs la description des appareils que j'ai employés pour cette expérience, & j'ai expliqué comment on parvient à mesurer les quantités de gaz consommés avec une rigoureuse exactitude. Voyez la troisième partie de cet Ouvrage.
Effet.
A mesure que la combustion s'opère, il se dépose de l'eau sur les parois intérieures du ballon ou matras: la quantité de cette eau augmente peu à peu; elle se réunit en grosses goutes qui coulent & se rassemblent dans le fond du vase.
En pesant le matras avant & après l'opération, il est facile de connoître la quantité d'eau qui s'est ainsi rassemblée. On a donc dans cette expérience 100 une double vérification; d'une part le poids des gaz employés, de l'autre celui de l'eau formée, & ces deux quantités doivent être égales. C'est par une expérience de ce genre que nous avons reconnu, M. Meusnier & moi, qu'il falloit 85 parties en poids d'oxygène, & 15 parties également en poids d'hydrogène, pour composer 100 parties d'eau. Cette expérience qui n'a point encore été publiée, a été faite en présence d'une Commission nombreuse de l'Académie; nous y avons apporté les attentions les plus scrupuleuses, & nous avons lieu de la croire exacte à un deux-centième près tout au plus.
Ainsi, soit qu'on opère par voie de décomposition ou de recomposition, on peut regarder comme constant & aussi bien prouvé qu'on puisse le faire en Chimie & en Physique, que l'eau n'est point une substance simple; qu'elle est composée de deux principes, l'oxygène & l'hydrogène, & que ces deux principes séparés l'un de l'autre, ont tellement d'affinité avec le calorique, qu'ils ne peuvent exister que sous forme de gaz, au degré de température & de pression dans lequel nous vivons.
Ce phénomène de la décomposition & de la recomposition de l'eau s'opère continuellement sous nos yeux, à la température de l'atmosphère 101 & par l'effet des affinités composées. C'est à cette décomposition que sont dus, comme nous le verrons bientôt, au moins jusqu'à un certain point, les phénomènes de la fermentation spiritueuse, de la putréfaction, & même de la végétation. Il est bien extraordinaire qu'elle ait échappé jusqu'ici à l'œil attentif des Physiciens & des Chimistes, & on doit en conclure que dans les sciences comme dans la morale il est difficile de vaincre les préjugés dont on a été originairement imbu, & de suivre une autre route que celle dans laquelle on est accoutumé de marcher.
Je terminerai cet article par une expérience beaucoup moins probante que celles que j'ai précédemment rapportées, mais qui m'a paru cependant faire plus d'impression qu'aucune autre sur un grand nombre de personnes. Si on brûle une livre ou seize onces d'esprit-de-vin ou alkool dans un appareil propre à recueillir toute l'eau qui se dégage pendant la combustion, on en obtient 17 à 18 onces[5]. Or une matière quelconque ne peut rien fournir dans une expérience au-delà de la totalité de 102 son poids; il faut donc qu'il s'ajoute une autre substance à l'esprit-de-vin pendant sa combustion: or j'ai fait voir que cette autre substance étoit la base de l'air, l'oxygène. L'esprit-de-vin contient donc un des principes de l'eau, l'hydrogène; & c'est l'air de l'atmosphère qui fournit l'autre, l'oxygène: nouvelle preuve que l'eau est une substance composée.

103
CHAPITRE IX.
De la quantité de Calorique qui se dégage des différentes espèces de combustion.
Nous avons vu qu'en opérant une combustion quelconque dans une sphère de glace creuse, & en fournissant pour l'entretenir de l'air à zéro du thermomètre, la quantité de glace fondue dans l'intérieur de la sphère, donnoit une mesure, sinon absolue, du moins relative des quantités de calorique dégagé. Nous avons donné, M. de la Place & moi, la description de l'appareil que nous avons employé dans ce genre d'expériences. Voyez Mémoires de l'Acad. des Sciences, année 1780, page 355. Voyez aussi la 3e partie de cet Ouvrage. Ayant essayé de déterminer les quantités de glace qui se fondoient par la combustion de trois des quatre substances combustibles simples, savoir, le phosphore, le carbone & l'hydrogène, nous avons obtenu les résultats qui suivent.
Pour la combustion d'une livre de phosphore, 100 livres de glace.
Pour la combustion d'une livre de carbone, 96 livres 8 onces.
104
Pour la combustion d'une livre de gaz hydrogène, 295 livres 9 onces 3 gros & demi.
La substance qui se forme par le résultat de la combustion du phosphore, étant un acide concret, il est probable qu'il reste très-peu de calorique dans cet acide, & que par conséquent cette combustion fournit un moyen de connoître, à très-peu de chose près, la quantité de calorique contenue dans le gaz oxygène. Mais quand on voudroit supposer que l'acide phosphorique retient encore une quantité considérable de calorique, comme le phosphore en contenoit aussi une portion avant la combustion, l'erreur ne pourroit jamais être que de la différence, & par conséquent de peu d'importance.
J'ai fait voir, page 60, qu'une livre de phosphore en brûlant absorboit 1 livre 8 onces d'oxygène; & puisqu'il y a en même tems 100 livres de glace fondue, il en résulte que la quantité de calorique contenue dans une livre de gaz oxygène, est capable de faire fondre 66 livres 10 onces 5 gros 24 grains de glace.
Une livre de charbon en brûlant ne fait fondre que 96 livres 8 onces de glace; mais il s'absorbe en même tems 2 livres 9 onces 1 gros 10 grains de gaz oxygène. Or, en partant des résultats obtenus dans la combustion du phosphore, 105 2 liv. 9 onc. 1 gros 10 grains de gaz oxygène, devroient abandonner assez de calorique pour fondre 171 livres 6 onces 5 gros de glace. Il disparoît donc dans cette expérience une quantité de calorique qui auroit été suffisante pour faire fondre 74 liv. 14 onc. 5 gros de glace; mais comme l'acide carbonique n'est point, comme le phosphorique, dans l'état concret après la combustion, qu'il est au contraire dans l'état gazeux, il a fallu nécessairement une quantité de calorique pour le porter à cet état, & c'est cette quantité qui se trouve manquante dans la combustion ci-dessus. En la divisant par le nombre de livres d'acide carbonique qui se forment par la combustion d'une livre de charbon, on trouve que la quantité de calorique nécessaire pour porter une livre d'acide carbonique de l'état concret à l'état gazeux, feroit fondre 20 liv. 15 onces 5 gros de glace.
On peut faire un semblable calcul sur la combustion de l'hydrogène & sur la formation de l'eau; une livre de ce fluide élastique absorbe en brûlant 5 liv. 10 onc. 5 gros 24 grains d'oxygène, & fait fondre 295 livres 9 onces 3 gros & demi de glace.
| liv. | onc. | gros. | |
| Or, 5 liv. 10 onces 5 gros 24 grains de gaz oxygène, en passant de l'état aériforme à l'état 106 solide, perdroient, d'après les résultats obtenus dans la combustion du phosphore, assez de calorique pour faire fondre une quantité de glace égale à | 377 | 12 | 3 |
| Il ne s'en dégage dans la combustion du gaz hydrogène, que | 295 | 2 | 3 |
| Il en reste donc dans l'eau qui se forme, lors même qu'elle est ramenée à zéro du thermomètre, | 82 | 9 | 7 1/2 |
Or, comme il se forme 6 liv. 10 onc. 5 gros 24 grains d'eau dans la combustion d'une livre de gaz hydrogène, il en résulte qu'il reste dans chaque livre d'eau, à zéro du thermomètre, une quantité de calorique égale à celle nécessaire pour fondre 12 liv. 5 onc. 2 gros 48 grains de glace, sans parler même de celui contenu dans le gaz hydrogène, dont il est impossible de tenir compte dans cette expérience, parce que nous n'en connoissons pas la quantité. D'où l'on voit que l'eau, même dans l'état de glace, contient encore beaucoup de calorique, & que l'oxygène en conserve une quantité très-considérable en passant dans cette combinaison.
De ces diverses tentatives on peut résumer les résultats qui suivent.
107
Combustion du Phosphore.
| liv. | onc. | gros | gr. | |
| Quantité de phosphore brûlé, | 1 | » | » | » |
| Quantité de gaz oxygène nécessaire pour la combustion, | 1 | 8 | » | » |
| Quantité d'acide phosphorique obtenu, | 2 | 8 | » | » |
| Quantité de calorique dégagé par la combustion d'une livre de phosphore, exprimé par la quantité de livres de glace qu'il peut fondre, | 100,00000 | |||
| Quantité de calorique dégagé de chaque livre de gaz oxygène dans la combustion du phosphore, | 66,66667 | |||
| Quantité de calorique qui se dégage dans la formation d'une livre d'acide phosphorique, | 40,00000 | |||
| Quantité de calorique resté dans chaque livre d'acide phosphorique, | 0,00000 |
On suppose ici que l'acide phosphorique ne conserve aucune portion de calorique, ce qui n'est pas rigoureusement vrai: mais la quantité (comme on l'a déjà observé plus haut) en est probablement très-petite, & on ne la suppose nulle que faute de la pouvoir évaluer.
108
Combustion du Charbon.
| liv. | onc. | gros | gr. | |
| Quantité de charbon brûlé, | 1 | » | » | » |
| Quantité de gaz oxygène absorbé pendant la combustion, | 2 | 9 | 1 | 10 |
| Quantité d'acide carbonique formé, | 3 | 9 | 1 | 10 |
| Quantité de calorique dégagé par la combustion d'une livre de charbon, exprimé par la quantité de livres de glace qu'il peut fondre, | 96,50000 | |||
| Quantité de calorique dégagé de chaque livre de gaz oxygène, | 37,52823 | |||
| Quantité de calorique qui se dégage dans la formation d'une livre de gaz acide carbonique, | 27,02024 | |||
| Quantité de calorique que conserve une livre d'oxygène dans cette combustion, | 29,13844 | |||
| Quantité de calorique nécessaire pour porter une livre d'acide carbonique à l'état de gaz, | 20,97960 |
109
Combustion du Gaz hydrogène.
| liv. | onc. | gros | gr. | |
| Quantité de gaz hydrogène brûlé, | 1 | » | » | » |
| Quantité de gaz oxygène employé pour la combustion, | 5 | 10 | 5 | 24 |
| Quantité d'eau formée, | 6 | 10 | 5 | 24 |
| Quantité de calorique dégagé par la combustion d'une livre de gaz hydrogène, | 295,58950 | |||
| Quantité de calorique dégagé par chaque livre de gaz oxygène, | 52,16280 | |||
| Quantité de calorique qui se dégage pendant la formation d'une livre d'eau, | 44,33840 | |||
| Quantité de calorique que conserve une livre d'oxygène dans sa combustion avec l'hydrogène, | 14,50386 | |||
| Quantité de calorique que conserve une livre d'eau à zéro, | 12,32823 |
De la Formation de l'Acide nitrique.
Lorsque l'on combine du gaz nitreux avec du gaz oxigène pour former de l'acide nitrique ou nitreux, il y a une légère chaleur produite; mais elle est beaucoup moindre que celle qui 110 a lieu dans les autres combinaisons de l'oxygène; d'où il résulte par une conséquence nécessaire que le gaz oxygène, en se fixant dans l'acide nitrique, retient une grande partie du calorique qui lui étoit combiné dans l'état de gaz. Il n'est point impossible sans doute de déterminer la quantité de calorique qui se dégage pendant la réunion des deux gaz, & on en concluroit facilement ensuite celle qui demeure engagée dans la combinaison. On parviendroit à obtenir la première de ces données, en opérant la combinaison du gaz nitreux & du gaz oxygène dans un appareil environné de glace: mais comme il se dégage peu de calorique dans cette combinaison, on ne pourroit réussir à en déterminer la quantité, qu'autant qu'on opéreroit très en grand avec des appareils embarrassans & compliqués; & c'est ce qui nous a empêchés jusqu'ici, M. de la Place & moi, de la tenter. En attendant, on peut déjà y suppléer par des calculs qui ne peuvent pas s'écarter beaucoup de la vérité.
Nous avons fait détonner, M. de la Place & moi, dans un appareil à glace une proportion convenable de salpêtre & de charbon, & nous avons observé qu'une livre de salpêtre pouvoit, en détonant ainsi, fondre 12 livres de glace.
Mais une livre de salpêtre, comme on 111 le verra dans la suite, contient:
| onc. | gros | grains. | |
| Potasse | 7 | 6 | 51,84 = 4515,84. |
| Acide sec | 8 | 1 | 20,16 = 4700,16. |
Et les 8 onces 1 gros 20 grains 16 d'acide, sont eux-mêmes composés de
| onc. | gros | grains. | |
| Oxygène | 6 | 3 | 66,34 = 3738,34. |
| Mofète | 1 | 5 | 25,82 = 961,82. |
| On a donc réellement brûlé dans cette opération 2 gros 1 grain 1/3 de charbon, à l'aide de 3738,34 grains, ou 6 onces 3 gros 66,34 grains d'oxygène; & puisque la quantité de glace fondue dans cette combustion a été de 12 livres, il en résulte qu'une livre de gaz oxygène brûlé de la même manière, fondroit | 29,58320 |
| A quoi ajoutant pour la quantité de calorique que conserve une livre d'oxygène dans sa combinaison avec le charbon, pour constituer l'acide carbonique dans l'état de gaz, & qui est, comme on l'a vu plus haut, de | 29,13844 |
| On a pour la quantité totale de calorique que contient une livre d'oxygène, lorsqu'il est combiné dans l'acide nitrique, | 58,72164 |
| 112On a vu par le résultat de la combustion du phosphore, que dans l'état de gaz oxygène il en contenoit au moins | 66,66667 |
| Donc, en se combinant avec l'azote pour former de l'acide nitrique, il n'en perd que | 7,94502 |
Des expériences ultérieures apprendront si ce résultat déduit par le calcul, s'accorde avec des opérations plus directes.
Cette énorme quantité de calorique que l'oxygène porte avec lui dans l'acide nitrique, explique pourquoi dans toutes les détonations du nitre, ou pour mieux dire, dans toutes les occasions où l'acide nitrique se décompose, il y a un si grand dégagement de calorique.
Combustion de la Bougie.
Après avoir examiné quelques cas de combustions simples, je vais donner des exemples de combustions plus composées; je commence par la cire.
Une livre de cette substance, en brûlant paisiblement dans l'appareil à glace destiné à mesurer les quantités de calorique, fond 133 liv. 2 onces 5 gros 1/3 de glace.
Or une livre de bougie, suivant les expériences 113 que j'ai rapportées, Mém. de l'Acad. année 1784, page 606, contient:
| onc. | gros | grains. | |
| Charbon | 13 | 1 | 23 |
| Hydrogène | 2 | 6 | 49 |
| liv. de glace. | |
| Les 13 onces 1 gros 23 grains de charbon, d'après les expériences ci-dessus rapportées, devoient fondre | 79,39390 |
| Les 2 onces 6 gros 49 grains d'hydrogène, devoient fondre | 52,37605 |
| Total, | 131,76995 |
On voit par ces résultats, que la quantité de calorique qui se dégage de la bougie qui brûle, est assez exactement égale à celle qu'on obtiendroit en brûlant séparément un poids de charbon & d'hydrogène égal à celui qui entre dans sa combinaison. Les expériences sur la combustion de la bougie ayant été répétées plusieurs fois, j'ai lieu de présumer qu'elles sont exactes.
Combustion de l'Huile d'olives.
Nous avons enfermé dans l'appareil ordinaire une lampe qui contenoit une quantité d'huile d'olives bien connue; & l'expérience finie, nous avons déterminé exactement le poids de l'huile qui avoit été consommée, & celui de 114 la glace qui avoir été fondue; le résultat a été qu'une livre d'huile d'olives en brûlant pouvoit fondre 148 livr. 14 onc. 1 gros de glace.
Mais une livre d'huile d'olives, d'après les expériences que j'ai rapportées, Mémoires de l'Acad. année 1784, & dont on trouvera un extrait dans le chapitre suivant, contient:
| onc. | gros | grains. | |
| Charbon | 12 | 5 | 5 |
| Hydrogène | 3 | 2 | 67 |
| liv. de glace. | |
| La combustion de 12 onces 5 gros 5 grains de charbon, ne devoit fondre que | 76,18723 |
| Et celle de 3 onces 2 gros 67 grains d'hydrogène, | 62,15053 |
| Total, | 138,33776 |
| Il s'en est fondu | 148,88330 |
| Le dégagement de calorique a donc été plus considérable qu'il ne devoit l'être d'une quantité équivalente à | 10,54554 |
Cette différence qui n'est pas au surplus très-considérable peut tenir ou à des erreurs inévitables dans les expériences de ce genre, ou à ce que la composition de l'huile n'est pas encore assez rigoureusement connue. Mais il en 115 résulte toujours qu'il y a déjà beaucoup d'ensemble & d'accord dans la marche des expériences relatives à la combinaison & au dégagement du calorique.
Ce qui reste à faire dans ce moment & dont nous sommes occupés, est de déterminer ce que l'oxygène conserve de calorique dans sa combinaison avec les métaux pour les convertir en oxides; ce que l'hydrogène en contient dans les différens états dans lesquels il peut exister; enfin de connoître d'une manière plus exacte la quantité de calorique qui se dégage dans la formation de l'eau. Il nous reste sur cette détermination une incertitude assez grande qu'il est nécessaire de lever par de nouvelles expériences. Ces différens points bien connus, & nous espérons qu'ils le seront bientôt, nous nous trouverons vraisemblablement obligés de faire des corrections, peut-être même assez considérables, à la plupart des résultats que je viens d'exposer; mais je n'ai pas cru que ce fût une raison de différer d'en aider ceux qui pourront se proposer de travailler sur le même objet. Il est difficile quand on cherche les élémens d'une science nouvelle, de ne pas commencer par des à-peu-près; & il est rare qu'il soit possible de la porter dès le premier jet à son état de perfection.
116
CHAPITRE X.
De la combinaison des Substances combustibles les unes avec les autres.
Les substances combustibles étant en général celles qui ont une grande appétence pour l'oxygène, il en résulte qu'elles doivent avoir de l'affinité entr'elles, qu'elles doivent tendre à se combiner les unes avec les autres: quæ sunt eadem uni tertio sunt eadem inter se; & c'est ce qu'on observe en effet. Presque tous les métaux, par exemple, sont susceptibles de se combiner les uns avec les autres, & il en résulte un ordre de composés qu'on nomme alliage dans les usages de la société. Rien ne s'oppose à ce que nous adoptions cette expression: ainsi nous dirons que la plupart des métaux s'allient les uns avec les autres; que les alliages, comme toutes les combinaisons, sont susceptibles d'un ou de plusieurs degrés de saturation: que les substances métalliques dans cet état sont en général plus cassantes que les métaux purs, sur-tout lorsque les métaux alliés diffèrent beaucoup par leur degré de fusibilité; enfin nous ajouterons que c'est à cette différence des degrés de fusibilité 117 des métaux que sont dus une partie des phénomènes particuliers que présentent les alliages, tels, par exemple, que la propriété qu'ont quelques espèces de fer d'être cassans à chaud. Ces fers doivent être considérés comme un alliage de fer pur, métal presqu'infusible, avec une petite quantité d'un autre métal, quel qu'il soit, qui se liquéfie à une chaleur beaucoup plus douce. Tant qu'un alliage de cette espèce est froid, & que les deux métaux sont dans l'état solide, il peut être malléable: mais si on le chauffe à un degré suffisant pour liquéfier celui des deux métaux qui est le plus fusible, les parties liquides interposées entre les solides doivent rompre la solution de continuité, & le fer doit devenir cassant.
A l'égard des alliages du mercure avec les métaux, on a coutume de les désigner sous le nom d'amalgame, & nous n'avons vu aucun inconvénient à leur conserver cette dénomination.
Le soufre, le phosphore, le charbon sont également susceptibles de se combiner avec les métaux; les combinaisons du soufre ont été en général désignées sous le nom de pirites; les autres n'ont point été nommées, ou du moins elles ont reçu des dénominations si modernes que rien ne s'oppose à ce qu'elles soient changées.
118
Nous avons donné aux premières de ces combinaisons le nom de sulfures, aux secondes celui de phosphures, enfin aux troisièmes celui de carbures. Ainsi le soufre, le phosphore, le charbon oxygénés forment des oxides ou des acides; mais lorsqu'ils entrent dans des combinaisons sans s'être auparavant oxygénés, ils forment des sulfures, des phosphures & des carbures. Nous étendrons même ces dénominations aux combinaisons alkalines; ainsi nous désignerons sous le nom de sulfure de potasse la combinaison du soufre avec la potasse ou alkali fixe végétal, & sous le nom de sulfure d'ammoniaque la combinaison du soufre avec l'alkali volatil ou ammoniaque.
L'hydrogène, cette substance éminemment combustible est aussi susceptible de se combiner avec un grand nombre de substances combustibles. Dans l'état de gaz il dissout le carbone, le soufre, le phosphore & plusieurs métaux. Nous désignerons ces combinaisons sous le nom de gaz hydrogène carboné, de gaz hydrogène sulfuré, de gaz hydrogène phosphoré. Le second de ces gaz, le gaz hydrogène sulfuré est celui que les chimistes ont désigné sous le nom de gaz hépatique, & que M. Schéele a nommé gaz puant du soufre; c'est à lui que quelques eaux minérales doivent leurs vertus; 119 c'est aussi à son émanation que les déjections animales doivent principalement leur odeur infecte. A l'égard du gaz hydrogène phosphoré, il est remarquable par la propriété qu'il a de s'enflammer spontanément lorsqu'il a le contact de l'air ou mieux encore celui du gaz oxigène, comme l'a découvert M. Gengembre. Ce gaz a l'odeur du poisson pourri, & il est probable qu'il s'exhale en effet un véritable gaz hydrogène phosphoré de la chair des poissons par la putréfaction.
Lorsque l'hydrogène & le carbone s'unissent ensemble sans que l'hydrogène ait été porté à l'état de gaz par le calorique, il en résulte une combinaison particulière connue sous le nom d'huile, & cette huile est ou fixe ou volatile, suivant les proportions de l'hydrogène & du carbone.
Il ne sera pas inutile d'observer ici qu'un des principaux caractères qui distingue les huiles fixes retirées des végétaux par expression d'avec les huiles volatiles ou essentielles, c'est que les premières contiennent un excès de carbone qui s'en sépare lorsqu'on les échauffe au-delà du degré de l'eau bouillante: les huiles volatiles au contraire étant formées d'une plus juste proportion de carbone & d'hydrogène, ne sont point susceptibles d'être décomposées à un degré de 120 chaleur supérieur à l'eau bouillante; les deux principes qui les constituent demeurent unis; ils se combinent avec le calorique pour former un gaz, & c'est dans cet état que ces huiles passent dans la distillation.
J'ai donné la preuve que les huiles étoient ainsi composées d'hydrogène & de carbone dans un mémoire sur la combinaison de l'esprit de vin & des huiles avec l'oxygène, imprimé dans le recueil de l'Académie, année 1784, page 593. On y verra que les huiles fixes en brûlant dans le gaz oxygène se convertissent en eau & en acide carbonique, & qu'en appliquant le calcul à l'expérience, elles sont composées de 21 parties d'hydrogène & de 79 parties de carbone. Peut-être les substances huileuses solides, telles que la cire, contiennent-elles en outre un peu d'oxigène auquel elles doivent leur état solide. Je suis au surplus occupé dans ce moment d'expériences qui donneront un grand développement à toute cette théorie.
C'est une question bien digne d'être examinée, de savoir si l'hydrogène est susceptible de se combiner avec le soufre, le phosphore & même avec les métaux dans l'état concret. Rien n'indique sans doute à priori que ces combinaisons soient impossibles; car puisque les corps combustibles sont en général susceptibles de se 121 combiner les uns avec les autres, on ne voit pas pourquoi l'hydrogène feroit exception. Mais en même-tems aucune expérience directe ne prouve encore ni la possibilité ni l'impossibilité de cette union. Le fer & le zinc sont de tous les métaux ceux dans lesquels on seroit le plus en droit de soupçonner une combinaison d'hydrogène: mais en même-tems ces métaux ont la propriété de décomposer l'eau; & comme dans les expériences chimiques il est difficile de se débarrasser des derniers vestiges d'humidité, il n'est pas facile de s'assurer si les petites portions de gaz hydrogène qu'on obtient dans quelques expériences sur ces métaux leur étoient combinées, ou bien si elles proviennent de la décomposition de quelques molécules d'eau. Ce qu'il y a de certain, c'est que plus on prend soin d'écarter l'eau de ce genre d'expérience, plus la quantité de gaz hydrogène diminue, & qu'avec de très-grandes précautions on parvient à n'en avoir que des quantités presque insensibles.
Quoi qu'il en soit, que les corps combustibles, notamment le soufre, le phosphore & les métaux, soient susceptibles ou non d'absorber de l'hydrogène, on peut assurer au moins qu'il ne s'y combine qu'en très-petite quantité; & que cette combinaison loin d'être essentielle à leur 122 constitution, ne peut être regardée que comme une addition étrangère qui en altère la pureté. C'est au surplus à ceux qui ont embrassé ce systême à prouver par des expériences décisives l'existence de cet hydrogène, & jusqu'à présent ils n'ont donné que des conjectures appuyées sur des suppositions.

123
CHAPITRE XI.
Considérations sur les Oxides & les Acides à plusieurs bases, & sur la composition des matières végétales & animales.
Nous avons examiné dans le chapitre cinquième & dans le chapitre huitième quel étoit le résultat de la combustion & de l'oxygénation des quatre substances combustibles simples, le phosphore, le soufre, le carbone & l'hydrogène: nous avons fait voir dans le chapitre dixième que les substances combustibles simples étoient susceptibles de se combiner les unes avec les autres, pour former des corps combustibles composés, & nous avons observé que les huiles en général, principalement les huiles fixes des végétaux, appartenoient à cette classe, & qu'elles étoient toutes composées d'hydrogène & de carbone. Il me reste à traiter dans ce chapitre de l'oxygénation des corps combustibles composés, à faire voir qu'il existe des acides & des oxides à base double & triple, que la nature nous en fournit à chaque pas des exemples, & que c'est principalement par ce genre de combinaisons qu'elle est parvenue à former avec 124 un aussi petit nombre d'élémens ou de corps simples une aussi grande variété de résultats.
On avoit très-anciennement remarqué qu'en mêlant ensemble de l'acide muriatique & de l'acide nitrique, il en résultoit un acide mixte qui avoit des propriétés fort différentes de celles des deux acides dont il étoit composé. Cet acide a été célébre par la propriété qu'il a de dissoudre l'or, le Roi des métaux dans le langage alchimique, & c'est de-là que lui a été donnée la qualification brillante d'eau régale. Cet acide mixte, comme l'a très-bien prouvé M. Berthollet, a des propriétés particulières dépendantes de l'action combinée de ses deux bases acidifiables, & nous avons cru par cette raison devoir lui conserver un nom particulier. Celui d'acide nitro-muriatique nous a paru le plus convenable, parce qu'il exprime la nature des deux substances qui entrent dans sa composition.
Mais ce phénomène qui n'a été observé que pour l'acide nitro-muriatique se présente continuellement dans le règne végétal: il est infiniment rare d'y trouver un acide simple, c'est-à-dire qui ne soit composé que d'une seule base acidifiable. Tous les acides de ce règne ont pour base l'hydrogène & le carbone, quelquefois l'hydrogène, le carbone & le phosphore, 125 le tout combiné avec une proportion plus ou moins considérable d'oxygène. Le règne végétal a également des oxides qui sont formés des mêmes bases doubles & triples, mais moins oxygénées.
Les acides & oxides du règne animal sont encore plus composés; il entre dans la combinaison de la plupart quatre bases acidifiables, l'hydrogène, le carbone, le phosphore & l'azote.
Je ne m'étendrai pas beaucoup ici sur cette matière sur laquelle il n'y a pas long-tems que je me suis formé des idées claires & méthodiques: je la traiterai plus à fond dans des Mémoires que je prépare pour l'Académie. La plus grande partie de mes expériences sont faites, mais il est nécessaire que je les répète & que je les multiplie davantage, afin de pouvoir donner des résultats exacts pour les quantités. Je me contenterai en conséquence de faire une courte énumération des oxides & acides végétaux & animaux, & de terminer cet article par quelques réflexions sur la constitution végétale & animale.
Les oxides végétaux à deux bases sont le sucre, les différentes espèces de gomme que nous avons réunies sous le nom générique de muqueux, & l'amidon. Ces trois substances ont pour radical l'hydrogène & le carbone combinés 126 ensemble, de manière à ne former qu'une seule base, & portés à l'état d'oxide par une portion d'oxygène; ils ne diffèrent que par la proportion des principes qui composent la base. On peut de l'état d'oxide les faire passer à celui d'acide en leur combinant une nouvelle quantité d'oxygène, & on forme ainsi, suivant le degré d'oxygénation & la proportion de l'hydrogène & du carbone, les différens acides végétaux.
Il ne s'agiroit plus pour appliquer à la nomenclature des acides & des oxides végétaux les principes que nous avons précédemment établis pour les oxides & les acides minéraux, que de leur donner des noms relatifs à la nature des deux substances qui composent leur base. Les oxides & les acides végétaux seroient alors des oxides & des acides hydro-carboneux: bien plus on auroit encore dans cette méthode l'avantage de pouvoir indiquer sans périphrases quel est le principe qui est en excès, comme M. Rouelle l'avoit imaginé pour les extraits végétaux: il appeloit extracto-résineux celui où l'extrait dominoit, & résino-extractif celui qui participoit davantage de la résine.
En partant des mêmes principes, & en variant les terminaisons pour donner encore plus d'étendue à ce langage, on auroit pour désigner 127 les acides & les oxides végétaux, les dénominations suivantes:
- Oxide hydro-carboneux.
- Oxide hydro-carbonique.
- Oxide carbone-hydreux.
- Oxyde carbone-hydrique.
- Acide hydro-carboneux.
- Acide hydro-carbonique.
- Acide hydro-carbonique oxygéné.
- Acide carbone-hydreux.
- Acide carbone-hydrique.
- Acide carbone-hydrique oxygéné.
Il est probable que cette variété de langage sera suffisante pour indiquer toutes les variétés que nous présente la nature, & qu'à mesure que les acides végétaux seront bien connus, ils se rangeront naturellement & pour ainsi dire d'eux-mêmes dans le cadre que nous venons de présenter. Mais il s'en faut bien que nous soyons encore en état de pouvoir faire une classification méthodique de ces substances: nous savons quels sont les principes qui les composent, & il ne me reste plus aucun doute à cet égard; mais les proportions sont encore inconnues. Ce sont ces considérations qui nous ont déterminés à conserver provisoirement les 128 noms anciens; & maintenant encore que je suis un peu plus avancé dans cette carrière que je ne l'étois à l'époque où notre essai de nomenclature a paru, je me reprocherois de tirer des conséquences trop décidées d'expériences qui ne sont pas encore assez précises: mais en convenant que cette partie de la Chimie reste en souffrance, je puis y ajouter l'espérance qu'elle sera bientôt éclaircie.
Je me trouve encore plus impérieusement forcé de prendre le même parti à l'égard des oxides & des acides à trois & quatre bases, dont le règne animal présente un grand nombre d'exemples, & qui se rencontrent même quelquefois dans le règne végétal. L'azote, par exemple, entre dans la composition de l'acide prussique; il s'y trouve joint à l'hydrogène & au carbone, pour former une base triple; il entre également, à ce qu'on peut croire, dans l'acide gallique. Enfin presque tous les acides animaux ont pour base l'azote, le phosphore, l'hydrogène & le carbone. Une nomenclature qui entreprendroit d'exprimer à la fois ces quatre bases, seroit méthodique sans doute; elle auroit l'avantage d'exprimer des idées claires & déterminées: mais cette cumulation de substantifs & d'adjectifs grecs & latins, dont les Chimistes même n'ont point encore admis généralement l'usage, sembleroit 129 présenter un langage barbare, également difficile à retenir & à prononcer. La perfection d'ailleurs de la science doit précéder celle du langage, & il s'en faut bien que cette partie de la Chimie soit encore parvenue au point auquel elle doit arriver un jour. Il est donc indispensable de conserver, au moins pour un tems, les noms anciens pour les acides & oxides animaux. Nous nous sommes seulement permis d'y faire quelques légères modifications; par exemple, de terminer en eux la dénomination de ceux dans lesquels nous soupçonnons que le principe acidifiable est en excès, & de terminer au contraire en ique le nom de ceux dans lesquels nous avons lieu de croire que l'oxygène est prédominant.
Les acides végétaux qu'on connoît jusqu'à présent, sont au nombre de treize; savoir:
- L'acide acéteux.
- L'acide acétique.
- L'acide oxalique.
- L'acide tartareux.
- L'acide pyro-tartareux.
- L'acide citrique.
- L'acide malique.
- L'acide pyro-muqueux.
- L'acide pyro-ligneux.
- L'acide gallique.
- L'acide benzoïque.
- 130L'acide camphorique.
- L'acide succinique.
Quoique tous ces acides soient, comme je l'ai dit, principalement & presqu'uniquement composés d'hydrogène, de carbone & d'oxygène, ils ne contiennent cependant, à proprement parler, ni eau, ni acide carbonique, ni huile, mais seulement les principes propres à les former. La force d'attraction qu'exercent réciproquement l'hydrogène, le carbone & l'oxygène, est dans ces acides dans un état d'équilibre qui ne peut exister qu'à la température dans laquelle nous vivons: pour peu qu'on les échauffe au-delà du degré de l'eau bouillante, l'équilibre est rompu; l'oxygène & l'hydrogène se réunissent pour former de l'eau; une portion du carbone s'unit à l'hydrogène pour produire de l'huile; il se forme aussi de l'acide carbonique par la combinaison du carbone & de l'oxygène; enfin il se trouve presque toujours une quantité excédente de charbon qui reste libre. C'est ce que je me propose de développer un peu davantage dans le Chapitre suivant.
Les oxides du règne animal sont encore moins connus que ceux du règne végétal, & leur nombre même est encore indéterminé. La partie rouge du sang, la lymphe, presque toutes les sécrétions sont de véritables oxides; & c'est 131 sous ce point de vue qu'il est important de les étudier.
Quant aux acides animaux, le nombre de ceux qui sont connus se borne actuellement à six; encore est-il probable que plusieurs de ces acides rentrent les uns dans les autres, ou au moins ne diffèrent que d'une manière peu sensible. Ces acides sont:
- L'acide lactique.
- L'acide saccho-lactique.
- L'acide bombique.
- L'acide formique.
- L'acide sébacique.
- L'acide prussique.
Je ne place pas l'acide phosphorique au rang des acides animaux, parce qu'il appartient également aux trois règnes.
La connexion des principes qui constituent les acides & les oxides animaux, n'est pas plus solide que celle des acides & des oxides végétaux; un très-léger changement dans la température suffit pour la troubler, & c'est ce que j'espère rendre plus sensible par les observations que je vais rapporter dans le Chapitre suivant.
132
CHAPITRE XII.
De la décomposition des Matières végétales & animales par l'action du feu.
Pour bien concevoir ce qui se passe dans la décomposition des substances végétales par le feu, il faut non-seulement considérer la nature des principes qui entrent dans leur composition, mais encore les différentes forces d'attraction que les molécules de ces principes exercent les unes sur les autres, & en même-tems celle que le calorique exerce sur eux.
Les principes vraiment constitutifs des végétaux se réduisent à trois, comme je viens de l'exposer dans le Chapitre précédent; l'hydrogène, l'oxygène & le carbone. Je les appelle constitutifs, parce qu'ils sont communs à tous les végétaux, qu'il ne peut exister de végétaux sans eux; à la différence des autres substances qui ne sont essentielles qu'à la constitution de tel végétal en particulier, mais non pas de tous les végétaux en général.
De ces trois principes, deux, l'hydrogène & l'oxygène, ont une grande tendance à s'unir au calorique & à se convertir en gaz; tandis 133 que le carbone au contraire est un principe fixe & qui a très-peu d'affinité avec le calorique.
D'un autre côté, l'oxygène qui tend avec un degré de force à peu près égale à s'unir, soit avec l'hydrogène, soit avec le carbone, à la température habituelle dans laquelle nous vivons, a au contraire plus d'affinité avec le carbone à une chaleur rouge; l'oxygène quitte en conséquence à ce degré l'hydrogène, & s'unit au carbone pour former de l'acide carbonique.
Je me servirai quelquefois de cette expression chaleur rouge, quoiqu'elle n'exprime pas un degré de chaleur bien déterminée, mais beaucoup supérieure cependant à celle de l'eau bouillante.
Quoique nous soyons bien éloignés de connoître la valeur de toutes ces forces, & de pouvoir en exprimer l'énergie par des nombres, au moins sommes-nous certains par ce qui se passe journellement sous nos yeux, que quelque variables qu'elles soient en raison du degré de température, ou, ce qui est la même chose, en raison de la quantité de calorique avec lequel elles sont combinées, elles sont toutes à peu près en équilibre à la température dans laquelle nous vivons; ainsi les végétaux ne contiennent ni huile, ni eau, ni acide carbonique[B]; mais ils 134 contiennent les élémens de toutes ces substances. L'hydrogène n'est point combiné, ni avec l'oxygène, ni avec le carbone, & réciproquement; mais les molécules de ces trois substances forment une combinaison triple, d'où résultent le repos & l'équilibre.
Un changement très-léger dans la température suffit pour renverser tout cet échaffaudage de combinaisons, s'il est permis de se servir de cette expression. Si la température à laquelle le végétal est exposé n'excède pas beaucoup celle de l'eau bouillante, l'hydrogène & l'oxygène se réunissent & forment de l'eau qui passe dans la distillation; une portion d'hydrogène & de carbone s'unissent ensemble pour former de l'huile volatile, une autre portion de carbone devient libre, & comme le principe le plus fixe, il reste dans la cornue. Mais si au lieu d'une chaleur voisine de l'eau bouillante on applique à une substance végétale une chaleur rouge, alors ce n'est plus de l'eau qui se forme, ou plutôt même celle qui pouvoit s'être formée par la première impression de la chaleur se décompose; l'oxygène s'unit au carbone avec lequel il a plus d'affinité à ce degré; il se forme de l'acide carbonique, & l'hydrogène devenu libre s'échappe sous la forme de gaz, en s'unissant au calorique. Non-seulement à ce degré il ne 135 se forme point d'huile, mais s'il s'en étoit formé, elle seroit décomposée.
On voit donc que la décomposition des matières végétales se fait à ce degré, en vertu d'un jeu d'affinités doubles & triples, & que tandis que le carbone attire l'oxygène pour former de l'acide carbonique, le calorique attire l'hydrogène pour former du gaz hydrogène.
Il n'est point de substance végétale dont la distillation ne fournisse la preuve de cette théorie, si toutefois on peut appeler de ce nom un simple énoncé des faits. Qu'on distille du sucre; tant qu'on ne lui fera éprouver qu'une chaleur inférieure à celle de l'eau bouillante, il ne perdra qu'un peu d'eau de cristallisation; il sera toujours du sucre & il en conservera toutes les propriétés: mais sitôt qu'on l'expose à une chaleur tant soit peu supérieure à celle de l'eau bouillante, il noircit; une portion de carbone se sépare de la combinaison, en même tems il passe de l'eau légèrement acide, & un peu d'huile; le charbon qui reste dans la cornue, forme près d'un tiers du poids originaire.
Le jeu des affinités est encore plus compliqué dans les plantes qui contiennent de l'azote, comme les crucifères, & dans celles qui contiennent du phosphore; mais comme ces substances n'entrent qu'en petite quantité dans leur 136 combinaison, elles n'apportent pas de grands changemens, au moins en apparence, dans les phénomènes de la distillation: il paroît que le phosphore demeure combiné avec le charbon, qui lui communique de la fixité. Quant à l'azote, il s'unit à l'hydrogène pour former de l'ammoniaque ou alkali volatil.
Les matières animales étant composées à peu près des mêmes principes que les plantes crucifères, leur distillation donne le même résultat; mais comme elles contiennent plus d'hydrogène & plus d'azote, elles fournissent plus d'huile & plus d'ammoniaque. Pour faire connoître avec quelle ponctualité cette théorie rend compte de tous les phénomènes qui ont lieu dans la distillation des matières animales, je ne citerai qu'un fait; c'est la rectification & la décomposition totale des huiles volatiles animales, appelées vulgairement huiles de Dippel. Ces huiles, lorsqu'on les obtient par une première distillation à feu nud, sont brunes, parce qu'elles contiennent un peu de charbon presque libre; mais elles deviennent blanches par la rectification. Le carbone tient si peu à ces combinaisons, qu'il s'en sépare par leur simple exposition à l'air. Si on place une huile volatile animale bien rectifiée & par conséquent blanche, limpide & transparente, sous une cloche remplie 137 de gaz oxygène, en peu de tems le volume du gaz diminue & il est absorbé par l'huile. L'oxygène se combine avec l'hydrogène de l'huile, pour former de l'eau qui tombe au fond; en même tems la portion de charbon qui étoit combinée avec l'hydrogène, devient libre & se manifeste par sa couleur noire. C'est par cette raison que ces huiles ne se conservent blanches & claires, qu'autant qu'on les enferme dans des flacons bien bouchés, & qu'elles noircissent dès qu'elles ont le contact de l'air.
Les rectifications successives de ces mêmes huiles présentent un autre phénomène confirmatif de cette théorie. A chaque fois qu'on les distille, il reste un peu de charbon au fond de la cornue, en même tems il se forme un peu d'eau par la combinaison de l'oxygène de l'air des vaisseaux avec l'hydrogène de l'huile. Comme ce même phénomène a lieu à chaque distillation de la même huile, il en résulte qu'au bout d'un grand nombre de rectifications successives, sur-tout si on opère à un degré de feu un peu fort & dans des vaisseaux d'une capacité un peu grande, la totalité de l'huile se trouve décomposée, & l'on parvient à la convertir entièrement en eau & en charbon. Cette décomposition totale de l'huile par des 138 rectifications répétées, est beaucoup plus longue & beaucoup plus difficile, quand on opère avec des vaisseaux d'une petite capacité, & sur-tout à un degré de feu lent & peu supérieur à celui de l'eau bouillante. Je rendrai compte à l'Académie, dans un Mémoire particulier, du détail de mes expériences sur cette décomposition des huiles; mais ce que j'ai dit me paroît suffire pour donner des idées précises de la constitution des matières végétales & animales, & de leur décomposition par le feu.

139
CHAPITRE XIII.
De la décomposition des Oxides végétaux par la fermentation vineuse.
Tout le monde sait comment se fait le vin, le cidre, l'hidromel & en général toutes les boissons fermentées spiritueuses. On exprime le jus des raisins & des pommes; on étend d'eau ce dernier; on met la liqueur dans de grandes cuves, & on la tient dans un lieu dont la température soit au moins de 10 degrés du thermomètre de Réaumur. Bientôt il s'y excite un mouvement rapide de fermentation, des bulles d'air nombreuses viennent crêver à la surface, & quand la fermentation est à son plus haut période, la quantité de ces bulles est si grande, la quantité de gaz qui se dégage est si considérable, qu'on croiroit que la liqueur est sur un brâsier ardent qui y excite une violente ébullition. Le gaz qui se dégage est de l'acide carbonique, & quand on le recueille avec soin, il est parfaitement pur & exempt du mêlange de toute autre espèce d'air ou de gaz.
Le suc des raisins, de doux & de sucré qu'il étoit, se change dans cette opération en une liqueur 140 vineuse qui, lorsque la fermentation est complette, ne contient plus de sucre, & dont on peut retirer par distillation une liqueur inflammable qui est connue dans le commerce & dans les arts sous le nom d'esprit de vin. On sent que cette liqueur étant un résultat de la fermentation d'une matière sucrée quelconque suffisamment étendue d'eau, il auroit été contre les principes de notre nomenclature de la nommer plutôt esprit de vin qu'esprit de cidre, ou esprit de sucre fermenté. Nous avons donc été forcés d'adopter un nom plus général, & celui d'alkool qui nous vient des arabes nous a paru propre à remplir notre objet.
Cette opération est une des plus frappantes & des plus extraordinaires de toutes celles que la Chimie nous présente, & nous avons à examiner d'où vient le gaz acide carbonique qui se dégage, d'où vient l'esprit inflammable qui se forme, & comment un corps doux, un oxide végétal peut se transformer ainsi en deux substances si différentes, dont l'une est combustible, l'autre éminemment incombustible. On voit que pour arriver à la solution de ces deux questions, il falloit d'abord bien connoître l'analyse & la nature du corps susceptible de fermenter, & les produits de la fermentation; car rien ne se crée, ni dans les opérations de l'art, ni dans 141 celles de la nature, & l'on peut poser en principes que dans toute opération, il y a une égale quantité de matière avant & après l'opération; que la qualité & la quantité des principes est la même, & qu'il n'y a que des changemens, des modifications.
C'est sur ce principe qu'est fondé tout l'art de faire des expériences en Chimie: on est obligé de supposer dans toutes une véritable égalité ou équation entre les principes du corps qu'on examine, & ceux qu'on en retire par l'analyse. Ainsi puisque du moût de raisin donne du gaz acide carbonique & de l'alkool, je puis dire que le moût de raisin = acide carbonique + alkool. Il résulte de-là qu'on peut parvenir de deux manières à éclaircir ce qui se passe dans la fermentation vineuse; la première, en déterminant bien la nature & les principes du corps fermentescible; la seconde, en observant bien les produits qui en résultent par la fermentation, & il est évident que les connoissances que l'on peut acquérir sur l'un conduisent à des conséquences certaines sur la nature des autres, & réciproquement.
Il étoit important d'après cela que je m'attachasse à bien connoître les principes constituans du corps fermentescible. On conçoit que pour y parvenir je n'ai pas été chercher les 142 sucs de fruits très-composés, & dont une analyse rigoureuse seroit peut-être impossible. J'ai choisi de tous les corps susceptibles de fermenter le plus simple; le sucre dont l'analyse est facile, & dont j'ai déjà précédemment fait connoître la nature. On se rappelle que cette substance est un véritable oxide végétal, un oxide à deux bases; qu'il est composé d'hydrogène & de carbone porté à l'état d'oxide par une certaine proportion d'oxygène, & que ces trois principes sont dans un état d'équilibre qu'une force très-légère suffit pour rompre: une longue suite d'expériences faites par différentes voies & que j'ai répétées bien des fois, m'a appris que les proportions des principes qui entrent dans la composition du sucre sont à-peu-près les suivantes.
| Hydrogène, | 8 | parties. |
| Oxygène, | 64 | |
| Carbone, | 28 | |
| Total, | 100 |
Pour faire fermenter le sucre il faut d'abord l'étendre d'environ quatre parties d'eau. Mais de l'eau & du sucre mêlés ensemble, dans quelque proportion que ce soit, ne fermenteroient jamais seuls, & l'équilibre subsisteroit toujours entre les principes de cette combinaison, 143 si on ne le rompoit par un moyen quelconque. Un peu de levure de bierre suffit pour produire cet effet & pour donner le premier mouvement à la fermentation: elle se continue ensuite d'elle-même jusqu'à la fin. Je rendrai compte ailleurs des effets de la levure & de ceux des fermens en général. J'ai communément employé dix livres de levure en pâte pour un quintal de sucre, & une quantité d'eau égale à quatre fois le poids du sucre: ainsi la liqueur fermentescible se trouvoit composée ainsi qu'il suit: je donne ici les résultats de mes expériences tels que je les ai obtenus, & en conservant même jusqu'aux fractions que m'a données le calcul de réduction.
Matériaux de la fermentation pour un quintal de sucre.
| liv. | onc. | gr. | gr. | |||
| Eau | 400 | » | » | » | ||
| Sucre | 100 | » | » | » | ||
| Levure de biere en pâte, composée de | Eau | 7 | 3 | 6 | 44 | |
| Levure seche | 2 | 12 | 1 | 28 | ||
| Total | 510 | » | » | » | ||
144
Détail des principes constituans des matériaux de la fermentation.
| livres | onces | gros | grains | |||
| 407 livres 3 onces 6 gros 44 grains d'eau composées de | Hydrogène | 61 | 1 | 2 | 71,40 | |
| Oxygène | 346 | 2 | 3 | 44,60 | ||
| 100 livres de sucre composées de | Hydrogène | 8 | » | » | » | |
| Oxygène | 64 | » | » | » | ||
| Carbone | 28 | » | » | » | ||
| 2 livres 12 onces 1 gros 28 grains de levure seche composées de | Carbone | » | 12 | 4 | 59,00 | |
| Azote | » | » | 5 | 2,94 | ||
| Hydrogène | » | 4 | 5 | 9,30 | ||
| Oxygène | 1 | 10 | 2 | 28,76 | ||
| Total | 510 | » | » | » | ||
Récapitulation des principes constituans des matériaux de la fermentation.
| liv. | on. | gr. | grains. | liv. | onc. | gr. | gr. | ||||
| Oxygène | de l'eau | 340 | » | » | » | 411 | 12 | 6 | 1,36 | ||
| de l'eau de la levure | 6 | 2 | 3 | 44,60 | |||||||
| du sucre | 64 | » | » | » | |||||||
| de la levure | 1 | 10 | 2 | 28,76 | |||||||
| Hydrogène | de l'eau | 60 | » | » | » | 69 | 6 | » | 8,70 | ||
| de l'eau de la levure | 1 | 1 | 2 | 71,40 | |||||||
| du sucre | 8 | » | » | » | |||||||
| de la levure | » | 4 | 5 | 9,30 | |||||||
| Carbone | du sucre | 28 | » | » | » | 28 | 12 | 4 | 59,00 | ||
| de la levure | » | 12 | 4 | 59,00 | |||||||
| Azote | de la levure | » | » | 5 | 2,94 | ||||||
| Total | 510 | » | » | » | |||||||
145
Après avoir bien déterminé quelle est la nature & la quantité des principes qui constituent les matériaux de la fermentation, il reste à examiner quels en sont les produits. Pour parvenir à les connoître, j'ai commencé par renfermer les 510 livres de liqueur ci-dessus dans un appareil, par le moyen duquel je pouvois, non-seulement déterminer la qualité & la quantité des gaz à mesure qu'ils se dégageoient, mais encore peser chacun des produits séparément, à telle époque de la fermentation que je le jugeois à propos. Il seroit trop long de décrire ici cet appareil, qui se trouve au surplus décrit dans la troisième partie de cet Ouvrage. Je me bornerai donc à rendre compte des effets.
Une heure ou deux après que le mêlange est fait, sur-tout si la température dans laquelle on opère est de 15 à 18 degrés, on commence à appercevoir les premiers indices de la fermentation: la liqueur se trouble & devient écumeuse; il s'en dégage des bulles qui viennent crêver à la surface: bientôt la quantité de ces bulles augmente, & il se fait un dégagement abondant & rapide de gaz acide carbonique très-pur accompagné d'écume qui n'est autre chose que de la levure qui se sépare. Au bout de quelques jours, suivant le degré de 146 chaleur, le mouvement & le dégagement de gaz diminue, mais il ne cesse pas entièrement; & ce n'est qu'après un intervalle de tems assez long que la fermentation est achevée.
Le poids de l'acide carbonique sec qui se dégage dans cette opération est de 35 livres 5 onces 4 gros 19 grains.
Ce gaz entraîne en outre avec lui une portion assez considérable d'eau qu'il tient en dissolution, & qui est environ de 13 livres 14 onces 5 gros.
Il reste dans le vase dans lequel on opère une liqueur vineuse légèrement acide, d'abord trouble, qui s'éclaircit ensuite d'elle-même, & qui laisse déposer une portion de levure. Cette liqueur pèse en totalité 460 livres 11 onces 6 gros 53 grains.
Enfin en analysant séparément toutes ces substances, & en les résolvant dans leurs parties constituantes, on trouve après un travail très-pénible les résultats qui suivent, qui seront détaillés dans les mémoires de l'Académie.
147
Tableau des résultats obtenus par la fermentation.
| liv. | on. | gr. | gr. | |||
| 35 livres 5 onces 4 gros 19 grains d'acide carbonique composées | d'oxygène | 25 | 7 | 1 | 34 | |
| de carbone | 9 | 14 | 2 | 57 | ||
| 408 livres 15 onces 5 gros 14 grains d'eau composées | d'oxygène | 347 | 10 | » | 59 | |
| d'hydrogène | 61 | 5 | 4 | 27 | ||
| 57 livres 11 onces 1 gros 58 grains d'alkool sec, composées | d'oxygène combiné avec l'hydrogène | 31 | 6 | 1 | 64 | |
| d'hydrogène combiné avec l'oxygène | 5 | 8 | 5 | 3 | ||
| d'hydrogène combiné avec le carbone | 4 | » | 5 | » | ||
| de carbone | 16 | 11 | 5 | 63 | ||
| 2 livres 8 onces d'acide acéteux sec composées | d'hydrogène | 2 | 4 | » | ||
| d'oxygène | 1 | 11 | 4 | » | ||
| de carbone | 10 | » | » | |||
| 4 livres 1 once 4 gros 3 grains de résidu sucré composées | d'hydrogène | 5 | 1 | 67 | ||
| d'oxygène | 2 | 9 | 7 | 27 | ||
| de carbone | 1 | 2 | 2 | 53 | ||
| 1 livre 6 onces 50 grains de levure seche composées | d'hydrogène | 2 | 2 | 41 | ||
| d'oxygène | 13 | 1 | 14 | |||
| de carbone | 6 | 2 | 30 | |||
| d'azote | 2 | 37 | ||||
| 510 livres | 510 | » | » | » |
148
Récapitulation des résultats obtenus par la fermentation.
| liv. | on. | gr. | gr. | |||
| 409 livres 10 onces 54 grains d'oxygène | de l'eau | 347 | 10 | » | 59 | |
| de l'acide carbonique | 25 | 7 | 1 | 34 | ||
| de l'alkool | 31 | 6 | 1 | 64 | ||
| de l'acide acéteux | 1 | 11 | 4 | » | ||
| du résidu sucré | 2 | 9 | 7 | 27 | ||
| de la levure | 13 | 1 | 14 | |||
| 28 livres 12 onces 5 gros 59 grains de carbone | de l'acide carbonique | 9 | 14 | 2 | 57 | |
| de l'alkool | 16 | 11 | 5 | 63 | ||
| de l'acide acéteux | 10 | » | » | |||
| du résidu sucré | 1 | 2 | 2 | 53 | ||
| de la levure | 6 | 2 | 30 | |||
| 71 livres 8 onces 6 gros 66 grains d'hydrogène | de l'eau | 61 | 5 | 4 | 27 | |
| de l'eau de l'alkool | 5 | 8 | 5 | 3 | ||
| combiné avec le carbone dans l'alkool | 4 | » | 5 | » | ||
| de l'acide acéteux | 2 | 4 | » | |||
| du résidu sucré | 5 | 1 | 67 | |||
| de la levure | 2 | 2 | 41 | |||
| 2 gros 37 grains d'azote | 2 | 37 | ||||
| 510 livres | 510 | » | » | » |
Quoique dans ces résultats j'aye porté jusqu'aux grains la précision du calcul, il s'en faut bien que ce genre d'expériences puisse comporter encore une aussi grande exactitude; mais comme je n'ai opéré que sur quelques livres de sucre, & que pour établir des comparaisons j'ai été obligé de les réduire au quintal, j'ai cru 149 devoir laisser subsister les fractions telles que le calcul me les a données.
En réfléchissant sur les résultats que présentent les tableaux ci-dessus, il est aisé de voir clairement ce qui se passe dans la fermentation vineuse. On remarque d'abord que sur les cent livres de sucre qu'on a employées, il y en a eu 4 livres 1 once 4 gros 3 grains qui sont restées dans l'état de sucre non-décomposé, en sorte qu'on n'a réellement opéré que sur 95 livres 14 onces 5 gros 69 grains de sucre; c'est-à-dire, sur 61 livres 6 onces 45 grains d'oxygène, sur 7 livres 10 onces 6 gros 6 grains d'hydrogène, & sur 26 livres 13 onces 5 gros 19 grains de carbone. Or en comparant ces quantités on verra qu'elles sont suffisantes pour former tout l'esprit de vin ou alkool, tout l'acide carbonique & tout l'acide acéteux qui a été produit par l'effet de la fermentation. Il n'est donc point nécessaire de supposer que l'eau se décompose dans cette opération: à moins qu'on ne prétende que l'oxygène & l'hydrogène sont dans l'état d'eau dans le sucre; ce que je ne crois pas, puisque j'ai établi au contraire qu'en général les trois principes constitutifs des végétaux, l'hydrogène, l'oxygène & le carbone étoient entr'eux dans un état d'équilibre; que cet état d'équilibre subsistoit tant qu'il n'étoit 150 point troublé, soit par un changement de température, soit par une double affinité, & que ce n'étoit qu'alors que les principes se combinant deux à deux formoient de l'eau & de l'acide carbonique.
Les effets de la fermentation vineuse se réduisent donc à séparer en deux portions le sucre qui est un oxide; à oxygéner l'une aux dépens de l'autre pour en former de l'acide carbonique; à désoxygéner l'autre en faveur de la première pour en former une substance combustible qui est l'alkool: en sorte que s'il étoit possible de recombiner ces deux substances, l'alkool & l'acide carbonique, on reformeroit du sucre. Il est à remarquer au surplus que l'hydrogène & le carbone ne sont pas dans l'état d'huile dans l'alkool; ils sont combinés avec une portion d'oxygène qui les rend miscibles à l'eau: les trois principes, l'oxygène, l'hydrogène & le carbone, sont donc encore ici dans une espèce d'état d'équilibre; & en effet, en les faisant passer à travers un tube de verre ou de porcelaine rougi au feu, on les recombine deux à deux, & on retrouve de l'eau, de l'hydrogène, de l'acide carbonique & du carbone.
J'avois avancé d'une manière formelle dans mes premiers Mémoires sur la formation de l'eau, que cette substance regardée comme un 151 élément, se décomposoit dans un grand nombre d'opérations chimiques, notamment dans la fermentation vineuse: je supposois alors qu'il existoit de l'eau toute formée dans le sucre, tandis que je suis persuadé aujourd'hui qu'il contient seulement les matériaux propres à la former. On conçoit qu'il a dû m'en coûter pour abandonner mes premières idées; aussi n'est-ce qu'après plusieurs années de réflexions, & d'après une longue suite d'expériences & d'observations sur les végétaux, que je m'y suis déterminé.
Je terminerai ce que j'ai à dire sur la fermentation vineuse, en observant qu'elle peut fournir un moyen d'analyse du sucre & en général des substances végétales susceptibles de fermenter. En effet, comme je l'ai déjà indiqué au commencement de cet article, je puis considérer les matières mises à fermenter & le résultat obtenu après la fermentation, comme une équation algébrique; & en supposant successivement chacun des élémens de cette équation inconnus, j'en puis tirer une valeur, & rectifier ainsi l'expérience par le calcul & le calcul par l'expérience. J'ai souvent profité de cette méthode pour corriger les premiers résultats de mes expériences, & pour me guider dans les précautions à prendre pour les recommencer: 152 mais ce n'est pas ici le moment d'entrer dans ces détails sur lesquels je me suis au surplus étendu fort au long dans le Mémoire que j'ai donné à l'Académie sur la Fermentation vineuse, & qui sera incessamment imprimé.

153
CHAPITRE XIV.
De la Fermentation putride.
Je viens de faire voir comment le corps sucré se décomposoit, lorsqu'il étoit étendu d'une certaine quantité d'eau & à l'aide d'une douce chaleur; comment les trois principes qui le constituent, l'oxygène, l'hydrogène & le carbone, qui étoient dans un état d'équilibre & qui ne formoient dans l'état de sucre ni de l'eau, ni de l'huile, ni de l'acide carbonique, se séparoient pour se combiner dans un autre ordre; comment une portion de carbone se réunissoit à l'oxygène pour former de l'acide carbonique; comment une autre portion de carbone se combinoit avec de l'hydrogène & avec de l'eau pour former de l'alkool.
Les phénomènes de la putréfaction s'opèrent de même en vertu d'affinités très-compliquées. Les trois principes constitutifs du corps cessent également, dans cette opération, d'être dans un état d'équilibre: au lieu d'une combinaison ternaire, il se forme des combinaisons binaires; mais le résultat de ces combinaisons est bien différent de celui que donne la fermentation 154 vineuse. Dans cette dernière, une partie des principes de la substance végétale, l'hydrogène par exemple, reste uni à une portion d'eau & de carbone pour former de l'alkool. Dans la fermentation putride au contraire, la totalité de l'hydrogène se dissipe sous la forme de gaz hydrogène: en même tems l'oxygène & le carbone se réunissant au calorique, s'échappent sous la forme de gaz acide carbonique. Enfin quand l'opération est entièrement achevée, sur-tout si la quantité d'eau nécessaire pour la putréfaction n'a pas manqué, il ne reste plus que la terre du végétal mêlée d'un peu de carbone & de fer.
La putréfaction des végétaux n'est donc autre chose qu'une analyse complette des substances végétales dans laquelle la totalité de leurs principes constitutifs se dégage sous forme de gaz, à l'exception de la terre qui reste dans l'état de ce qu'on nomme terreau.
Je donnerai dans la troisième partie de cet Ouvrage, une idée des appareils qu'on peut employer pour ce genre d'expériences.
Tel est le résultat de la putréfaction, quand le corps qu'on y soumet ne contient que de l'oxygène, de l'hydrogène, du carbone & un peu de terre: mais ce cas est rare, & il paroît même que ces substances, lorsqu'elles sont seules, 155 fermentent difficilement; qu'elles fermentent mal, & qu'il faut un tems considérable pour que la putréfaction soit complette. Il n'en est pas de même quand la substance mise à fermenter contient de l'azote; & c'est ce qui a lieu à l'égard de toutes les matières animales & même d'un assez grand nombre de matières végétales. Ce nouvel ingrédient favorise merveilleusement la putréfaction: c'est pour cette raison qu'on mêlange les matières animales avec les végétales, lorsqu'on veut hâter la putréfaction; & c'est dans ce mêlange que consiste presque toute la science des amendemens & des fumiers.
Mais l'introduction de l'azote dans les matériaux de la putréfaction, ne produit pas seulement l'effet d'en accélérer les phénomènes; elle forme, en se combinant avec l'hydrogène, une nouvelle substance connue sous le nom d'alkali volatil ou ammoniaque. Les résultats qu'on obtient en analysant les matières animales par différens procédés, ne laissent aucun doute sur la nature des principes qui constituent l'ammoniaque. Toutes les fois qu'on sépare préalablement l'azote de ces matières, elles ne donnent plus d'ammoniaque, & elles n'en donnent qu'autant qu'elles contiennent de l'azote. Cette composition de l'ammoniaque est d'ailleurs 156 confirmée par des expériences analytiques, que M. Berthollet a détaillées dans les Mémoires de l'Acad. année 1785, page 316; il a donné différens moyens de décomposer cette substance & d'obtenir séparément les deux principes, l'azote & l'hydrogène, qui entrent dans sa combinaison.
J'ai déjà annoncé plus haut (voyez Chapitre dixième) que les corps combustibles étoient presque tous susceptibles de se combiner les uns avec les autres. Le gaz hydrogène a éminemment cette propriété; il dissout le carbone, le soufre & le phosphore, & il résulte de ces combinaisons ce que j'ai appelé plus haut, gaz hydrogène carboné, gaz hydrogène sulfuré, gaz hydrogène phosphoré. Les deux derniers de ces gaz ont une odeur particulière & très-désagréable: celle du gaz hydrogène sulfuré a beaucoup de rapport avec celle des œufs gâtés & corrompus; celle du gaz hydrogène phosphoré est absolument la même que celle du poisson pourri; enfin l'ammoniaque a une odeur qui n'est ni moins pénétrante, ni moins désagréable que les précédentes. C'est de la combinaison de ces différentes odeurs que résulte celle qui s'exhale des matières animales en putréfaction, & qui est si fétide. Tantôt c'est l'odeur de l'ammoniaque qui est prédominante, 157 & on la reconnoît aisément à ce qu'elle pique les yeux; tantôt c'est celle du soufre, comme dans les matières fécales; tantôt enfin, c'est celle du phosphore, comme dans le hareng pourri.
J'ai supposé jusqu'ici que rien ne dérangeoit le cours de la fermentation, & n'en troubloit les effets. Mais M. de Fourcroy & M. Thouret ont observé, relativement à des cadavres enterrés à une certaine profondeur & garantis jusqu'à un certain point du contact de l'air, des phénomènes particuliers. Ils ont remarqué que souvent la partie musculaire se convertissoit en une véritable graisse animale. Ce phénomène tient à ce que, par quelque circonstance particulière, l'azote que contenoient ces matières animales aura été dégagé, & à ce qu'il n'est resté que de l'hydrogène & du carbone, c'est-à-dire, les matériaux propres à faire de la graisse. Cette observation sur la possibilité de convertir en graisse les matières animales, peut conduire un jour à des découvertes importantes sur le parti qu'on en peut tirer pour les usages de la société. Les déjections animales, telles que les matières fécales, sont principalement composées de carbone & d'hydrogène; elles se rapprochent donc beaucoup de l'état d'huile, & en effet elles en fournissent beaucoup par la distillation à feu nud. Mais 158 l'odeur insoutenable qui accompagne tous les produits qu'on en retire, ne permet pas d'espérer de long-tems qu'on puisse les employer à autre chose qu'à faire des engrais.
Je n'ai donné dans ce Chapitre que des apperçus, parce que la composition des matières animales n'est pas encore très-exactement connue. On sait qu'elles sont composées d'hydrogène, de carbone, d'azote, de phosphore, de soufre; le tout porté à l'état d'oxide par une quantité plus ou moins grande d'oxygène: mais on ignore absolument quelle est la proportion de ces principes. Le tems complétera cette partie de l'analyse chimique, comme il en a complété déjà quelques autres.

159
CHAPITRE XV.
De la Fermentation acéteuse.
La fermentation acéteuse n'est autre chose que l'acidification du vin qui se fait à l'air libre par l'absorption de l'oxygène. L'acide qui en résulte est l'acide acéteux, vulgairement appelé vinaigre: il est composé d'une proportion qui n'a point encore été déterminée, d'hydrogène & de carbone combinés ensemble, & portés à l'état d'acide par l'oxygène.
Le vinaigre étant un acide, l'analogie conduisoit seule à conclure qu'il contenoit de l'oxygène; mais cette vérité est prouvée de plus par des expériences directes. Premièrement le vin ne peut se convertir en vinaigre qu'autant qu'il a le contact de l'air, & qu'autant que cet air contient du gaz oxygène. Secondement cette opération est accompagnée d'une diminution du volume de l'air dans lequel elle se fait, & cette diminution de volume est occasionnée par l'absorption du gaz oxygène. Troisièmement on peut transformer le vin en vinaigre, en l'oxygénant par quelqu'autre moyen que ce soit.
Indépendamment de ces faits qui prouvent 160 que l'acide acéteux est un résultat de l'oxygénation du vin, une expérience de M. Chaptal, professeur de Chimie à Montpellier, fait voir clairement ce qui se passe dans cette opération. Il prend du gaz acide carbonique dégagé de la bière en fermentation; il en imprègne de l'eau jusqu'à saturation, c'est-à-dire, jusqu'à ce qu'elle en ait absorbé environ une quantité égale à son volume; il met cette eau à la cave dans des vaisseaux qui ont communication avec l'air, & au bout de quelque tems le tout se trouve converti en acide acéteux. Le gaz acide carbonique des cuves de bière en fermentation, n'est pas entièrement pur; il est mêlé d'un peu d'alkool qu'il tient en dissolution: il y a donc dans l'eau imprégnée d'acide carbonique dégagé de la fermentation vineuse, tous les matériaux nécessaires pour former de l'acide acéteux. L'alkool fournit l'hydrogène & une portion de carbone; l'acide carbonique fournit du carbone & de l'oxygène; enfin l'air de l'atmosphère doit fournir ce qui manque d'oxygène pour porter le mêlange à l'état d'acide acéteux.
On voit par-là qu'il ne faut qu'ajouter de l'hydrogène à l'acide carbonique pour le constituer acide acéteux, ou pour parler plus généralement, pour le transformer en un acide végétal quelconque, suivant le degré d'oxygénation; 161 qu'il ne faut au contraire que retrancher de l'hydrogène aux acides végétaux pour les convertir en acide carbonique.
Je ne m'étendrai pas davantage sur la fermentation acéteuse à l'égard de laquelle nous n'avons pas encore d'expériences exactes; les faits principaux sont connus, mais l'exactitude numérique manque. On voit d'ailleurs que la théorie de l'acétification est étroitement liée à celle de la constitution de tous les acides & oxides végétaux, & nous ne connoissons point encore la proportion des principes dont ils sont composés. Il est aisé de s'appercevoir cependant que toute cette partie de la chimie marche rapidement comme toutes les autres, vers sa perfection, & qu'elle est beaucoup plus simple qu'on ne l'avoit cru jusqu'ici.

162
CHAPITRE XVI.
De la formation des Sels neutres, & des différentes bases qui entrent dans leur composition.
Nous avons vu comment un petit nombre de substances simples, ou au moins qui n'ont point été décomposées jusqu'ici, telles que l'azote, le soufre, le phosphore, le carbone, le radical muriatique & l'hydrogène, formoient en se combinant avec l'oxygène tous les oxides & les acides du règne végétal & du règne animal: nous avons admiré avec quelle simplicité de moyens la nature multiplioit les propriétés & les formes, soit en combinant ensemble jusqu'à trois & quatre bases acidifiables dans différentes proportions, soit en changeant la dose d'oxygène destiné à les acidifier. Nous ne la trouverons ni moins variée, ni moins simple, ni sur-tout moins féconde dans l'ordre de choses que nous allons parcourir.
Les substances acidifiables en se combinant avec l'oxygène, & en se convertissant en acides, acquièrent une grande tendance à la combinaison; elles deviennent susceptibles de s'unir avec des substances terreuses & métalliques, & c'est 163 de cette réunion que résultent les sels neutres. Les acides peuvent donc être regardés comme de véritables principes salifians, & les substances auxquelles ils s'unissent pour former des sels neutres, comme des bases salifiables: c'est précisément de la combinaison des principes salifians avec les bases salifiables que nous allons nous occuper dans cet article.
Cette manière d'envisager les acides ne me permet pas de les regarder comme des sels, quoiqu'ils aient quelques-unes de leurs propriétés principales, telles que la solubilité dans l'eau, &c. Les acides, comme je l'ai déjà fait observer, résultent d'un premier ordre de combinaisons; ils sont formés de la réunion de deux principes simples, ou au moins qui se comportent à la manière des principes simples, & ils sont par conséquent pour me servir de l'expression de Stahl, dans l'ordre des mixtes. Les sels neutres, au contraire, sont d'un autre ordre de combinaisons, ils sont formés de la réunion de deux mixtes, & ils rentrent dans la classe des composés. Je ne rangerai pas non plus, par la même cause, les alkalis[6] ni les substances terreuses, telles que la chaux, la magnésie, &c. dans la 164 classe des sels, & je ne désignerai par ce nom que des composés formés de la réunion d'une substance simple oxygénée avec une base quelconque.
Je me suis suffisamment étendu dans les chapitres précédens sur la formation des acides, & je n'ajouterai rien à cet égard; mais je n'ai rien dit encore des bases qui sont susceptibles de se combiner avec eux pour former des sels neutres; ces bases que je nomme salifiables, sont:
- La potasse.
- La soude.
- L'ammoniaque.
- La chaux.
- La magnésie.
- La baryte.
- L'alumine.
Et toutes les substances métalliques.
Je vais dire un mot de l'origine & de la nature de chacune de ces bases en particulier.
De la Potasse.
Nous avons déjà fait observer que lorsqu'on 165 échauffoit une substance végétale dans un appareil distillatoire, les principes qui la composent, l'oxygène, l'hydrogène & le carbone, & qui formoient une combinaison triple dans un état d'équilibre, se réunissoient deux à deux en obéissant aux affinités qui doivent avoir lieu suivant le degré de température. Ainsi à la première impression du feu, & dès que la chaleur excède celle de l'eau bouillante, l'oxygène & l'hydrogène se réunissent pour former de l'eau. Bientôt après une portion de carbone & une d'hydrogène se combinent pour former de l'huile. Lorsqu'ensuite par le progrès de la distillation on est parvenu à une chaleur rouge, l'huile & l'eau même qui s'étoient formées se décomposent; l'oxygène & le carbone forment l'acide carbonique, une grande quantité de gaz hydrogène devenu libre se dégage & s'échappe; enfin il ne reste plus que du charbon dans la cornue.
La plus grande partie de ces phénomènes se retrouvent dans la combustion des végétaux à l'air libre: mais alors la présence de l'air, introduit dans l'opération trois ingrédiens nouveaux, dont deux au moins apportent des changemens considérables dans les résultats de l'opération. Ces ingrédiens sont l'oxygène de l'air, l'azote & le calorique. A mesure que l'hydrogène 166 du végétal ou celui qui résulte de la décomposition de l'eau est chassé par le progrès du feu sous la forme de gaz hydrogène, il s'allume au moment où il a le contact de l'air, il reforme de l'eau, & le calorique des deux gaz qui devient libre, au moins pour la plus grande partie, produit la flamme.
Lorsqu'ensuite tout le gaz hydrogène a été chassé, brûlé & réduit en eau, le charbon qui reste brûle à son tour, mais sans flamme; il forme de l'acide carbonique qui s'échappe, emportant avec lui une portion de calorique qui le constitue dans l'état de gaz: le surplus du calorique devient libre, s'échappe & produit la chaleur & la lumière qu'on observe dans la combustion du charbon. Tout le végétal se trouve ainsi réduit en eau & en acide carbonique; il ne reste qu'une petite portion d'une matière terreuse grise, connue sous le nom de cendre, & qui contient les seuls principes vraiment fixes qui entrent dans la constitution des végétaux.
Cette terre ou cendre dont le poids n'excède pas communément le vingtième de celui du végétal, contient une substance d'un genre particulier, connue sous le nom d'alkali fixe végétal ou de potasse.
Pour l'obtenir on passe de l'eau sur les cendres; 167 l'eau se charge de la potasse qui est dissoluble, & elle laisse les cendres qui sont insolubles: en évaporant ensuite l'eau, on obtient la potasse qui est fixe, même à un très-grand degré de chaleur, & qui reste sous forme blanche & concrète. Mon objet n'est point de décrire ici l'art de préparer la potasse, encore moins les moyens de l'obtenir pure: je n'entre même ici dans ces détails que pour obéir à la loi que je me suis faite de n'admettre aucun mot qui n'ait été défini.
La potasse qu'on obtient par ce procédé est toujours plus ou moins saturée d'acide carbonique, & la raison en est facile à saisir: comme la potasse ne se forme, ou au moins n'est rendue libre qu'à mesure que le charbon du végétal est converti en acide carbonique par l'addition de l'oxygène, soit de l'air, soit de l'eau, il en résulte que chaque molécule de potasse se trouve au moment de sa formation en contact avec une molécule d'acide carbonique, & comme il y a beaucoup d'affinité entre ces deux substances, il doit y avoir combinaison. Quoique l'acide carbonique soit celui de tous les acides qui tient le moins à la potasse, il est cependant difficile d'en séparer les dernières portions. Le moyen le plus habituellement employé consiste à dissoudre la potasse 168 dans de l'eau, à y ajouter deux ou trois fois son poids de chaux vive, à filtrer & à évaporer dans des vaisseaux fermés; la substance saline qu'on obtient est de la potasse presqu'entièrement dépouillée d'acide carbonique.
Dans cet état, elle est non-seulement dissoluble dans l'eau, au moins à partie égale; mais elle attire encore celle de l'air avec une étonnante avidité: elle fournit en conséquence un moyen de sécher l'air ou les gaz auxquels elle est exposée. Elle est également soluble dans l'esprit-de-vin ou alkool, à la différence de celle qui est saturée d'acide carbonique, qui n'est pas soluble dans ce dissolvant. Cette circonstance a fourni à M. Berthollet un moyen d'avoir de la potasse parfaitement pure.
Il n'y a point de végétaux qui ne donnent plus ou moins de potasse par incinération; mais on ne l'obtient pas également pure de tous, elle est ordinairement mêlée avec différens sels qu'il est aisé d'en séparer.
On ne peut guère douter que les cendres, autrement dit la terre que laissent les végétaux lorsqu'on les brûle, ne préexistât dans ces végétaux antérieurement à la combustion; cette terre forme, à ce qu'il paroît, la partie osseuse, la carcasse du végétal. Mais il n'en est pas de même de la potasse; on n'est encore parvenu à séparer 169 cette substance des végétaux, qu'en employant des procédés ou des intermèdes qui peuvent fournir de l'oxigène & de l'azote, tels que la combustion ou la combinaison avec l'acide nitrique; en sorte qu'il n'est point démontré que cette substance ne soit pas un produit de ces opérations. J'ai commencé une suite d'expériences sur cet objet, dont je serai bientôt en état de rendre compte.
De la Soude.
La soude est, comme la potasse, un alkali qui se tire de la lixiviation des cendres des plantes, mais de celles seulement qui croissent aux bords de la mer, & principalement du kali, d'où est venu le nom d'alkali qui lui a été donné par les arabes: elle a quelques propriétés communes avec la potasse, mais elle en a d'autres qui l'en distinguent. En général ces deux substances portent chacune dans toutes les combinaisons salines des caractères qui leur sont propres. La soude, telle qu'on l'obtient de la lixiviation des plantes marines, est le plus souvent entièrement saturée d'acide carbonique; mais elle n'attire pas, comme la potasse, l'humidité de l'air; au contraire elle s'y desseche; ses cristaux s'effleurissent & se convertissent en une poussière blanche 170 qui a toutes les propriétés de la soude, & qui n'en differe que parce qu'elle a perdu son eau de cristallisation.
On ne connoît pas mieux jusqu'ici les principes constituans de la soude que ceux de la potasse, & on n'est pas même certain si cette substance est toute formée dans les végétaux, antérieurement à la combustion. L'analogie pourroit porter à croire que l'azote est un des principes constituans des alkalis en général, & on en a la preuve à l'égard de l'ammoniaque, comme je vais l'exposer: mais on n'a, relativement à la potasse & à la soude que de légères présomptions qu'aucune expérience décisive n'a encore confirmées.
De l'Ammoniaque.
Comme nous n'avions aucune connoissance précise à présenter sur la composition de la soude & de la potasse, nous avons été obligés de nous borner dans les deux paragraphes précédens à indiquer les substances dont on les retire, & les moyens qu'on emploie pour les obtenir. Il n'en est pas de même de l'ammoniaque, que les anciens ont nommée alkali volatil. M. Berthollet, dans un Mémoire imprimé dans le recueil de l'Académie, année 1784, page 316, est parvenu à prouver par voie de 171 décomposition que 1000 parties de cette substance en poids étoient composées d'environ 807 d'azote & de 193 d'hydrogène.
C'est principalement par la distillation des matières animales qu'on obtient cette substance; l'azote qui est un de leurs principes constituans, s'unit à la proportion d'hydrogène propre à cette combinaison, & il se forme de l'ammoniaque: mais on ne l'obtient point pure dans cette opération; elle est mêlée avec de l'eau, de l'huile, & en grande partie saturée d'acide carbonique. Pour la séparer de toutes ces substances, on la combine d'abord avec un acide tel, par exemple, que l'acide muriatique; on l'en dégage ensuite, soit par une addition de chaux, soit par une addition de potasse.
Lorsque l'ammoniaque a été ainsi amenée à son plus grand degré de pureté, elle ne peut plus exister que sous forme gazeuse, à la température ordinaire dans laquelle nous vivons; elle a une odeur excessivement pénétrante. L'eau en absorbe une très-grande quantité, sur-tout si elle est froide & si on ajoute la pression au refroidissement; ainsi saturée d'ammoniaque, elle a été appelée alkali volatil fluor: nous l'appellerons simplement ammoniaque ou ammoniaque en liqueur, & nous désignerons la même substance, quand elle sera dans l'état 172 aériforme, par le nom de gaz ammoniac.
De la Chaux, de la Magnésie, de la Baryte & de l'Alumine.
La composition de ces quatre terres est absolument inconnue; & comme on n'est point encore parvenu à déterminer quelles sont leurs parties constituantes & élémentaires, nous sommes autorisés, en attendant de nouvelles découvertes, à les regarder comme des êtres simples: l'art n'a donc aucune part à la formation de ces terres, la nature nous les présente toutes formées. Mais comme elles ont la plupart, sur-tout les trois premières, une grande tendance à la combinaison, on ne les trouve jamais seules. La chaux est presque toujours saturée d'acide carbonique, & dans cet état elle forme la craie, les spaths calcaires, une partie des marbres, &c. Quelquefois elle est saturée d'acide sulfurique, comme dans le gypse & les pierres à plâtre; d'autres fois avec l'acide fluorique, & elle forme le spath fluor ou vitreux. Enfin les eaux de la mer & des fontaines salées en contiennent de combinée avec l'acide muriatique. C'est de toutes les bases salifiables celle qui est la plus abondamment répandue dans la nature.
173
On rencontre la magnésie dans un grand nombre d'eaux minérales; elle y est le plus communément combinée avec l'acide sulfurique; on la trouve aussi très-abondamment dans l'eau de la mer, où elle est combinée avec l'acide muriatique; enfin elle entre dans la composition d'un grand nombre de pierres.
La baryte est beaucoup moins abondante que les deux terres précédentes; on la trouve dans le règne minéral combinée avec l'acide sulfurique, & elle forme alors le spath pesant; quelquefois, mais plus rarement, elle est combinée avec l'acide carbonique.
L'alumine ou base de l'alun a moins de tendance à la combinaison que les précédentes; aussi la trouve-t-on souvent dans l'état d'alumine, sans être combinée avec aucun acide. C'est principalement dans les argiles qu'on la rencontre; elle en fait, à proprement parler, la base.
Des Substances métalliques.
Les métaux, à l'exception de l'or & quelquefois de l'argent, se présentent rarement dans le règne minéral sous leur forme métallique; ils sont communément ou plus ou moins saturés d'oxygène, ou combinés avec du soufre, de l'arsenic, de l'acide sulfurique, de l'acide muriatique, 174 de l'acide carbonique, de l'acide phosphorique. La docimasie & la métallurgie enseignent à les séparer de toutes ces substances étrangères, & nous renvoyons aux ouvrages qui traitent de cette partie de la Chimie.
Il est probable que nous ne connoissons qu'une partie des substances métalliques qui existent dans la nature; toutes celles, par exemple, qui ont plus d'affinité avec l'oxygène qu'avec le carbone, ne sont pas susceptibles d'être réduites ou ramenées à l'état métallique, & elles ne doivent se présenter à nos yeux que sous la forme d'oxides qui se confondent pour nous avec les terres. Il est très-probable que la baryte que nous venons de ranger dans la classe des terres, est dans ce cas; elle présente dans le détail des expériences des caractères qui la rapprochent beaucoup des substances métalliques. Il seroit possible à la rigueur que toutes les substances auxquelles nous donnons le nom de terres, ne fussent que des oxides métalliques, irréductibles par les moyens que nous employons.
Quoi qu'il en soit, les substances métalliques que nous connoissons, celles que nous pouvons obtenir dans l'état métallique, sont au nombre de dix-sept; savoir:
175
| L'arsenic. | Le fer. |
| Le molybdène. | L'étain. |
| Le tungstène. | Le plomb. |
| Le manganèse. | Le cuivre. |
| Le nickel. | Le mercure. |
| Le cobalt. | L'argent. |
| Le bismuth. | Le platine. |
| L'antimoine. | L'or. |
| Le zinc. |
Je ne considérerai ici ces métaux que comme des bases salifiables, & je n'entrerai dans aucun détail sur leurs propriétés relatives aux arts & aux usages de la société. Chaque métal sous ces points de vue exigeroit un traité complet, & je sortirois absolument des bornes que je me suis prescrites.

176
CHAPITRE XVII.
Suite des réflexions sur les bases salifiables, & sur la formation des Sels neutres.
Telles sont les bases salifiables, c'est-à-dire, susceptibles de se combiner avec les acides, & de former des sels neutres. Mais il faut observer que les alkalis & les terres entrent purement & simplement dans la composition des sels neutres, sans aucun intermède qui serve à les unir; tandis qu'au contraire les métaux ne peuvent se combiner avec les acides, qu'autant qu'ils ont été préalablement plus ou moins oxygénés. On peut donc rigoureusement dire que les métaux ne sont point dissolubles dans les acides, mais seulement les oxides métalliques. Ainsi lorsqu'on met une substance métallique dans un acide, la première condition pour qu'elle puisse s'y dissoudre, est qu'elle puisse s'y oxider, & elle ne le peut qu'en enlevant de l'oxygène, ou à l'acide, ou à l'eau, dont cet acide est étendu: c'est-à-dire, en d'autres termes qu'une substance métallique ne peut se dissoudre dans un acide, qu'autant que l'oxygène qui entre, soit dans la composition de l'eau, soit dans 177 celle de l'acide, a plus d'affinité avec le métal, qu'il n'en a avec l'hydrogène ou la base acidifiable; ou, ce qui revient encore au même, qu'il n'y a de dissolution métallique, qu'autant qu'il y a décomposition de l'eau ou de l'acide.
C'est de cette observation simple, qui a échappé, même à l'illustre Bergman, que dépend l'explication des principaux phénomènes des dissolutions métalliques. Le premier de tous & le plus frappant est l'effervescence, ou, pour parler d'une manière moins équivoque, le dégagement de gaz qui a lieu pendant la dissolution. Ce gaz dans les dissolutions par l'acide nitrique est du gaz nitreux; dans les dissolutions par l'acide sulfurique, il est ou du gaz acide sulfureux, ou du gaz hydrogène, suivant que c'est aux dépens de l'acide sulfurique ou de l'eau que le métal s'est oxidé.
Il est sensible que l'acide nitrique & l'eau étant composés l'un & l'autre de substances qui séparément ne peuvent exister que dans l'état de gaz, du moins à la température dans laquelle nous vivons, aussitôt qu'on leur enlève l'oxygène, le principe qui lui étoit uni doit entrer sur le champ en expansion, il doit prendre la forme gazeuse, & c'est ce passage rapide de l'état liquide à l'état gazeux qui constitue l'effervescence. Il en est de même de l'acide sulfurique; les métaux, 178 en général, sur-tout par la voie humide, n'enlèvent point à cet acide la totalité de l'oxygène; ils ne le réduisent point en soufre, mais en acide sulfureux qui ne peut également exister que dans l'état de gaz au degré de température & de pression dans lequel nous vivons. Cet acide doit donc se dégager sous la forme de gaz, & c'est encore à ce dégagement qu'est due l'effervescence.
Un second phénomène est que toutes les substances métalliques se dissolvent sans effervescence dans les acides quand elles ont été oxidées avant la dissolution: il est clair qu'alors le métal n'ayant plus à s'oxider, il ne tend plus à décomposer ni l'acide ni l'eau; il ne doit donc plus y avoir d'effervescence, puisque l'effet qui le produisoit n'a plus lieu.
Un troisième phénomène est que tous les métaux se dissolvent sans effervescence dans l'acide muriatique oxygéné: ce qui se passe dans cette opération mérite quelques réflexions particulières. Le métal dans ce cas enlève à l'acide muriatique oxygéné son excès d'oxygène; il se forme d'une part un oxide métallique, & de l'autre de l'acide muriatique ordinaire. S'il n'y a pas d'effervescence dans ces sortes de dissolutions, ce n'est pas qu'il ne soit de l'essence de l'acide muriatique d'exister sous la 179 forme de gaz au degré de température dans lequel nous vivons, mais ce gaz trouve dans l'acide muriatique oxygéné plus d'eau qu'il n'en faut pour être retenu & pour demeurer sous forme liquide; il ne se dégage donc pas comme l'acide sulfureux, & après s'être combiné avec l'eau dans le premier instant, il se combine paisiblement ensuite avec l'oxide métallique qu'il dissout.
Un quatrième phénomène est que les métaux qui ont peu d'affinité pour l'oxygène, & qui n'exercent pas sur ce principe une action assez forte pour décomposer, soit l'acide, soit l'eau, sont absolument indissolubles: c'est par cette raison que l'argent, le mercure, le plomb, ne sont pas dissolubles dans l'acide muriatique, lorsqu'on les présente à cet acide dans leur état métallique; mais si on les oxide auparavant, de quelque manière que ce soit, ils deviennent aussitôt très-dissolubles, & la dissolution se fait sans effervescence.
L'oxygène est donc le moyen d'union entre les métaux & les acides; & cette circonstance qui a lieu pour tous les métaux comme pour tous les acides, pourroit porter à croire que toutes les substances qui ont une grande affinité avec les acides contiennent de l'oxygène. Il est donc assez probable que les quatre terres salifiables 180 que nous avons désignées ci-dessus contiennent de l'oxygène, & que c'est par ce latus qu'elles s'unissent aux acides. Cette considération sembleroit appuyer ce que j'ai précédemment avancé à l'article des terres, que ces substances pourroient bien n'être autre chose que des métaux oxidés avec lesquels l'oxygène a plus d'affinité qu'il n'en a avec le charbon, & qui par cette circonstance sont irréductibles. Au reste ce n'est ici qu'une conjecture que des expériences ultérieures pourront seules ou confirmer ou détruire.
Les acides connus jusqu'ici sont les suivans; nous allons en les désignant, indiquer le nom du radical ou base acidifiable dont ils sont composés.
| Noms des acides. | Nom de la base acidifiable ou radical de chaque acide, avec des observations. | ||||
| 1 | Sulfureux. | Soufre. | |||
| 2 | Sulfurique. | ||||
| 3 | Phosphoreux. | Phosphore. | |||
| 4 | Phosphorique. | ||||
| 5 | Muriatique. | Radical muriatique. | |||
| 6 | Muriatique oxygéné. | ||||
| 7 | Nitreux. | Azote. | |||
| 8 | Nitrique. | ||||
| 9 | Nitrique oxigéné. | ||||
| 10 | Carbonique. | Carbone. | |||
| 18111 | Acéteux. | Tous ces acides paroissent être formés de la réunion d'une base acidifiable double, le carbone & l'hydrogène, & ne différer entr'eux que par la différence de proportion de ces deux bases & de l'oxigène qui les acidifie; on n'a au surplus encore aucune suite d'expériences bien faites à cet égard. | |||
| 12 | Acétique. | ||||
| 13 | Oxalique. | ||||
| 14 | Tartareux. | ||||
| 15 | Pyro-tartareux. | ||||
| 16 | Citrique. | ||||
| 17 | Malique. | ||||
| 18 | Pyro-ligneux. | ||||
| 19 | Pyro-muqueux. | ||||
| 20 | Gallique. | On n'a encore que des connoissances très-imparfaites sur la nature des radicaux de ces acides; on sait seulement que le carbone & l'hydrogène en sont les principales parties, & que l'acide prussique contient de l'azote. | |||
| 21 | Prussique. | ||||
| 22 | Benzoïque. | ||||
| 23 | Succinique. | ||||
| 24 | Camphorique. | ||||
| 25 | Lactique. | ||||
| 26 | Saccho-lactique. | ||||
| 27 | Bombique. | Ces acides & tous ceux qu'on obtient en oxigénant les matières animales, paroissent avoir pour base acidifiable le carbone, l'hydrogène, le phosphore & l'azote. | |||
| 28 | Formique. | ||||
| 29 | Sébacique. | ||||
| 30 | Boracique. | Le radical boracique | La nature de ces deux radicaux est entièrement inconnue. | ||
| 31 | Fluorique. | Le radical fluorique | |||
| 32 | Antimonique. | Antimoine. | |||
| 33 | Argentique. | Argent. | |||
| 34 | Arsenique. | Arsenic. | |||
| 35 | Bismuthique. | Bismuth. | |||
| 36 | Cobaltique. | Cobalt. | |||
| 37 | Cuprique. | Cuivre. | |||
| 38 | Stamnique. | Etain. | |||
| 39 | Ferrique. | Fer. | |||
| 40 | Manganique. | Manganèse. | |||
| 41 | Hydrargirique. | Mercure. | |||
| 42 | Molybdique. | Molybdène. | |||
| 43 | Nickelique. | Nickel. | |||
| 44 | Aurique. | Or. | |||
| 45 | Platinique. | Platine. | |||
| 46 | Plombique. | Plomb. | |||
| 47 | Tungstique. | Tungstène. | |||
| 48 | Zincique. | Zinc. | |||
182
On voit que le nombre des acides est de 48 en y comprenant les 17 acides métalliques qui sont encore peu connus, mais sur lesquels M. Berthollet va donner incessamment un travail important. On ne peut pas encore se flatter sans doute de les avoir tous découverts; mais il est probable, d'un autre côté, qu'un examen plus approfondi fera connoître que plusieurs des acides végétaux regardés comme différens, rentrent les uns dans les autres. Au reste, on ne peut présenter ici le tableau de la Chimie que dans l'état où elle est, & tout ce qu'on peut faire c'est de donner des principes pour nommer, en conformité du même systême, les corps qui pourront être découverts dans la suite.
Le nombre des bases salifiables, c'est-à-dire, susceptibles d'être converties en sels neutres par les acides, est de vingt-quatre, savoir:
- Trois alkalis.
- Quatre terres.
- Et dix-sept substances métalliques.
La totalité des sels neutres qu'on peut concevoir dans l'état actuel de nos connoissances est donc de 1152; mais c'est en supposant que les acides métalliques soient susceptibles de dissoudre d'autres métaux; & cette dissolubilité des métaux, oxygénés les uns par les autres, 183 est une science neuve qui n'a point encore été entamée: c'est de cette partie de la science que dépendent toutes les combinaisons vitreuses métalliques. Il est d'ailleurs probable que toutes les combinaisons salines qu'on peut concevoir, ne sont pas possibles, ce qui doit réduire considérablement le nombre des sels que la nature & l'art peuvent former. Mais quand on ne supposeroit que cinq à six cens espèces de sels possibles, il est évident que si on vouloit donner à toutes des dénominations arbitraires à la manière des anciens, si on les désignoit, ou par le nom des premiers auteurs qui les ont découverts, ou par le nom des substances dont ils ont été tirés, il en résulteroit une confusion que la mémoire la plus heureuse ne pourroit pas débrouiller. Cette méthode pouvoit être tolérable dans le premier âge de la Chimie; elle pouvoit l'être encore il y a vingt ans, parce qu'alors on ne connoissoit pas au-delà de trente espèces de sels: mais aujourd'hui que le nombre en augmente tous les jours, que chaque acide qu'on découvre enrichit souvent la Chimie de 24 sels nouveaux, quelquefois de 48 en raison des deux degrés d'oxygénation de l'acide; il faut nécessairement une méthode, & cette méthode est donnée par l'analogie: c'est celle que nous avons suivie 184 dans la nomenclature des acides; & comme la marche de la nature est une, elle s'appliquera naturellement à la nomenclature des sels neutres.
Lorsque nous avons nommé les différentes espèces d'acides, nous avons distingué dans ces substances la base acidifiable particulière à chacun d'eux, & le principe acidifiant, l'oxygène qui est commun à tous. Nous avons exprimé la propriété commune à tous par le nom générique d'acide, & nous avons ensuite différencié les acides par le nom de la base acidifiable particulière à chacun. C'est ainsi que nous avons donné au soufre, au phosphore, au carbone oxygénés le nom d'acide sulfurique, d'acide phosphorique, d'acide carbonique: enfin nous avons cru devoir indiquer les différens degrés de saturation d'oxygène par une terminaison différente du même mot. Ainsi nous avons distingué l'acide sulfureux de l'acide sulfurique, l'acide phosphoreux de l'acide phosphorique.
Ces principes appliqués à la nomenclature des sels neutres, nous ont obligés de donner un nom commun à tous les sels dans la combinaison desquels entre le même acide, & de les différencier ensuite par le nom de la base salifiable. Ainsi nous avons désigné tous les sels qui ont l'acide sulfurique pour acide, par le nom de 185 sulfates; tous ceux qui ont l'acide phosphorique pour acide, par le nom de phosphates, & ainsi des autres. Nous distinguerons donc sulfate de potasse, sulfate de soude, sulfate d'ammoniaque, sulfate de chaux, sulfate de fer, &c. & comme nous connoissons vingt-quatre bases, tant alkalines que terreuses & métalliques, nous aurons vingt-quatre espèces de sulfates, autant de phosphates, & de même pour tous les autres acides. Mais comme le soufre est susceptible de deux degrés d'oxygénation, qu'une première dose d'oxygène constitue l'acide sulfureux, & une seconde l'acide sulfurique; comme les sels neutres que forment ces deux acides avec les différentes bases ne sont pas les mêmes, & qu'ils ont des propriétés fort différentes, il a fallu les distinguer encore par une terminaison particulière: nous avons en conséquence désigné par le nom de sulfites, de phosphites, &c. les sels neutres formés par l'acide le moins oxygéné. Ainsi le soufre oxygéné sera susceptible de former 48 sels neutres, savoir vingt-quatre sulfates & vingt-quatre sulfites, & ainsi des autres substances susceptibles de deux degrés d'oxygénation.
Il seroit excessivement ennuyeux pour les lecteurs de suivre ces dénominations dans tous leurs détails; il suffit d'avoir exposé clairement 186 la méthode de nommer: quand on l'aura saisie, on pourra l'appliquer sans effort à toutes les combinaisons possibles; & le nom de la substance combustible & acidifiable connu, on se rappellera toujours aisément le nom de l'acide qu'elle est susceptible de former, & celui de tous les sels neutres qui doivent en dériver.
Je m'en tiendrai donc à ces notions élémentaires; mais, pour satisfaire en même tems ceux qui pourroient avoir besoin de plus grands détails, j'ajouterai dans une seconde partie des Tableaux qui présenteront une récapitulation générale, non-seulement de tous les sels neutres, mais en général de toutes les combinaisons chimiques. J'y joindrai quelques courtes explications sur la manière la plus simple & la plus sûre de se procurer les différentes espèces d'acides, & sur les propriétés générales des sels neutres qui en résultent.
Je ne me dissimule pas qu'il auroit été nécessaire pour compléter cet Ouvrage, d'y joindre des observations particulières sur chaque espèce de sel, sur sa dissolubilité dans l'eau & dans l'esprit-de-vin, sur la proportion d'acide & de base qui entre dans sa composition, sur sa quantité d'eau de cristallisation, sur les différens degrés de saturation dont il est susceptible, enfin sur le degré de force avec laquelle 187 l'acide tient à sa base. Ce travail immense a été commencé par M. Bergman, M. de Morveau, M. Kirwan & quelques autres célèbres Chimistes; mais il n'est encore que médiocrement avancé, & les bases sur lesquelles il repose ne sont pas même encore d'une exactitude rigoureuse. Des détails aussi nombreux n'auroient pas pu convenir à un Ouvrage élémentaire, & le tems de rassembler les matériaux & de compléter les expériences auroit retardé de plusieurs années la publication de cet Ouvrage. C'est un vaste champ ouvert au zèle & à l'activité des jeunes Chimistes; mais qu'il me soit permis de recommander, en terminant ici ma tâche, à ceux qui auront le courage de l'entreprendre, de s'attacher plutôt à faire bien qu'à faire beaucoup; à s'assurer d'abord par des expériences précises & multipliées de la composition des acides, avant de s'occuper de celle des sels neutres. Tout édifice destiné à braver les outrages du tems, doit être établi sur des fondemens solides; & dans l'état où est parvenue la Chimie, c'est en retarder la marche que d'établir ses progrès sur des expériences qui ne sont ni assez exactes, ni assez rigoureuses.

SECONDE PARTIE.
De la Combinaison des Acides avec les bases salifiables, & de la Formation des Sels neutres.
AVERTISSEMENT.
Si j'avois voulu suivre strictement le plan que je m'étois formé dans la distribution des différentes parties de cet Ouvrage, je me serois borné dans les Tableaux qui composeront cette seconde Partie, & dans les explications qui les accompagnent, à donner de courtes définitions des différens acides que l'on connoît, une description abrégée des procédés par lesquels on les obtient, & j'y aurois joint une simple nomenclature des sels neutres qui résultent de leurs combinaisons avec différentes bases. Mais j'ai reconnu que, sans ajouter beaucoup au 190 volume de cet Ouvrage, je pourrois en augmenter beaucoup l'utilité, en présentant sous la même forme le tableau des substances simples, de celles qui entrent dans la composition des acides & des oxides, & leurs combinaisons.
Cette addition n'augmente que de dix le nombre des Tableaux strictement nécessaires pour la nomenclature de tous les sels neutres. J'y présente 1o. les substances simples, ou du moins celles que l'état actuel de nos connoissances nous oblige à regarder comme telles.
2o. Les radicaux oxidables & acidifiables doubles & triples, qui se combinent avec l'oxygène, à la manière des substances simples.
3o. Les combinaisons de l'oxygène avec les substances simples métalliques & non métalliques.
4o. Les combinaisons de l'oxygène avec les radicaux composés.
5o. Les combinaisons de l'azote avec les substances simples.
6o. Les combinaisons de l'hydrogène avec les substances simples.
7o. Les combinaisons du soufre avec les substances simples.
8o. Les combinaisons du phosphore avec les substances simples.
9o. Les combinaisons du carbone avec les substances simples. 191
10o. Les combinaisons de quelques autres radicaux avec les substances simples.
Ces dix Tableaux & les Observations qui les accompagnent, forment une espèce de récapitulation des quinze premiers Chapitres de cet Ouvrage. Les Tableaux qui sont à la suite & qui présentent l'ensemble de toutes les combinaisons salines, ont plus particulièrement rapport aux Chapitres XIV & XV.
On s'appercevra facilement que j'ai beaucoup profité dans ce travail de ce que M. de Morveau a publié dans le premier volume de l'Encyclopédie par ordre de matières; & en effet il m'auroit été difficile de puiser dans de meilleures sources, sur-tout d'après la difficulté de consulter les ouvrages étrangers dans leur langue originale. Je ne le citerai qu'une seule fois, au commencement de cette seconde Partie, pour ne pas être obligé de le citer à chaque article.
J'ai placé à la suite de chaque Tableau & vis-à-vis autant qu'il a été possible les explications qui y sont relatives.
192
Tableau des Substances simples.
| Noms nouveaux. | Noms anciens correspondans. | ||||
| Lumière. | Lumière. | ||||
| Substances simples qui appartiennent aux trois règnes & qu'on peut regarder comme les élémens des corps. | Calorique. | Chaleur. | |||
| Principe de la chaleur. | |||||
| Fluide igné. | |||||
| Feu. | |||||
| Matière du feu & de la chaleur. | |||||
| Oxygène. | Air déphlogistiqué. | ||||
| Air empiréal. | |||||
| Air vital. | |||||
| Base de l'air vital. | |||||
| Azote. | Gaz phlogistiqué. | ||||
| Mofete. | |||||
| Base de la mofete. | |||||
| Hydrogène. | Gaz inflammable. | ||||
| Base du gaz inflammable. | |||||
| Substances simples non métalliques oxidables & acidifiables. | Soufre. | Soufre. | |||
| Phosphore. | Phosphore. | ||||
| Carbone. | Charbon pur. | ||||
| Radical muriatique. | Inconnu. | ||||
| Radical fluorique. | Inconnu. | ||||
| Radical boracique. | Inconnu. | ||||
| Substances simples métalliques oxidables & acidifiables. | Antimoine. | Antimoine. | |||
| Argent. | Argent. | ||||
| Arsenic. | Arsenic. | ||||
| Bismuth. | Bismuth. | ||||
| Cobalt. | Cobalt. | ||||
| Cuivre. | Cuivre. | ||||
| Etain. | Etain. | ||||
| Fer. | Fer. | ||||
| Manganèse. | Manganèse. | ||||
| Mercure. | Mercure. | ||||
| Molybdène. | Molybdène. | ||||
| Nickel. | Nickel. | ||||
| Or. | Or. | ||||
| Platine. | Platine. | ||||
| Plomb. | Plomb. | ||||
| Tungstène. | Tungstène. | ||||
| Zinc. | Zinc. | ||||
| Substances simples salifiables terreuses. | Chaux. | Terre calcaire, chaux. | |||
| Magnésie. | Magnésie, base du sel d'Epsom. | ||||
| Baryte. | Barote, terre pesante. | ||||
| Alumine. | Argile, terre de l'alun, base de l'alun. | ||||
| Silice. | Terre siliceuse, terre vitrifiable. | ||||
193
OBSERVATIONS
Sur le Tableau des Substances simples, ou du moins de celles que l'état actuel de nos connoissances nous oblige à considérer comme telles.
La Chimie en soumettant à des expériences les différens corps de la nature, a pour objet de les décomposer & de se mettre en état d'examiner séparément les différentes substances qui entrent dans leur combinaison. Cette science a fait de nos jours des progrès très-rapides. Il sera facile de s'en convaincre si l'on consulte les différens auteurs qui ont écrit sur l'ensemble de la Chimie: on verra que dans les premiers tems on regardoit l'huile & le sel comme les principes des corps; que l'expérience & l'observation ayant amené de nouvelles connoissances, on s'apperçut ensuite que les sels n'étoient point des corps simples, qu'ils étoient composés d'un acide & d'une base, & que c'étoit de cette réunion que résultoit leur état de neutralité. Les découvertes modernes ont encore reculé de plusieurs degrés les bornes de l'analyse[7], elles nous ont éclairés sur la formation 194 des acides, & nous ont fait voir qu'ils étoient formés par la combinaison d'un principe acidifiant commun à tous, l'oxygène, & d'un radical particulier pour chacun, qui les différencie & qui les constitue plutôt tel acide que tel autre. J'ai été encore plus loin dans cet ouvrage, puisque j'ai fait voir, comme M. Hassenfratz, au surplus l'avoit déjà annoncé, que les radicaux des acides eux-mêmes ne sont pas toujours des substances simples, même dans le sens que nous attachons à ce mot; qu'ils sont ainsi que le principe huileux, un composé d'hydrogène & de carbone. Enfin M. Berthollet a prouvé que les bases des sels n'étoient pas plus simples que les acides eux-mêmes, & que l'ammoniaque étoit un composé d'azote & d'hydrogène.
La Chimie marche donc vers son but & vers sa perfection, en divisant, subdivisant, & resubdivisant encore, & nous ignorons quel sera le terme de ses succès. Nous ne pouvons donc pas assurer que ce que nous regardons comme simple aujourd'hui le soit en effet: tout ce que nous pouvons dire, c'est que telle substance est le terme actuel auquel arrive l'analyse chimique, & qu'elle ne peut plus se subdiviser au-delà dans l'état actuel de nos connoissances.
Il est à présumer que les terres cesseront 195 bientôt d'être comptées au nombre des substances simples; elles sont les seules de toute cette classe qui n'aient point de tendance à s'unir à l'oxygène, & je suis bien porté à croire que cette indifférence pour l'oxygène, s'il m'est permis de me servir de cette expression, tient à ce qu'elles en sont déjà saturées. Les terres, dans cette manière de voir, feroient des substances simples, peut-être des oxides métalliques oxygénées jusqu'à un certain point. Ce n'est au surplus qu'une simple conjecture que je présente ici. J'espère que le lecteur voudra bien ne pas confondre ce que je donne pour des vérités de fait & d'expérience avec ce qui n'est encore qu'hypothétique.
Je n'ai point fait entrer dans ce tableau les alkalis fixes, tels que la potasse & la soude, parce que ces substances sont évidemment composées, quoiqu'on ignore cependant encore la nature des principes qui entrent dans leur combinaison.
196
Tableau des Radicaux ou bases oxidables & acidifiables, composés, qui entrent dans les combinaisons à la manière des substances simples.
| Noms des Radicaux. | Observations. | |||
| Radicaux oxidables ou acidifiables composés, du règne minéral. | Radical nitro-muriatique, ou radical de l'eau régale. | C'est la base de l'eau régale des anciens Chimistes, célèbre par la propriété qu'elle a de dissoudre l'or. | ||
| Radicaux hydro-carboneux, ou carbone-hydreux du règne végétal, susceptibles d'être oxidés & acidifiés. | Radical tartareux. | Les anciens Chimistes ne connoissoient point la composition des acides, & ne se doutant pas qu'ils fussent formés de la réunion d'un radical particulier à chacun d'eux & d'un principe acidifiant commun à tous, ils n'ont pu donner aucun nom à des substances dont ils n'avoient aucune idée: nous nous sommes donc trouvés dans la nécessité de créer une Nomenclature pour cet objet; mais nous avons prévenu en même tems que cette Nomenclature seroit susceptible de modification, à mesure que la nature des radicaux composés seroit mieux connue. Voyez ce que j'ai dit à cet égard, chapitre XI. | ||
| Radical malique. | ||||
| Radical citrique. | ||||
| Radical pyro-ligneux. | ||||
| Radical pyro-muqueux. | ||||
| Radical pyro-tartareux. | ||||
| Radical oxalique. | ||||
| Radical acéteux. | ||||
| Radical succinique. | ||||
| Radical benzoïque. | ||||
| Radical camphorique. | ||||
| Radical gallique. | ||||
| Radicaux hydro-carboneux ou carbone-hydreux du règne animal dans la composition desquels entre presque toujours l'azote & souvent le phosphore & qui sont susceptibles d'être oxidés & acidifiés. XI. | Radical lactique. | |||
| Radical saccholactique. | ||||
| Radical formique. | ||||
| Radical bombique. | ||||
| Radical sébacique. | ||||
| Radical lithique. | ||||
| Radical prussique. | ||||
Les radicaux du règne végétal donnent par un premier degré d'oxigénation des oxides végétaux; tels que le sucre, l'amidon, la gomme ou le muqueux. Les radicaux animaux donnent des oxides animaux, tels que la limphe, &c. &c. 197
OBSERVATIONS
Sur le Tableau des Radicaux ou bases oxydables & acidifiables, composés de la réunion de plusieurs substances simples.
Les radicaux du règne végétal & du règne animal que présente ce tableau, & qui tous sont susceptibles d'être oxidés & acidifiés, n'ayant point encore été analysés avec précision, il est impossible de les assujétir encore à une nomenclature régulière. Des expériences dont quelques-unes me sont propres, & dont d'autres ont été faites par M. Hassenfratz, m'ont seulement appris qu'en général, presque tous les acides végétaux, tels que l'acide tartareux, l'acide oxalique, l'acide citrique, l'acide malique, l'acide acéteux, l'acide pyro-tartarique, l'acide pyro-mucique, ont pour radical l'hydrogène & le carbone, mais réunis de manière à ne former qu'une seule & même base; que tous ces acides ne diffèrent entr'eux que par la différence de proportion de ces deux substances, & par le degré d'oxygénation. Nous savons de plus, principalement par les expériences de M. Berthollet, que les radicaux du règne animal, & 198 quelques-uns même du règne végétal sont plus composés, & qu'indépendamment de l'hydrogène & du carbone, ils contiennent encore souvent de l'azote, & quelquefois du phosphore; mais il n'existe point encore de calculs exacts sur les quantités. Nous nous sommes donc trouvés forcés de donner, à la manière des anciens, à ces différens radicaux des noms dérivés de celui de la substance dont ils ont été tirés. Sans doute, un jour & à mesure que nos connoissances acquerront plus de certitude & d'étendue, tous ces noms disparoîtront, & ils ne subsisteront plus que comme un témoignage de l'état dans lequel la science chimique nous a été transmise: ils feront place à ceux des radicaux hydro-carboneux & hydro-carbonique, carbone-hydreux & carbone-hydrique, comme je l'ai expliqué dans le chapitre XI, & le choix de ces noms sera déterminé par la proportion des deux bases dont ils sont composés.
On apperçoit aisément que les huiles étant composées d'hydrogène & de carbone, elles sont de véritables radicaux carbone-hydreux ou hydro-carboneux, & en effet, il suffit d'oxygéner des huiles pour les convertir d'abord en oxides, & ensuite en acides végétaux, suivant le degré d'oxygénation. On ne peut pas cependant assurer d'une manière positive que les huiles 199 entrent toutes entières dans la composition des oxides & des acides végétaux; il est possible qu'elles perdent auparavant une portion de leur hydrogène ou de leur carbone, & que ce qui reste de l'une & de l'autre de ces substances ne soit plus dans la proportion nécessaire pour constituer des huiles. C'est sur quoi nous avons encore besoin d'être éclairés par l'expérience.
Nous ne connoissons, à proprement parler, dans le règne minéral d'autre radical composé que le radical nitro-muriatique. Il est formé par la réunion de l'azote avec le radical muriatique. Les autres acides composés ont été beaucoup moins étudiés, & ne présentent pas d'ailleurs des phénomènes aussi frappans.
200
OBSERVATIONS
Sur les combinaisons de la Lumière & du Calorique avec les différentes substances.
Je n'ai point formé de Tableau pour les combinaisons de la lumière & du calorique avec les substances simples ou composées; parce que nous n'avons point encore des idées suffisamment arrêtées sur ces sortes de combinaisons. Nous savons, en général, que tous les corps de la nature sont plongés dans le calorique, qu'ils en sont environnés, pénétrés de toutes parts, & qu'il remplit tous les intervalles que laissent entr'elles leurs molécules: que dans certains cas le calorique se fixe dans les corps, de manière même à constituer leurs parties solides; mais que le plus souvent il en écarte les molécules, il exerce sur elles une force répulsive, & que c'est de son action ou de son accumulation plus ou moins grande que dépend le passage des corps de l'état solide à l'état liquide, de l'état liquide à l'état aériforme. Enfin nous avons appelé du nom générique de gaz toutes les substances portées à l'état aériforme par une addition suffisante de calorique; en sorte que si nous voulons désigner l'acide muriatique, l'acide 201 carbonique, l'hydrogène, l'eau, l'alkool dans l'état aériforme, nous leur donnons le nom de gaz acide muriatique, gaz acide carbonique, gaz hydrogène, gaz aqueux, gaz alkool.
A l'égard de la lumière, ses combinaisons & sa manière d'agir sur les corps sont encore moins connues. Il paroît seulement, d'après les expériences de M. Berthollet, qu'elle a une grande affinité avec l'oxygène, qu'elle est susceptible de se combiner avec lui, & qu'elle contribue avec le calorique à le constituer dans l'état de gaz. Les expériences qui ont été faites sur la végétation, donnent aussi lieu de croire que la lumière se combine avec quelques parties des plantes, & que c'est à cette combinaison qu'est due la couleur verte des feuilles & la diversité de couleurs des fleurs. Il est au moins certain que les plantes qui croissent dans l'obscurité sont étiolées, qu'elles sont absolument blanches, qu'elles sont dans un état de langueur & de souffrance, & qu'elles ont besoin pour reprendre leur vigueur naturelle & pour se colorer, de l'influence immédiate de la lumière.
On observe quelque chose de semblable sur les animaux eux-mêmes; les hommes, les femmes, les enfans s'étiolent jusqu'à un certain point dans les travaux sédentaires des manufactures, dans les logemens resserrés, dans les 202 rues étroites des villes. Ils se développent au contraire, ils acquièrent plus de force & plus de vie dans la plupart des occupations champêtres & dans les travaux qui se font en plein air.
L'organisation, le sentiment, le mouvement spontané, la vie, n'existent qu'à la surface de la terre & dans les lieux exposés à la lumière. On diroit que la fable du flambeau de Prométhée étoit l'expression d'une vérité philosophique qui n'avoit point échappé aux anciens. Sans la lumière la nature étoit sans vie, elle étoit morte & inanimée: un Dieu bienfaisant, en apportant la lumière, a répandu sur la surface de la terre l'organisation, le sentiment & la pensée.
Mais ce n'est point ici le lieu d'entrer dans aucuns détails sur les corps organisés; c'est à dessein que j'ai évité de m'en occuper dans cet Ouvrage, & c'est ce qui m'a empêché de parler des phénomènes de la respiration, de la sanguification & de la chaleur animale. Je reviendrai un jour sur ces objets.
203
Tableau des Combinaisons binaires de l'oxygène avec les substances métalliques & non métalliques oxidables & acidifiables.
| Premier degré d'oxigénation. | ||||
| Noms nouveaux. | Noms anciens. | |||
| Combinaisons de l'oxygène avec les substances simples non métalliques, telles que: | Le calorique. | Le gaz oxygène. | Air vital ou déphlogistiqué. | |
| L'hydrogène. | On ne connoît qu'un degré de combinaison de l'oxygène & de l'hydrogène, & cette combinaison forme de l'eau. | |||
| L'azote. | Oxide nitreux ou base du gaz nitreux. | Gaz nitreux. | ||
| Le carbone. | Oxide de carbone. | Inconnu. | ||
| Le soufre. | Oxide de soufre. | Soufre mou. | ||
| Le phosphore. | Oxide de phosphore. | Résidu de la combustion du phosphore. | ||
| Le radical muriatique. | Oxide muriatique. | Inconnu. | ||
| Le radical fluorique. | Oxide fluorique. | Inconnu. | ||
| Le radical boracique. | Oxide boracique. | Inconnu. | ||
| Combinaisons de l'oxygène avec les substances simples métalliques, telles que: | L'antimoine. | Oxide gris d'antimoine. | Chaux grise d'antimoine. | |
| L'argent. | Oxide d'argent. | Chaux d'argent. | ||
| L'arsenic. | Oxide gris d'arsenic. | Chaux grise d'arsenic. | ||
| Le bismuth. | Oxide gris de bismuth. | Chaux grise de bismuth. | ||
| Le cobalt. | Oxide gris de cobalt. | Chaux grise de cobalt. | ||
| Le cuivre. | Oxide rouge brun de cuivre. | Chaux rouge brune de cuivre. | ||
| L'étain. | Oxide gris d'étain. | Chaux grise d'étain. | ||
| Le fer. | Oxide noir de fer. | Ethiops martial. | ||
| Le manganèse. | Oxide noir de manganèse. | Chaux noire de manganèse. | ||
| Le mercure. | Oxide noir de mercure. | Ethiops minéral. | ||
| Le molybdène. | Oxide de molybdène. | Chaux de molybdène. | ||
| Le nickel. | Oxide de nickel. | Chaux de nickel. | ||
| L'or. | Oxide jaune d'or. | Chaux jaune d'or. | ||
| Le platine. | Oxide jaune de platine. | Chaux jaune de platine. | ||
| Le plomb. | Oxide gris de plomb. | Chaux grise de plomb. | ||
| Le tungstène. | Oxide de tungstène. | Chaux de tungstène. | ||
| Le zinc. | Oxide gris de zinc. | Chaux grise de zinc. | ||
| Second degré d'oxigénation. | ||||
| Noms nouveaux. | Noms anciens. | |||
| Combinaisons de l'oxygène avec les substances simples non métalliques, telles que: | Le calorique. | |||
| L'hydrogène. | ||||
| L'azote. | Acide nitreux. | Acide nitreux fumant. | ||
| Le carbone. | Acide carboneux. | Inconnu. | ||
| Le soufre. | Acide sulfureux. | Acide sulfureux. | ||
| Le phosphore. | Acide phosphoreux. | Acide volatil du phosphore. | ||
| Le radical muriatique. | Acide muriateux. | Inconnu. | ||
| Le radical fluorique. | Acide fluoreux. | Inconnu. | ||
| Le radical boracique. | Acide boraceux. | Inconnu. | ||
| Combinaisons de l'oxygène avec les substances simples métalliques, telles que: | L'antimoine. | Oxide blanc d'antimoine. | Chaux blanche d'antimoine, Antimoine diaphorétique. |
|
| L'argent. | . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . . . . . . . | ||
| L'arsenic. | Oxide blanc d'arsenic. | Chaux blanche d'arsenic. | ||
| Le bismuth. | Oxide blanc de bismuth. | Chaux blanche de bismuth. | ||
| Le cobalt. | . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . . . . . . . | ||
| Le cuivre. | Oxide vert & bleu de cuivre. | Chaux verte & bleue de cuivre. | ||
| L'étain. | Oxide blanc d'étain. | Chaux blanche d'étain ou potée d'étain. | ||
| Le fer. | Oxide jaune & rouge de fer. | Ocre & rouille. | ||
| Le manganèse. | Oxide blanc de manganèse. | Chaux blanche de manganèse. | ||
| Le mercure. | Oxide jaune & rouge de mercure. | Turbith minéral, précipité rouge, précipité per se. | ||
| Le molybdène. | . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . . . . . . . | ||
| Le nickel. | . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . . . . . . . | ||
| L'or. | Oxide rouge d'or. | Chaux rouge d'or. Précipité pourpre de Cassius. |
||
| Le platine. | . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . . . . . . . | ||
| Le plomb. | Oxide jaune & rouge de plomb. | Massicot & minium. | ||
| Le tungstène. | . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . . . . . . . | ||
| Le zinc. | Oxide blanc de zinc. | Chaux blanche de zinc, Pompholix. | ||
| Troisième degré d'oxigénation. | ||||
| Noms nouveaux. | Noms anciens. | |||
| Combinaisons de l'oxygène avec les substances simples non métalliques, telles que: | Le calorique. | |||
| L'hydrogène. | ||||
| L'azote. | Acide nitrique. | Acide nitreux non fumant. | ||
| Le carbone. | Acide carbonique | Air fixe. | ||
| Le soufre. | Acide sulfurique. | Acide vitriolique. | ||
| Le phosphore. | Acide phosphorique. | Acide phosphorique. | ||
| Le radical muriatique. | Acide muriatique. | Acide marin. | ||
| Le radical fluorique. | Acide fluorique. | Inconnu des anciens. | ||
| Le radical boracique. | Acide boracique. | Sel sédatif de Homberg. | ||
| Combinaisons de l'oxygène avec les substances simples métalliques, telles que: | L'antimoine. | Acide antimonique. | . . . . . . . . . . . . . . . . . . . | |
| L'argent. | Acide argentique. | . . . . . . . . . . . . . . . . . . . | ||
| L'arsenic. | Acide arsenique. | Acide arsenical. | ||
| Le bismuth. | Acide bismutique. | . . . . . . . . . . . . . . . . . . . | ||
| Le cobalt. | Acide cobaltique. | . . . . . . . . . . . . . . . . . . . | ||
| Le cuivre. | Acide cuprique. | . . . . . . . . . . . . . . . . . . . | ||
| L'étain. | Acide stamnique. | . . . . . . . . . . . . . . . . . . . | ||
| Le fer. | Acide ferrique. | . . . . . . . . . . . . . . . . . . . | ||
| Le manganèse. | Acide manganique. | . . . . . . . . . . . . . . . . . . . | ||
| Le mercure. | Acide mercurique. | . . . . . . . . . . . . . . . . . . . | ||
| Le molybdène. | Acide molybdique. | Acide de la molybdène. | ||
| Le nickel. | Acide nickelique. | . . . . . . . . . . . . . . . . . . . | ||
| L'or. | Acide aurique. | . . . . . . . . . . . . . . . . . . . | ||
| Le platine. | Acide platinique. | . . . . . . . . . . . . . . . . . . . | ||
| Le plomb. | Oxide plombique. | . . . . . . . . . . . . . . . . . . . | ||
| Le tungstène. | Acide tungstique. | Acide de la tungstène. | ||
| Le zinc. | Acide zincique. | . . . . . . . . . . . . . . . . . . . | ||
| Quatrième degré d'oxigénation. | ||||
| Noms nouveaux. | Noms anciens. | |||
| Combinaisons de l'oxygène avec les substances simples non métalliques, telles que: | Le calorique. | |||
| L'hydrogène. | ||||
| L'azote. | Acide nitrique oxigéné. | Inconnu. | ||
| Le carbone. | Acide carbonique oxigéné. | Inconnu. | ||
| Le soufre. | Acide sulfurique oxigéné. | Inconnu. | ||
| Le phosphore. | Acide phosphorique oxigéné. | Inconnu. | ||
| Le radical muriatique. | Acide muriatique oxigéné. | Acide marin déphlogistiqué. | ||
| Le radical fluorique. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le radical boracique. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Combinaisons de l'oxygène avec les substances simples métalliques, telles que: | L'antimoine. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | |
| L'argent. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| L'arsenic. | Acide arsenic oxigéné. | Inconnu. | ||
| Le bismuth. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le cobalt. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le cuivre. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| L'étain. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le fer. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le manganèse. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le mercure. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le molybdène. | Acide molybdique oxygéné. | Inconnu. | ||
| Le nickel. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| L'or. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le platine. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le plomb. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
| Le tungstène. | Acide tungstique oxygéné. | Inconnu. | ||
| Le zinc. | . . . . . . . . . . . . . . . . . | . . . . . . . . . . . . . . . . | ||
OBSERVATIONS
Sur les combinaisons binaires de l'Oxygène avec les substances simples métalliques & non métalliques.
L'Oxygène est une des substances les plus abondamment répandues dans la nature, puisqu'elle forme près du tiers en poids de notre atmosphère, & par conséquent du fluide élastique que nous respirons. C'est dans ce réservoir immense que vivent & croissent les animaux & les végétaux, & c'est également de lui que nous tirons principalement tout l'oxygène que nous employons dans nos expériences. L'attraction réciproque qui s'exerce entre ce principe & les différentes substances est telle, qu'il est impossible de l'obtenir seul & dégagé de toute combinaison. Dans notre atmosphère, il est uni au calorique qui le tient en état de gaz, & il est mêlé avec environ deux tiers en poids de gaz azote.
Il faut, pour qu'un corps s'oxygène, réunir un certain nombre de conditions: la première est que les molécules constituantes de ce corps n'exercent pas sur elles-mêmes une attraction plus forte que celle qu'elles exercent sur l'oxygène; car il est évident qu'alors il ne peut plus y avoir de combinaison. L'art dans ce cas peut 204 venir au secours de la nature, & l'on peut diminuer presqu'à volonté l'attraction des molécules des corps, en les échauffant, c'est-à-dire, en y introduisant du calorique.
Echauffer un corps, c'est écarter les unes des autres les molécules qui le constituent; & comme l'attraction de ces molécules diminue suivant une certaine loi relative à la distance, il se trouve nécessairement un instant où les molécules exercent une plus forte attraction sur l'oxygène, qu'elles n'en exercent sur elles-mêmes; c'est alors que l'oxygénation a lieu.
On conçoit que le degré de chaleur auquel commence ce phénomène, doit être différent pour chaque substance. Ainsi, pour oxygéner la plupart des corps & en général presque toutes les substances simples, il ne s'agit que de les exposer à l'action de l'air de l'atmosphère, & de les élever à une température convenable. Cette température pour le plomb, le mercure, l'étain, n'est pas fort supérieure à celle dans laquelle nous vivons. Il faut au contraire un degré de chaleur assez grand pour oxygéner le fer, le cuivre, &c. du moins par la voie sèche & lorsque l'oxygénation n'est point aidée par l'action de l'humidité. Quelquefois l'oxygénation se fait avec une extrême rapidité, & alors elle est accompagnée de chaleur, de lumière & 205 même de flamme; telle est la combustion du phosphore dans l'air de l'atmosphère, & celle du fer dans le gaz oxygène. Celle du soufre est moins rapide: enfin celle du plomb, de l'étain & de la plupart des métaux, se fait beaucoup plus lentement & sans que le dégagement du calorique, & sur-tout de la lumière, soit sensible.
Il est des substances qui ont une telle affinité pour l'oxygène, & qui ont la propriété de s'oxygéner à une température si basse, que nous ne les voyons que dans l'état d'oxygénation. Tel est l'acide muriatique que l'art, ni peut-être la nature, n'ont encore pu décomposer, & qui ne se présente à nous que dans l'état d'acide. Il est probable qu'il y a beaucoup d'autres substances du règne minéral qui, comme l'acide muriatique, sont nécessairement oxygénées au degré de chaleur dans lequel nous vivons; & c'est sans doute parce qu'elles sont déjà saturées d'oxygène, qu'elles n'exercent plus aucune action sur ce principe.
L'exposition des substances simples à l'air, élevées à un certain degré de température, n'est pas le seul moyen de les oxygéner. Au lieu de leur présenter l'oxygène uni au calorique, on peut leur présenter cette substance unie à un métal avec lequel elle ait peu d'affinité. L'oxide rouge de mercure est un des plus 206 propres à remplir cet objet, sur-tout à l'égard des corps qui ne sont point attaqués par le mercure. L'oxygène dans cet oxide tient très-peu au métal, & même il n'y tient plus au degré de chaleur qui commence à faire rougir le verre. En conséquence on oxygène avec beaucoup de facilité tous les corps qui en sont susceptibles, en les mêlant avec de l'oxide rouge de mercure, & en les élevant à un degré de chaleur médiocre.
L'oxide noir de manganèse, l'oxide rouge de plomb, les oxides d'argent, & en général presque tous les oxides métalliques peuvent remplir jusqu'à un certain point le même objet, en choisissant de préférence ceux dans lesquels l'oxygène a le moins d'adhérence. Toutes les réductions ou revivifications métalliques ne sont même que des opérations de ce genre: elles ne sont autre chose que des oxygénations du charbon par un oxide métallique quelconque. Le charbon combiné avec l'oxygène & avec du calorique, s'échappe sous forme de gaz acide carbonique, & le métal reste pur & revivifié.
On peut encore oxygéner toutes les substances combustibles en les combinant, soit avec du nitrate de potasse ou de soude, soit avec du muriate oxygéné de potasse. A un certain degré de chaleur, l'oxygène quitte le nitrate & le muriate, pour se combiner avec le corps 207 combustible: mais ces sortes d'oxygénation ne doivent être tentées qu'avec des précautions extrêmes & sur de très-petites quantités. L'oxygène entre dans la combinaison des nitrates & sur-tout des muriates oxygénés, avec une quantité de calorique presqu'égale à celle qui est nécessaire pour le constituer gaz oxygène. Cette immense quantité de calorique devient subitement libre au moment de sa combinaison avec les corps combustibles; & il en résulte des détonations terribles auxquelles rien ne résiste.
Enfin on peut oxygéner par la voie humide une partie des corps combustibles, & transformer en acides la plupart des oxides des trois règnes. On se sert principalement à cet effet de l'acide nitrique, auquel l'oxygène tient peu & qui le cède facilement à un grand nombre de corps, à l'aide d'une douce chaleur. On peut également employer l'acide muriatique oxygéné pour quelques-unes de ces opérations, mais non pas pour toutes.
J'appelle binaires les combinaisons des substances simples avec l'oxygène, parce qu'elles ne sont formées que de la réunion de deux substances. Je nommerai combinaisons ternaires celles composées de trois substances simples, & combinaisons quaternaires celles composées de quatre substances.
208
Tableau des combinaisons de l'Oxygène avec les radicaux composés.
| Noms des radicaux. | Noms des acides qui en résultent. | ||||
| Nomenclature nouvelle. | Nomenclature ancienne. | ||||
| Combinaisons de l'oxigène avec les radicaux composés du règne minéral, tels que: | Le radical nitro-muriatique. | L'acide nitro-muriatique. | L'eau régale. | ||
| Combinaisons de l'oxigène avec les radicaux carbone-hydreux & hydro-carboneux du règne végétal tels que le radical: * | tartarique. | L'acide tartareux. | inconnu des anciens. | ||
| malique. | L'acide malique. | inconnu des anciens. | |||
| citrique. | L'acide citrique. | L'acide du citron. | |||
| pyro-lignique. | L'acide pyro-ligneux. | L'acide empyreumatique du bois. | |||
| pyro-mucique. | L'acide pyro-muqueux. | L'acide empyreumatique du sucre. | |||
| pyro-tartarique. | L'acide pyro-tartareux. | L'acide empyreumatique du tartre. | |||
| oxalique. | L'acide oxalique. | Le sel d'oseille. | |||
| acétique. | L'acide acéteux ou acétique. | Le vinaigre, l'acide du vinaigre. | |||
| Le vinaigre radical. | |||||
| succinique. | L'acide succinique. | Le sel volatil de succin. | |||
| benzoïque. | L'acide benzoïque. | Les fleurs de benjoin. | |||
| camphorique. | L'acide camphorique. | inconnu des anciens. | |||
| gallique. | L'acide gallique. | Le principe astringent des végétaux. | |||
| Combinaisons de l'oxigène avec les radicaux carbone-hydreux & hydro-carboneux du règne animal, auxquels se joint presque toujours l'azote & souvent le phosphore, tels que le radical: ** | lactique. | L'acide lactique. | L'acide du petit lait aigri. | ||
| saccho-lactique. | L'acide saccho-lactique. | inconnu des anciens. | |||
| formique. | L'acide formique. | L'acide des fourmis. | |||
| bombique. | L'acide bombique. | inconnu des anciens. | |||
| sébacique. | L'acide sébacique. | inconnu des anciens. | |||
| lithique. | L'acide lithique. | Le calcul de la vessie. | |||
| prussique. | L'acide prussique. | La matière colorante du bleu de Prusse. | |||
* Ces radicaux, par un premier degré d'oxigénation, donnent le sucre, l'amidon, le muqueux, & en général tous les oxides végétaux.
** Ces radicaux, par un premier degré d'oxigénation, donnent la limphe animale, différentes humeurs, & en général tous les oxides animaux.
209
OBSERVATIONS
Sur les combinaisons de l'Oxigène avec les Radicaux composés.
Depuis que j'ai publié dans les Mémoires de l'Académ. année 1776, pag. 671, & 1778, page 535, une nouvelle théorie sur la nature & sur la formation des acides; & que j'en ai conclu que le nombre de ces substances devoit être beaucoup plus grand qu'on ne l'avoit pensé jusqu'alors, une nouvelle carrière s'est ouverte en Chimie: au lieu de cinq ou six acides qu'on connoissoit, on en a découvert successivement jusqu'à trente, & le nombre des sels neutres s'est accru dans la même proportion. Ce qui nous reste à étudier maintenant, est la nature des bases acidifiables & le degré d'oxygénation dont elles sont susceptibles. J'ai déjà fait observer que dans le règne minéral, presque tous les radicaux oxidables & acidifiables étoient simples; que dans le règne végétal au contraire, & sur-tout dans le règne animal, il n'en existoit presque pas qui ne fussent composés au moins de deux substances, d'hydrogène & de carbone; que souvent l'azote & le phosphore s'y réunissoient, & qu'il en résultoit des radicaux à quatre bases. 210
Les oxides & acides animaux & végétaux peuvent, d'après ces observations, différer entr'eux, 1o. par le nombre des principes acidifians qui constituent leur base; 2o. par la différente proportion de ces principes; 3o. par le différent degré d'oxygénation; ce qui suffit & au-delà pour expliquer le grand nombre de variétés que nous présente la nature. Il n'est pas étonnant, d'après cela, qu'on puisse convertir presque tous les acides végétaux les uns dans les autres; il ne s'agit, pour y parvenir, que de changer la proportion du carbone & de l'hydrogène, ou de les oxygéner plus ou moins. C'est ce qu'a fait M. Crell dans des expériences très-ingénieuses, qui ont été confirmées & étendues depuis par M. Hassenfratz. Il en résulte que le carbone & l'hydrogène donnent par un premier degré d'oxygénation de l'acide tartareux, par un second de l'acide oxalique, par un troisième de l'acide acéteux ou acétique. Il paroîtroit seulement que le carbone entre dans une proportion un peu moindre dans la combinaison des acides acéteux & acétique. L'acide citrique & l'acide malique diffèrent très-peu des précédens.
Doit-on conclure de ces réflexions, que les huiles soient la base, qu'elles soient le radical des acides végétaux & animaux? J'ai déjà exposé 211 mes doutes à cet égard. Premièrement, quoique les huiles paroissent n'être uniquement composées que d'hydrogène & de carbone, nous ne savons pas si la proportion qu'elles en contiennent est précisément celle nécessaire pour constituer les radicaux des acides. Secondement, puisque les acides végétaux & animaux ne sont pas seulement composés d'hydrogène, & de carbone, mais que l'oxygène entre également dans leur combinaison, il n'y a pas de raison de conclure qu'ils contiennent plutôt de l'huile que de l'acide carbonique & de l'eau. Ils contiennent bien, il est vrai, les matériaux propres à chacune de ces combinaisons; mais ces combinaisons ne sont point réalisées à la température habituelle dont nous jouissons, & les trois principes sont dans un état d'équilibre, qu'un degré de chaleur un peu supérieur à celui de l'eau bouillante suffit pour troubler. On peut consulter ce que j'ai dit à cet égard, page 132 & suivantes de cet Ouvrage.
212
Tableau des combinaisons binaires de l'Azote avec les substances simples.
| Substances simples. | Résultat des combinaisons. | |||||
| Nomenclature nouvelle. | Nomenclature anc. | |||||
| Combinaisons de l'azote avec: | Le calorique. | Le gaz azote. | Air phlogistiqué, mofète. | |||
| L'hydrogène. | L'ammoniaque. | Alkali volatil. | ||||
| L'oxigène. | Oxide nitreux. | Base du gaz nitreux. | ||||
| Acide nitreux. | Acide nitreux fumant. | |||||
| Acide nitrique. | Acide nitreux blanc. | |||||
| Le Carbone. | Azoture de carbone. Combinaison inconnue. On sait seulement que le carbone est susceptible de se dissoudre dans l'azote, & il en résulte un gaz azotique carboné. |
Inconnue. | ||||
| Le phosphore. | Azoture de phosphore. Combinaison inconnue. |
Inconnue. | ||||
| Le soufre. | Azoture de soufre. Combinaison inconnue. On sait seulement que le soufre est susceptible de se dissoudre dans le gaz azotique, & il en résulte un gaz azotique sulfuré. |
Inconnue. | ||||
| Les radicaux composés. | L'azote se combine avec le carbone & l'hydrogène, & quelquefois avec le phosphore, pour former des radicaux composés, qui sont susceptibles, comme on l'a vu plus haut, de s'oxider & de s'acidifier. Ce principe entre généralement dans tous les radicaux du règne animal. | Inconnues. | ||||
| Les substances métalliques. | Ces combinaisons sont absolument inconnues. Si elles sont découvertes un jour, on les nommera azotures métalliques. | Inconnues. | ||||
| La chaux. | Toutes ces combinaisons sont entièrement inconnues. Si un jour elles sont reconnues possibles, elles seront nommées azotures de chaux, azotures magnésiènes, &c. | |||||
| La magnésie. | ||||||
| La baryte. | ||||||
| L'alumine. | ||||||
| La potasse. | ||||||
| La soude. | ||||||
213
OBSERVATIONS
Sur l'Azote & sur ses combinaisons avec les substances simples.
L'Azote est un des principes les plus abondamment répandus dans la nature. Combiné avec le calorique, il forme le gaz azote ou la mofète, qui entre environ pour les deux tiers dans le poids de l'air de l'atmosphère. Il demeure constamment dans l'état de gaz au degré de pression & de température dans lequel nous vivons; aucun degré de compression ni de froid n'ont encore pu le réduire à l'état liquide ou solide.
Ce principe est aussi un des élémens qui constitue essentiellement les matières animales: il y est combiné avec le carbone & l'hydrogène, quelquefois avec le phosphore, & le tout est lié par une certaine portion d'oxygène qui les met ou à l'état d'oxide, ou à celui d'acide, suivant le degré d'oxygénation. La nature des matières animales peut donc varier comme celles des matières végétales, de trois manières, 1o. par le nombre des substances qui entrent dans la combinaison du radical, 2o. par leur proportion, 3o. par le degré d'oxygénation. 214
L'azote combiné avec l'oxygène forme les oxides & acides nitreux & nitrique; combiné avec l'hydrogène, il forme l'ammoniaque: ses autres combinaisons avec les substances simples sont peu connues. Nous leur donnerons le nom d'azotures, pour conserver l'identité de terminaison en ure que nous avons affectée à toutes les substances non-oxygénées. Il est assez probable que toutes les substances alkalines appartiennent à ce genre de combinaisons.
Il y a plusieurs manières d'obtenir le gaz azote: la première, de le tirer de l'air commun en absorbant par le sulfure de potasse ou de chaux dissous dans l'eau, le gaz oxygène qu'il contient. Il faut douze ou quinze jours pour que l'absorption soit complette; en supposant même qu'on agite & qu'on renouvelle les surfaces, & qu'on rompe la pellicule qui s'y forme.
La seconde, de le tirer des matières animales en les dissolvant dans de l'acide nitrique affoibli & presqu'à froid. L'azote, dans cette opération, se dégage sous forme de gaz, & on le reçoit sous des cloches remplies d'eau dans l'appareil pneumato-chimique: mêlé avec un tiers en poids de gaz oxygène, il reforme de l'air atmosphérique.
Une troisième manière d'obtenir le gaz azote, 215 est de le retirer du nitre par la détonation, soit avec le charbon, soit avec quelques autres corps combustibles. Dans le premier cas, le gaz azote se dégage mêlé avec du gaz acide carbonique, qu'on absorbe ensuite par de l'alkali caustique ou de l'eau de chaux, & le gaz azote reste pur.
Enfin un quatrième moyen d'obtenir le gaz azote, est de le tirer de la combinaison de l'ammoniaque avec les oxides métalliques. L'hydrogène de l'ammoniaque se combine avec l'oxygène de l'oxide; il se forme de l'eau, comme l'a observé M. de Fourcroy: en même tems l'azote devenu libre, se dégage sous la forme de gaz.
Il n'y a pas long-tems que les combinaisons de l'azote sont connues en Chimie. M. Cavendish est le premier qui l'ait observé dans le gaz & dans l'acide nitreux. M. Berthollet l'a ensuite découvert dans l'ammoniaque & dans l'acide prussique. Tout jusqu'ici porte à croire que cette substance est un être simple & élémentaire; rien ne prouve au moins qu'elle ait encore été décomposée, & ce motif suffit pour justifier la place que nous lui avons assignée.
216
Tableau des combinaisons binaires de l'Hydrogène avec les substances simples.
| Noms des Substances simples. | Résultat des combinaisons. | |||||
| Nomenclature nouvelle. | Observations. | |||||
| Combinaisons de l'hydrogène avec: | Le calorique. | Gaz hydrogène. | Cette combinaison de l'oxygène & du carbone comprend les huiles fixes & volatiles, & forme le radical d'une partie des oxides & des acides végétaux & animaux; lorsqu'elle a lieu dans l'état de gaz, il en résulte du gaz hydrogène carboné. | |||
| L'azote. | Ammoniaque ou alkali volatil. | |||||
| L'oxigène. | Eau. | |||||
| Le soufre. | Combinaison inconnue. * | |||||
| Le phosphore. | ||||||
| Le carbone | Radical hydro-carboneux ou carbone-hydreux. | |||||
| L'antimoine. | Hydrure d'antimoine. | Aucunes de ces combinaisons ne sont connues, & il y a toute apparence qu'elles ne peuvent exister à la température dans laquelle nous vivons, à cause de la grande affinité de l'hydrogène pour le calorique. | ||||
| L'argent. | Hydrure d'argent. | |||||
| L'arsenic. | Hydrure d'arsenic. | |||||
| Le bismuth. | Hydrure de bismuth. | |||||
| Le cobalt. | Hydrure de cobalt. | |||||
| Le cuivre. | Hydrure de cuivre. | |||||
| L'étain. | Hydrure d'étain. | |||||
| Le fer. | Hydrure de fer. | |||||
| Le manganèse. | Hydrure de manganèse. | |||||
| Le mercure. | Hydrure de mercure. | |||||
| Le molybdène. | Hydrure de molybdène. | |||||
| Le nickel. | Hydrure de nickel. | |||||
| L'or. | Hydrure d'or. | |||||
| Le platine. | Hydrure de platine. | |||||
| Le plomb. | Hydrure de plomb. | |||||
| Le tungstène. | Hydrure de tungstène. | |||||
| Le zinc. | Hydrure de zinc. | |||||
| La potasse. | Hydrure de potasse. | |||||
| La soude. | Hydrure de soude. | |||||
| L'ammoniaque. | Hydrure d'ammoniaque. | |||||
| La chaux. | Hydrure de chaux. | |||||
| La magnésie. | Hydrure de magnésie. | |||||
| La baryte. | Hydrure de baryte. | |||||
| L'alumine. | Hydrure d'alumine. | |||||
* Ces combinaisons ont lieu dans l'état de gaz & il en résulte du gaz hydrogène sulfuré & phosphoré.
217
OBSERVATIONS
Sur l'Hydrogène, & sur le tableau de ses combinaisons.
L'hydrogène, comme l'exprime sa dénomination, est un des principes de l'eau; il entre pour quinze centièmes dans sa composition: l'oxygène en forme les quatre-vingt-cinq autres centièmes. Cette substance dont ses propriétés & même l'existence ne sont connues que depuis très-peu de tems, est un des principes des plus abondamment répandus dans la nature: c'est un de ceux qui jouent le principal rôle dans le règne végétal & dans le règne animal.
L'affinité de l'hydrogène pour le calorique est telle qu'il reste constamment dans l'état de gaz au degré de chaleur & de pression dans lequel nous vivons. Il nous est donc impossible de connoître ce principe dans un état concret & dépouillé de toute combinaison.
Pour obtenir l'hydrogène ou plutôt le gaz hydrogène, il ne faut que présenter à l'eau une substance pour laquelle l'oxygène ait plus d'affinité qu'il n'en a avec l'hydrogène. Aussitôt l'hydrogène devient libre, il se combine avec le calorique & forme le gaz hydrogène. C'est 218 le fer qu'on a coutume d'employer pour opérer cette séparation, & il faut pour cela qu'il soit élevé à un degré de chaleur capable de le faire rougir. Le fer s'oxide dans cette opération, & devient semblable à la mine de fer de l'île d'Elbe. Dans cet état il est beaucoup moins attirable à l'aimant, & il se dissout sans effervescence dans les acides.
Le carbone, lorsqu'il est rouge & embrâsé, a également la propriété de décomposer l'eau & d'enlever l'oxygène à l'hydrogène: mais alors il se forme de l'acide carbonique qui se mêle avec le gaz hydrogène; on l'en sépare facilement, parce que l'acide carbonique est absorbable par l'eau & par les alkalis, tandis que l'hydrogène ne l'est pas. On peut encore obtenir du gaz hydrogène en faisant dissoudre du fer ou du zinc dans de l'acide sulfurique étendu d'eau. Ces deux métaux qui ne décomposent que très-difficilement & très-lentement l'eau lorsqu'ils sont seuls, la décomposent au contraire avec beaucoup de facilité lorsqu'ils sont aidés par la présence de l'acide sulfurique. L'hydrogène s'unit au calorique dans cette opération, aussitôt qu'il est dégagé, & on l'obtient dans l'état de gaz hydrogène.
Quelques Chimistes d'un ordre très-distingué se persuadent que l'hydrogène est le phlogistique 219 de Stalh, & comme ce célèbre Chimiste admettoit du phlogistique dans les métaux, dans le soufre, dans le charbon, &c. ils sont obligés de supposer qu'il existe également, de l'hydrogène fixé & combiné dans toutes ces substances: ils le supposent, mais ils ne le prouvent pas, & quand ils le prouveroient, ils ne seroient pas beaucoup plus avancés, puisque ce dégagement du gaz hydrogène n'explique en aucune manière les phénomènes de la calcination & de la combustion. Il faudroit toujours en revenir à l'examen de cette question; le calorique & la lumière qui se dégagent pendant les différentes espèces de combustion, sont-ils fournis par le corps qui brûle ou par le gaz oxygène qui se fixe dans toutes les opérations? & certainement la supposition de l'hydrogène dans les différens corps combustibles ne jette aucune lumière sur cette question. C'est au surplus à ceux qui supposent à prouver; & toute doctrine qui expliquera aussi bien & aussi naturellement que la leur, sans supposition, aura au moins l'avantage de la simplicité.
On peut voir ce que nous avons publié sur cette grande question, M. de Morveau, M. Bertholet, M. de Fourcroy & moi, dans la traduction de l'essai de M. Kirwan sur le phlogistique.
220
Tableau des combinaisons binaires du Soufre non oxygéné avec les substances simples.
| Noms des Substances simples. | Résultat des combinaisons. | |||||
| Nomenclature nouvelle. | Noms anciens correspondans avec la nouvelle Nomenclature. | |||||
| Combinaisons du soufre avec: | Le calorique. | Gaz du soufre. | ||||
| L'oxigène. | Oxide de soufre. | Soufre mou. | ||||
| Acide sulfureux. | Acide sulfureux. | |||||
| Acide sulfurique. | Acide vitriolique. | |||||
| L'hydrogène. | Sulfure d'hydrogène. | Combinaisons inconnues. | ||||
| L'azote. | Sulfure d'azote ou azote sulfuré. | |||||
| Le phosphore. | Sulfure de phosphore. | |||||
| Le carbone. | Sulfure de carbone. | |||||
| L'antimoine. | Sulfure d'antimoine. | Antimoine crud. | ||||
| L'argent. | Sulfure d'argent. | |||||
| L'arsenic. | Sulfure d'arsenic. | Orpiment, réalgar. | ||||
| Le bismuth. | Sulfure de bismuth. | |||||
| Le cobalt. | Sulfure de cobalt. | |||||
| Le cuivre. | Sulfure de cuivre. | Pyrite de cuivre. | ||||
| L'étain. | Sulfure d'étain. | |||||
| Le fer. | Sulfure de fer. | Pyrite de fer. | ||||
| Le manganèse. | Sulfure de manganèse. | |||||
| Le mercure. | Sulfure de mercure. | Ethiops minéral, cinnabre. | ||||
| Le molybdène. | Sulfure de molybdène. | |||||
| Le nickel. | Sulfure de nickel. | |||||
| L'or. | Sulfure d'or. | |||||
| Le platine. | Sulfure de platine. | |||||
| Le plomb. | Sulfure de plomb. | Galène. | ||||
| Le tungstène. | Sulfure de tungstène. | |||||
| Le zinc. | Sulfure de zinc. | Blende. | ||||
| La potasse. | Sulfure de potasse. | Foie de soufre à base d'alkali fixe végétal. | ||||
| La soude. | Sulfure de soude. | Foie de soufre à base d'alkali fixe minéral. | ||||
| L'ammoniaque. | Sulfure d'ammoniaque. | Foie de soufre volatil, liqueur fumante de Boyle. | ||||
| La chaux. | Sulfure de chaux. | Foie de soufre à base calcaire. | ||||
| La magnésie. | Sulfure de magnésie. | Foie de soufre à base de magnésie. | ||||
| La baryte. | Sulfure de baryte. | Foie de soufre à base de terre pesante. | ||||
| L'alumine. | Sulfure d'alumine. | Combinaison inconnue. | ||||
221
OBSERVATIONS
Sur le Soufre & sur le tableau de ses combinaisons avec les substances simples.
Le soufre est une des substances combustibles qui a le plus de tendance à la combinaison. Il est naturellement dans l'état concret à la température habituelle dans laquelle nous vivons, & ne se liquéfie qu'à une chaleur supérieure de plusieurs degrés à celle de l'eau bouillante.
La nature nous présente le soufre tout formé, & à-peu-près porté au dernier degré de pureté dont il est susceptible dans le produit des volcans; elle nous le présente encore, & beaucoup plus souvent dans l'état d'acide sulfurique, c'est-à-dire combiné avec l'oxygène, & c'est dans cet état qu'il se trouve dans les argiles, dans les gypses, &c. Pour ramener à l'état de soufre l'acide sulfurique de ces substances, il faut lui enlever l'oxygène, & on y parvient en le combinant à une chaleur rouge avec du carbone. Il se forme de l'acide carbonique qui se dégage dans l'état de gaz, & il reste un sulfure qu'on décompose par un acide: l'acide s'unit à la base & le soufre se précipite.
222
Tableau des combinaisons binaires du Phosphore non oxygéné avec les substances simples.
| Noms des Substances simples. | Résultat des combinaisons. | |||||
| Nomenclature nouvelle. | Observations. | |||||
| Combinaisons du phosphore avec: | Le calorique. | Gaz du phosphore. | ||||
| L'oxigène. | Oxide de phosphore. | |||||
| Acide phosphoreux. | ||||||
| Acide phosphorique. | ||||||
| L'hydrogène. | Phosphure d'hydrogène. | |||||
| L'azote. | Phosphure d'azote. | |||||
| Le soufre. | Phosphure de soufre. | |||||
| Le carbone. | Phosphure de carbone. | |||||
| L'antimoine. | Phosphure d'antimoine. | De toutes ces combinaisons, on ne connoît encore que le phosphure de fer, auquel on a donné le nom très-impropre de sidérite; encore est-il incertain si le phosphore est oxigéné ou non oxigéné dans cette combinaison. | ||||
| L'argent. | Phosphure d'argent. | |||||
| L'arsenic. | Phosphure d'arsenic. | |||||
| Le bismuth. | Phosphure de bismuth. | |||||
| Le cobalt. | Phosphure de cobalt. | |||||
| Le cuivre. | Phosphure de cuivre. | |||||
| L'étain. | Phosphure d'étain. | |||||
| Le fer. | Phosphure de fer. | |||||
| Le manganèse. | Phosphure de manganèse. | |||||
| Le mercure. | Phosphure de mercure. | |||||
| Le molybdène. | Phosphure de molybdène. | |||||
| Le nickel. | Phosphure de nickel. | |||||
| L'or. | Phosphure d'or. | |||||
| Le platine. | Phosphure de platine. | |||||
| Le plomb. | Phosphure de plomb. | |||||
| Le tungstène. | Phosphure de tungstène. | |||||
| Le zinc. | Phosphure de zinc. | |||||
| La potasse. | Phosphure de potasse. | Ces combinaisons ne sont point encore connues. Il y a apparence qu'elles sont impossibles, d'après les expériences de M. Gengembre. | ||||
| La soude. | Phosphure de soude. | |||||
| L'ammoniaque. | Phosphure d'ammoniaque. | |||||
| La chaux. | Phosphure de chaux. | |||||
| La baryte. | Phosphure de baryte. | |||||
| La magnésie. | Phosphure de magnésie. | |||||
| L'alumine. | Phosphure d'alumine. | |||||
223
OBSERVATIONS
Sur le Phosphore & sur le Tableau de ses combinaisons avec les substances simples.
Le phosphore est une substance combustible simple, dont l'existence avoit échappé aux recherches des anciens Chimistes. C'est en 1667 que la découverte en fut faite par Brandt, qui fit mystère de son procédé: bientôt après Kunckel découvrit le secret de Brandt; il le publia, & le nom de phosphore de Kunckel qui lui a été conservé jusqu'à nos jours, prouve que la reconnoissance publique se porte sur celui qui publie, plutôt que sur celui qui découvre, quand il fait mystère de sa découverte. C'est de l'urine seule qu'on tiroit alors le phosphore: quoique la méthode de le préparer eût été décrite dans plusieurs ouvrages, & notamment par M. Homberg, dans les mémoires de l'Académie des Sciences, année 1692, l'Angleterre a été long-tems en possession d'en fournir seule aux savans de toute l'Europe. Ce fut en 1737 qu'il fut fait pour la première fois en France, au Jardin Royal des Plantes, en présence des commissaires de l'Académie des Sciences. Maintenant on le tire d'une manière plus 224 commode, & sur-tout plus économique, des os des animaux, qui sont un véritable phosphate calcaire. Le procédé le plus simple consiste, d'après MM. Gahn, Schéele, Rouelle, &c. à calciner des os d'animaux adultes, jusqu'à ce qu'ils soient presque blancs. On les pile & on les passe au tamis de soie; on verse ensuite dessus de l'acide sulfurique étendu d'eau, mais en quantité moindre qu'il n'en faut pour dissoudre la totalité des os. Cet acide s'unit à la terre des os pour former du sulfate de chaux: en même tems l'acide phosphorique est dégagé & reste libre dans la liqueur. On décante alors, on lave le résidu, & on réunit l'eau du lavage à la liqueur décantée; on fait évaporer, afin de séparer du sulfate de chaux qui se cristallise en filets soyeux, & on finit par obtenir l'acide phosphorique sous forme d'un verre blanc & transparent qui, réduit en poudre & mêlé avec un tiers de son poids de charbon, donne de bon phosphore. L'acide phosphorique qu'on obtient par ce procédé, n'est jamais aussi pur que celui retiré du phosphore, soit par la combustion, soit par l'acide nitrique; il ne doit donc point être employé pour des expériences de recherches.
Le phosphore se rencontre dans presque toutes les substances animales, & dans quelques 225 plantes qui ont, d'après l'analyse chimique, un caractère animal. Il y est ordinairement combiné avec le carbone, l'azote & l'hydrogène, & il en résulte des radicaux très-composés. Ces radicaux sont communément portés à l'état d'oxide par une portion d'oxygène. La découverte que M. Hassenfratz a faite de cette substance dans le charbon de bois, feroit soupçonner qu'il est plus commun qu'on ne pense dans le règne végétal: ce qu'il y a de certain, c'est que des familles entières de plantes en fournissent quand on les traite convenablement. Je range le phosphore au rang des corps combustibles simples, parce qu'aucune expérience ne donne lieu de croire qu'on puisse le décomposer. Il s'allume à 32 degrés du thermomètre.
226
Tableau des combinaisons binaires du Carbone non oxygéné avec les substances simples.
| Noms des Substances simples. | Résultat des combinaisons. | |||||
| Nomenclature nouvelle. | Observations. | |||||
| Combinaisons du carbone avec: | L'oxigène. | Oxide de carbone. | Inconnu. | |||
| Acide carbonique. | Air fixe des anglois, acide crayeux de M. Bucquet & de M. de Fourcroy. | |||||
| Le soufre. | Carbure de soufre. | Combinaisons inconnues. | ||||
| Le phosphore. | Carbure de phosphore. | |||||
| L'azote. | Carbure d'azote. | |||||
| L'hydrogène. | Radical carbone-hydreux. | |||||
| Huiles fixes & volatiles. | ||||||
| L'antimoine. | Carbure d'antimoine. | De toutes ces combinaisons, on ne connoît que les carbures de fer & de zinc, auxquels on a donné le nom de Plombagine; les autres n'ont encore été ni faites ni observées. | ||||
| L'argent. | Carbure d'argent. | |||||
| L'arsenic. | Carbure d'arsenic. | |||||
| Le bismuth. | Carbure de bismuth. | |||||
| Le cobalt. | Carbure de cobalt. | |||||
| Le cuivre. | Carbure de cuivre | |||||
| L'étain. | Carbure d'étain. | |||||
| Le fer. | Carbure de fer | |||||
| Le manganèse. | Carbure de manganèse. | |||||
| Le mercure. | Carbure de mercure. | |||||
| Le molybdène. | Carbure de molybdène. | |||||
| Le nickel. | Carbure de nickel. | |||||
| L'or. | Carbure d'or. | |||||
| Le platine. | Carbure de platine. | |||||
| Le plomb. | Carbure de plomb. | |||||
| Le tungstène. | Carbure de tungstène. | |||||
| Le zinc. | Carbure de zinc. | |||||
| La potasse. | Carbure de potasse. | Combinaisons inconnues. | ||||
| La soude. | Carbure de soude. | |||||
| L'ammoniaque. | Carbure d'ammoniaque. | |||||
| La chaux. | Carbure de chaux. | Combinaisons inconnues. | ||||
| La magnésie. | Carbure de magnésie. | |||||
| La baryte. | Carbure de baryte. | |||||
| L'alumine. | Carbure d'alumine. | |||||
227
OBSERVATIONS
Sur le Carbone & sur le Tableau de ses combinaisons.
Comme aucune expérience ne nous a indiqué jusqu'ici la possibilité de décomposer le carbone, nous ne pouvons quant à présent le considérer que comme une substance simple. Il paroît prouvé par les expériences modernes, qu'il est tout formé dans les végétaux, & j'ai déjà fait observer qu'il y étoit combiné avec l'hydrogène, quelquefois avec l'azote & avec le phosphore, pour former des radicaux composés; enfin que ces radicaux étoient ensuite portés à l'état d'oxides ou d'acides, suivant la proportion d'oxygène qui y étoit ajoutée.
Pour obtenir le carbone contenu dans les matières végétales ou animales, il ne faut que les faire chauffer à un degré de feu d'abord médiocre & ensuite très-fort, afin de décomposer les dernières portions d'eau que le charbon retient obstinément. Dans les opérations chimiques on se sert ordinairement de cornues de grès ou de porcelaine, dans lesquelles on introduit le bois ou autres matières combustibles, & on pousse à grand feu dans un bon 228 fourneau de reverbère: la chaleur volatilise, ou, ce qui est la même chose, convertit en gaz toutes les substances qui en sont susceptibles, & le carbone, comme le plus fixe, reste combiné avec un peu de terre & quelques sels fixes.
Dans les arts la carbonisation du bois se fait par un procédé moins coûteux: on dispose le bois en tas, on le recouvre de terre, de manière qu'il n'y ait de communication avec l'air que ce qu'il en faut pour faire brûler le bois & pour en chasser l'huile & l'eau; on étouffe ensuite le feu, en bouchant les trous qu'on avoit ménagés à la terre du fourneau.
Il y a deux manières d'analyser le carbone, sa combustion par le moyen de l'air ou plutôt du gaz oxygène, & son oxygénation par l'acide nitrique. On le convertit dans les deux cas en acide carbonique, & il laisse de la chaux, de la potasse & quelques sels neutres. Les Chimistes se sont peu occupés de ce genre d'analyse, & il n'est pas même rigoureusement démontré que la potasse existe dans le charbon avant la combustion.
229
OBSERVATIONS
Sur les Radicaux muriatique, fluorique & boracique, & sur leurs combinaisons.
On n'a point formé de Tableau pour présenter le résultat des combinaisons de ces substances, soit entr'elles, soit avec les autres corps combustibles; parce qu'elles sont toutes absolument inconnues. On sait seulement que ces radicaux s'oxygènent; qu'ils forment les acides muriatique, fluorique & boracique, & qu'alors ils sont susceptibles d'entrer dans un grand nombre de combinaisons: mais la Chimie n'a pas encore pu parvenir à les désoxygéner, s'il est permis de se servir de cette expression, & à les obtenir dans leur état de simplicité. Il faudroit, pour y parvenir, trouver un corps pour lequel l'oxygène eût plus d'affinité qu'il n'en a avec les radicaux muriatique, fluorique & boracique, ou bien se servir de doubles affinités. On peut voir dans les Observations relatives aux acides muriatique, fluorique & boracique, ce que nous savons de l'origine de leurs radicaux.
230
OBSERVATIONS
Sur la combinaison des Métaux les uns avec les autres.
Ce seroit ici le lieu, pour terminer ce qui concerne les substances simples, de présenter des Tableaux de la combinaison de tous les métaux les uns avec les autres; mais comme ces Tableaux seroient très-volumineux & ne présenteroient rien que d'incomplet, à moins de recherches qui n'ont point encore été faites, je les ai supprimés. Il me suffira de dire que toutes ces combinaisons portent le nom d'alliages, & qu'on doit nommer le premier le métal qui entre en plus grande abondance dans la composition métallique. Ainsi, alliage d'or & d'argent, ou or allié d'argent, annonce une combinaison où l'or est le métal dominant.
Les alliages métalliques ont, comme toutes les autres combinaisons, leur degré de saturation: il paroîtroit même, d'après les expériences de M. de la Briche, qu'ils en ont deux très-distincts.
231
Tableau des combinaisons de l'Azote ou Radical nitrique porté à l'état d'acide nitreux par la combinaison d'une suffisante quantité d'oxygène, avec les bases salifiables, dans l'ordre de leurs affinités avec cet acide.
| Noms des bases. | Noms des sels neutres. | ||||
| Nomenclature nouvelle. | Observations. | ||||
| Combinaisons de l'acide nitreux avec: | La baryte. | Nitrite de baryte. | Il n'y a qu'un très-petit nombre d'années que ces sels ont été découverts, & ils n'avoient point encore été nommés. | ||
| La potasse. | Nitrite de potasse. | ||||
| La soude. | Nitrite de soude. | ||||
| La chaux. | Nitrite de chaux. | ||||
| La magnésie. | Nitrite de magnésie. | ||||
| L'ammoniaque. | Nitrite d'ammoniaque. | ||||
| L'alumine. | Nitrite d'alumine. | ||||
| L'oxide de zinc. | Nitrite de zinc. | Comme les métaux se dissolvent dans les acides nitreux & nitrique, à différens degrés d'oxigénation, il doit en résulter des sels, où l'acide est réellement dans des états différens; ceux où le métal est le moins oxigéné seront appelés nitrites; ceux où il l'est davantage seront nommés nitrates: mais la limite de cette distinction n'est pas très aisée à saisir. Les anciens ne connoissoient aucuns de ces sels. | |||
| L'oxide de fer. | Nitrite de fer. | ||||
| L'oxide de manganèse. | Nitrite de manganèse. | ||||
| L'oxide de cobalt. | Nitrite de cobalt. | ||||
| L'oxide de nickel. | Nitrite de nickel. | ||||
| L'oxide de plomb. | Nitrite de plomb. | ||||
| L'oxide d'étain. | Nitrite d'étain. | ||||
| L'oxide de cuivre. | Nitrite de cuivre. | ||||
| L'oxide de bismuth. | Nitrite de bismuth. | ||||
| L'oxide d'antimoine. | Nitrite d'antimoine. | ||||
| L'oxide d'arsenic. | Nitrite d'arsenic. | ||||
| L'oxide de mercure. | Nitrite de mercure. | ||||
| L'oxide d'argent. * | Nitrite d'argent. | ||||
| L'oxide d'or. * | Nitrite d'or. | ||||
| L'oxide de platine. * | Nitrite de platine. | ||||
* Il y a grande apparence qu'il n'existe pas de nitrite d'argent, d'or & de platine, mais seulement des nitrates de ces métaux.
232
Tableau des combinaisons de l'Azote complettement saturé d'oxygène, & portée à l'état d'acide nitrique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases. | Noms des sels neutres. | |||||
| Nomenclature nouvelle. | Nomenclature ancienne. | |||||
| Combinaisons de l'acide nitrique avec: | La baryte. | Nitrate de baryte. | Nitre à base de terre pesante. | |||
| La potasse. | Nitrate de potasse, salpêtre. | Nitre, nitre à base d'alkali végétal, salpêtre. | ||||
| La soude. | Nitrate de soude. | Nitre quadrangulaire. | ||||
| Nitre à base d'alkali minéral. | ||||||
| La chaux. | Nitrate de chaux. | Nitre calcaire, nitre à base terreuse. | ||||
| Eau mère de nitre ou de salpêtre. | ||||||
| La magnésie. | Nitrate de magnésie. | Nitre à base de magnésie. | ||||
| L'ammoniaque. | Nitrate d'ammoniaque. | Nitre ammoniacal. | ||||
| L'alumine. | Nitrate d'alumine. | Alun nitreux, nitre argileux, nitre à base de terre d'alun. | ||||
| L'oxide de zinc. | Nitrate de zinc. | Nitre de zinc. | ||||
| L'oxide de fer. | Nitrate de fer. | Nitre de fer, nitre martial. | ||||
| L'oxide de manganèse. | Nitrate de manganèse. | Nitre de manganèse. | ||||
| L'oxide de cobalt. | Nitrate de cobalt. | Nitre de cobalt. | ||||
| L'oxide de nickel. | Nitrate de nickel. | Nitre de nickel. | ||||
| L'oxide de plomb. | Nitrate de plomb. | Nitre de plomb, nitre de saturne. | ||||
| L'oxide d'étain. | Nitrate d'étain. | Nitre d'étain. | ||||
| L'oxide de cuivre. | Nitrate de cuivre. | Nitre de cuivre, nitre de Vénus. | ||||
| L'oxide de bismuth. | Nitrate de bismuth. | Nitre de bismuth. | ||||
| L'oxide d'antimoine. | Nitrate d'antimoine. | Nitre d'antimoine. | ||||
| L'oxide d'arsenic. | Nitrate d'arsenic. | Nitre d'arsenic. | ||||
| Nitre arsenical. | ||||||
| L'oxide de mercure. | Nitrate de mercure. | Nitre mercuriel. | ||||
| Nitre de mercure. | ||||||
| L'oxide d'argent. | Nitrate d'argent. | Nitre d'argent. | ||||
| Nitre de lune, pierre infernale. | ||||||
| L'oxide d'or. | Nitrate d'or. | Nitre d'or. | ||||
| L'oxide de platine. | Nitrate de platine. | Nitre de platine. | ||||
233
OBSERVATIONS
Sur les Acides nitreux & nitrique, & sur le Tableau de leurs combinaisons.
L'Acide nitreux & l'acide nitrique se tirent d'un sel connu dans les arts sous le nom de salpêtre. On extrait ce sel par lixiviation des décombres des vieux bâtimens & de la terre des caves, des écuries, des granges, & en général des lieux habités. L'acide nitrique est le plus souvent uni dans ces terres à la chaux & à la magnésie, quelquefois à la potasse & plus rarement à l'alumine. Comme tous ces sels, à l'exception de celui à base de potasse, attirent l'humidité de l'air, & qu'ils seroient d'une conservation difficile dans les arts, on profite de la plus grande affinité qu'a la potasse avec l'acide nitrique, & de la propriété qu'elle a de précipiter la chaux, la magnésie & l'alumine, pour ramener ainsi dans le travail du salpêtrier & dans le rafinage qui se fait ensuite dans les magasins du Roi, tous les sels nitriques à l'état de nitrate de potasse ou de salpêtre. Pour obtenir l'acide nitreux de ce sel, on met dans une cornue tubulée trois parties de salpêtre très-pur, & une d'acide sulfurique concentré: on 234 y adapte un ballon à deux pointes, auquel on joint l'appareil de Woulfe, c'est-à-dire, des flacons à plusieurs gouleaux à moitié remplis d'eau & réunis par des tubes de verre. On voit cet appareil représenté pl. IV, fig. 1. On lutte exactement toutes les jointures, & on donne un feu gradué: il passe de l'acide nitreux en vapeurs rouges, c'est-à-dire, surchargé de gaz nitreux, ou autrement dit, qui n'est point oxygéné autant qu'il le peut être. Une partie de cet acide se condense dans le ballon, dans l'état d'une liqueur d'un jaune rouge très-foncé; le surplus se combine avec l'eau des bouteilles. Il se dégage en même-tems une grande quantité de gaz oxygène, par la raison qu'à une température un peu élevée l'oxygène a plus d'affinité avec le calorique qu'avec l'oxide nitreux, tandis que le contraire arrive à la température habituelle dans laquelle nous vivons. C'est parce qu'une partie d'oxygène a quitté ainsi l'acide nitrique, qu'il se trouve converti en acide nitreux. On peut ramener cet acide de l'état nitreux à l'état nitrique, en le faisant chauffer à une chaleur douce; le gaz nitreux qui étoit en excès s'échappe, & il reste de l'acide nitrique: mais on n'obtient par cette voie qu'un acide nitrique très-étendu d'eau, & il y a d'ailleurs une perte considérable.
On se procure de l'acide nitrique beaucoup 235 plus concentré & avec infiniment moins de perte, en mêlant ensemble du salpêtre & de l'argile bien seche, & en les poussant au feu dans une cornue de grès. L'argile se combine avec la potasse pour laquelle elle a beaucoup d'affinité: en même-tems il passe de l'acide nitrique très-légèrement fumant, & qui ne contient qu'une très-petite portion de gaz nitreux. On l'en débarrasse aisément, en faisant chauffer foiblement l'acide dans une cornue: on obtient une petite portion d'acide nitreux dans le récipient, & il reste de l'acide nitrique dans la cornue.
On a vu dans le corps de cet Ouvrage, que l'azote étoit le radical nitrique: si à vingt parties & demie en poids d'azote, on ajoute quarante-trois parties & demie d'oxygène, cette proportion constituera l'oxide ou le gaz nitreux; si on ajoute à cette première combinaison 36 autres parties d'oxygène, on aura de l'acide nitrique. L'intermédiaire entre la première & la dernière de ces proportions, donne différentes espèces d'acides nitreux, c'est-à-dire, de l'acide nitrique plus ou moins imprégné de gaz nitreux. J'ai déterminé ces proportions par voie de décomposition, & je ne puis pas assurer qu'elles soient rigoureusement exactes; mais elles ne peuvent pas s'écarter beaucoup de la vérité. M. Cavendish, qui a prouvé le premier & par 236 voie de composition, que l'azote est le radical nitrique, a donné des proportions un peu différentes & dans lesquelles l'azote entre pour une plus forte proportion: mais il est probable en même tems que c'est de l'acide nitreux qu'il a formé, & non de l'acide nitrique; & cette circonstance suffit pour expliquer jusqu'à un certain point la différence des résultats.
Pour obtenir l'acide nitrique très-pur, il faut employer du nitre dépouillé de tout mêlange de corps étrangers. Si, après la distillation, on soupçonne qu'il y reste quelques vestiges d'acide sulfurique, on y verse quelques gouttes de dissolution de nitrate barytique, l'acide sulfurique s'unit avec la baryte, & forme un sel neutre insoluble qui se précipite. On en sépare avec autant de facilité les dernières portions d'acide muriatique qui pouvoient y être contenues, en y versant quelques gouttes de nitrate d'argent; l'acide muriatique contenu dans l'acide nitrique, s'unit à l'argent avec lequel il a plus d'affinité, & se précipite sous forme de muriate d'argent qui est presqu'insoluble. Ces deux précipitations faites, on distille jusqu'à ce qu'il ait passé environ les sept huitièmes de l'acide, & on est sûr alors de l'avoir parfaitement pur.
L'acide nitrique est un de ceux qui a le plus 237 de tendance à la combinaison, & dont en même tems la décomposition est le plus facile. Il n'est presque point de substance simple, si on en excepte l'or, l'argent & le platine, qui ne lui enlève plus ou moins d'oxygène; quelques-unes même le décomposent en entier. Il a été fort anciennement connu des Chimistes, & ses combinaisons ont été plus étudiées que celles d'aucun autre. MM. Macquer & Baumé ont nommé nitres tous les sels qui ont l'acide nitrique pour acide. Nous avons dérivé leur nom de la même origine; mais nous en avons changé la terminaison, & nous les avons appelés nitrates ou nitrites, suivant qu'ils ont l'acide nitrique ou l'acide nitreux pour acide & d'après la loi générale dont nous avons expliqué les motifs, chapitre XVI. C'est également par une suite des principes généraux dont nous avons rendu compte, que nous avons spécifié chaque sel par le nom de sa base.
238
Tableau des combinaisons de l'Acide sulfurique ou Soufre oxygéné avec les bases salifiables dans l'ordre de leur affinité avec cet acide par la voie humide.
| Nomenclature nouvelle. | ||||
| Nos. | Noms des bases. | Sels neutres qui en résultent. | ||
| Combinaisons de l'acide sulfurique avec: | 1 | La baryte. | Sulfate de baryte. | |
| 2 | La potasse. | Sulfate de potasse. | ||
| 3 | La soude. | Sulfate de soude. | ||
| 4 | La chaux. | Sulfate de chaux. | ||
| 5 | La magnésie. | Sulfate de magnésie. | ||
| 6 | L'ammoniaque. | Sulfate d'ammoniaque. | ||
| 7 | L'alumine. | Sulfate d'alumine ou alun. | ||
| 8 | L'oxide de zinc. | Sulfate de zinc. | ||
| 9 | L'oxide de fer. | Sulfate de fer. | ||
| 10 | L'oxide de manganèse. | Sulfate de manganèse. | ||
| 11 | L'oxide de cobalt. | Sulfate de cobalt. | ||
| 12 | L'oxide de nickel. | Sulfate de nickel. | ||
| 13 | L'oxide de plomb. | Sulfate de plomb. | ||
| 14 | L'oxide d'étain. | Sulfate d'étain. | ||
| 15 | L'oxide de cuivre. | Sulfate de cuivre. | ||
| 16 | L'oxide de bismuth. | Sulfate de bismuth. | ||
| 17 | L'oxide d'antimoine. | Sulfate d'antimoine. | ||
| 18 | L'oxide d'arsenic. | Sulfate d'arsenic. | ||
| 19 | L'oxide de mercure. | Sulfate de mercure. | ||
| 20 | L'oxide d'argent. | Sulfate d'argent. | ||
| 21 | L'oxide d'or. | Sulfate d'or. | ||
| 22 | L'oxide de platine. | Sulfate de platine. | ||
239
| Nomenclature ancienne. | |||||
| Nos. | Noms des bases. | Sels neutres qui en résultent. | |||
| Combinaisons de l'acide vitriolique avec: | 1 | La terre pesante. | Vitriol de terre pesante, spath pesant. | ||
| 2 | L'alkali fixe végétal. | Tartre vitriolé, sel de duobus, arcanum duplicatum. | |||
| 3 | L'alkali fixe minéral. | Sel de Glauber. | |||
| 4 | La terre calcaire. | Sélénite, gypse, vitriol calcaire. | |||
| 5 | La magnésie. | Vitriol de magnésie, sel d'Epsom, sel de Sedlitz. | |||
| 6 | L'alkali volatil. | Sel ammoniacal secret de Glauber. | |||
| 7 | La terre de l'alun. | Alun. | |||
| 8 | La chaux de zinc. | Vitriol blanc, vitriol de Goslard. | |||
| Couperose blanche, vitriol de zinc. | |||||
| 9 | La chaux de fer. | Couperose verte, vitriol martial, vitriol de fer. | |||
| 10 | La chaux de manganèse. | Vitriol de manganèse. | |||
| 11 | La chaux de cobalt. | Vitriol de cobalt. | |||
| 12 | La chaux de nickel. | Vitriol de nickel. | |||
| 13 | La chaux de plomb. | Vitriol de plomb. | |||
| 14 | La chaux d'étain. | Vitriol d'étain. | |||
| 15 | La chaux de cuivre. | Vitriol de cuivre, couperose bleue. | |||
| 16 | La chaux de bismuth. | Vitriol de bismuth. | |||
| 17 | La chaux d'antimoine. | Vitriol d'antimoine. | |||
| 18 | La chaux d'arsenic. | Vitriol d'arsenic. | |||
| 19 | La chaux de mercure. | Vitriol de mercure. | |||
| 20 | La chaux d'argent. | Vitriol d'argent. | |||
| 21 | La chaux d'or. | Vitriol d'or. | |||
| 22 | La chaux de platine. | Vitriol de platine. | |||
240
OBSERVATIONS
Sur l'Acide sulfurique & sur le Tableau de ses combinaisons.
On a long-tems retiré l'acide sulfurique par distillation du sulfate de fer ou vitriol de mars, dans lequel cet acide est uni au fer. Cette distillation a été décrite par Basile Valentin, qui écrivoit dans le quinzième siècle. On préfère aujourd'hui de le tirer du soufre par la combustion, parce qu'il est beaucoup meilleur marché que celui qu'on peut extraire des différens sels sulfuriques. Pour faciliter la combustion du soufre & son oxygénation, on y mêle un peu de salpêtre ou nitrate de potasse en poudre. Ce dernier est décomposé, & fournit au soufre une portion de son oxygène, qui facilite sa conversion en acide. Malgré l'addition de salpêtre, on ne peut continuer la combustion du soufre dans des vaisseaux fermés, quelque grands qu'ils soient, que pendant un tems déterminé. La combustion cesse par deux raisons; 1o. parce que le gaz oxygène se trouve épuisé, & que l'air dans lequel se fait la combustion se trouve presque réduit à l'état de gaz azotique; 2o. parce 241 que l'acide lui-même qui reste long-tems en vapeurs, met obstacle à la combustion. Dans les travaux en grand des arts, on brûle le mêlange de soufre & de salpêtre dans de grandes chambres dont les parois sont recouvertes de feuilles de plomb: on laisse un peu d'eau au fond pour faciliter la condensation des vapeurs. On se débarrasse ensuite de cette eau, en introduisant l'acide sulfurique qu'on a obtenu dans de grandes cornues: on distille à un degré de chaleur modéré; il passe une eau légèrement acide, & il reste dans la cornue de l'acide sulfurique concentré. Dans cet état il est diaphane, sans odeur, & il pèse à peu près le double de l'eau. On prolongeroit la combustion du soufre, & on accéléreroit la fabrication de l'acide sulfurique, si on introduisoit dans les grandes chambres doublées de plomb où se fait cette opération, le vent de plusieurs soufflets qu'on dirigeroit sur la flamme. On feroit évacuer le gaz azotique par de longs canaux ou espèces de serpentins dans lesquels il seroit en contact avec de l'eau, afin de le dépouiller de tout le gaz acide sulfureux ou acide sulfurique qu'il pourroit contenir.
Suivant une première expérience de M. Berthollet, 69 parties de soufre en brûlant absorbent 31 parties d'oxygène, pour former 100 parties d'acide sulfurique. Suivant une seconde 242 expérience faite par une autre méthode, 72 parties de soufre en absorbent 28 d'oxygène, pour former la même quantité de 100 parties d'acide sulfurique sec.
Cet acide ne dissout, comme tous les autres, les métaux qu'autant qu'ils ont été préalablement oxidés; mais la plupart sont susceptibles de décomposer une portion de l'acide, & de lui enlever assez d'oxygène pour devenir dissolubles dans le surplus: c'est ce qui arrive à l'argent, au mercure & même au fer & au zinc, quand on les fait dissoudre dans de l'acide sulfurique concentré & bouillant. Ces métaux s'oxident & se dissolvent, mais ils n'enlèvent pas assez d'oxygène à l'acide pour le réduire en soufre; ils le réduisent seulement à l'état d'acide sulfureux, & il se dégage alors sous la forme de gaz acide sulfureux. Lorsqu'on met de l'argent, du mercure ou quelque métal autre que le fer & le zinc dans de l'acide sulfurique étendu d'eau, comme ils n'ont pas assez d'affinité avec l'oxygène pour l'enlever, ni au soufre, ni à l'acide sulfureux, ni à l'hydrogène, ils sont absolument insolubles dans cet acide. Il n'en est pas de même du zinc & du fer: ces deux métaux, aidés par la présence de l'acide, décomposent l'eau; ils s'oxident à ses dépens, & deviennent alors dissolubles dans l'acide, quoiqu'il ne soit ni concentré ni bouillant.
243
Tableau des combinaisons de l'Acide sulfureux avec les bases salifiables dans l'ordre de leur affinité avec cet acide.
| Nomenclature nouvelle. | |||
| Noms des bases. | Noms des sel neutres. | ||
| Combinaisons de l'acide sulfureux avec: | La baryte. | Sulfite de baryte. | |
| La potasse. | Sulfite de potasse. | ||
| La soude. | Sulfite de soude. | ||
| La chaux. | Sulfite de chaux. | ||
| La magnésie. | Sulfite de magnésie. | ||
| L'ammoniaque. | Sulfite d'ammoniaque. | ||
| L'alumine. | Sulfite d'alumine. | ||
| L'oxide de zinc. | Sulfite de zinc. | ||
| L'oxide de fer. | Sulfite de fer. | ||
| L'oxide de manganèse. | Sulfite de manganèse. | ||
| L'oxide de cobalt. | Sulfite de cobalt. | ||
| L'oxide de nickel. | Sulfite de nickel. | ||
| L'oxide de plomb. | Sulfite de plomb. | ||
| L'oxide d'étain. | Sulfite d'étain. | ||
| L'oxide de cuivre. | Sulfite de cuivre. | ||
| L'oxide de bismuth. | Sulfite de bismuth. | ||
| L'oxide d'antimoine. | Sulfite d'antimoine. | ||
| L'oxide d'arsenic. | Sulfite d'arsenic. | ||
| L'oxide de mercure. | Sulfite de mercure. | ||
| L'oxide d'argent. | Sulfite d'argent. | ||
| L'oxide d'or. | Sulfite d'or. | ||
| L'oxide de platine. | Sulfite de platine. | ||
Nota. Les anciens n'ont connu à proprement parler de ces sels que le sulfite de potasse, qui, jusqu'à ces derniers tems, a conservé le nom de sel sulfureux de Stalh. Avant la nouvelle nomenclature que nous avons proposée, on désignoit les sels sulfureux comme il suit: Sel sulfureux de Stalh à base d'alkali fixe végétal, sel sulfureux de Stalh à base d'alkali fixe minéral, sel sulfureux de Stalh à base de terre calcaire.
On a suivi dans ce tableau l'ordre des affinités indiqué par M. Bergman pour l'acide sulfurique, parce qu'en effet à l'égard des alkalis & des terres, l'ordre est le même pour l'acide sulfureux; mais il n'est pas certain qu'il en soit de même pour les oxides métalliques.
244
OBSERVATIONS
Sur l'Acide sulfureux, & sur le Tableau de ses combinaisons.
L'Acide sulfureux est formé, comme l'acide sulfurique, de la combinaison du soufre avec l'oxygène, mais avec une moindre proportion de ce dernier. On peut l'obtenir de différentes manières, 1o. en faisant brûler du soufre lentement, 2o. en distillant de l'acide sulfurique sur de l'argent, de l'antimoine, du plomb, du mercure ou du charbon: une portion d'oxygène s'unit au métal, & l'acide passe dans l'état d'acide sulfureux. Cet acide existe naturellement dans l'état de gaz au degré de température & de pression dans lequel nous vivons; mais il paroît, d'après des expériences de M. Clouet, qu'à un très-grand degré de refroidissement, il se condense & devient liquide: l'eau absorbe beaucoup plus de ce gaz acide qu'elle n'absorbe de gaz acide carbonique; mais elle en absorbe beaucoup moins que de gaz acide muriatique.
C'est une vérité bien établie, & que je n'ai peut-être que trop répétée, que les métaux en général ne peuvent se dissoudre dans les acides, qu'autant qu'ils peuvent s'y oxider: or l'acide sulfureux étant déjà dépouillé d'une grande 245 partie de l'oxygène nécessaire pour le constituer acide sulfurique, il est plutôt disposé à en reprendre qu'à en fournir à la plupart des métaux, & c'est pour cela qu'il ne peut les dissoudre, à moins qu'ils n'aient été préalablement oxidés. Par une suite du même principe, les oxides métalliques se dissolvent dans l'acide sulfureux sans effervescence & même avec beaucoup de facilité. Cet acide a même, comme l'acide muriatique, la propriété de dissoudre des oxides métalliques qui sont trop oxygénés, & qui seroient par cela même indissolubles dans l'acide sulfurique; il forme alors avec eux de véritables sulfates. On pourroit donc soupçonner qu'il n'existe que des sulfates métalliques & non des sulfites, si les phénomènes qui ont lieu dans la dissolution du fer, du mercure, & de quelques autres métaux, ne nous apprenoient que ces substances métalliques sont susceptibles de s'oxider plus ou moins en se dissolvant dans les acides. D'après cette observation le sel dans lequel le métal sera le moins oxidé devra porter le nom de sulfite, & celui dans lequel le métal sera le plus oxidé devra porter le nom de sulfate. On ignore encore si cette distinction, nécessaire pour le fer & pour le mercure, est applicable à tous les autres sulfates métalliques.
246
Tableau des combinaisons du Phosphore qui a reçu un premier degré d'oxygénation, & qui a été porté à l'état d'Acide phosphoreux, avec les bases salifiables dans l'ordre de leur affinité avec cet acide.
| Nomenclature nouvelle. | |||
| Noms des bases. | Noms des sels neutres. | ||
| Combinaisons de l'acide phosphoreux avec: | La chaux. | Phosphite de chaux. | |
| La baryte. | Phosphite de baryte. | ||
| La magnésie. | Phosphite de magnésie. | ||
| La potasse. | Phosphite de potasse. | ||
| La soude. | Phosphite de soude. | ||
| L'ammoniaque. | Phosphite d'ammoniaque. | ||
| L'alumine. | Phosphite d'alumine. | ||
| L'oxide de zinc. | Phosphite de zinc. * | ||
| L'oxide de fer. | Phosphite de fer. | ||
| L'oxide de manganèse. | Phosphite de manganèse. | ||
| L'oxide de cobalt. | Phosphite de cobalt. | ||
| L'oxide de nickel. | Phosphite de nickel. | ||
| L'oxide de plomb. | Phosphite de plomb. | ||
| L'oxide d'étain. | Phosphite d'étain. | ||
| L'oxide de cuivre. | Phosphite de cuivre. | ||
| L'oxide de bismuth. | Phosphite de bismuth. | ||
| L'oxide d'antimoine. | Phosphite d'antimoine. | ||
| L'oxide d'arsenic. | Phosphite d'arsenic. | ||
| L'oxide de mercure. | Phosphite de mercure. | ||
| L'oxide d'argent. | Phosphite d'argent. | ||
| L'oxide d'or. | Phosphite d'or. | ||
| L'oxide de platine. | Phosphite de platine. | ||
* L'existence des phosphites métalliques n'est pas encore absolument certaine, elle suppose que les métaux sont susceptibles de se dissoudre dans l'acide phosphorique, à différens degrés d'oxygénation, ce qui n'est pas encore prouvé.
Aucuns de ces sels n'avoient été nommés.
247
Tableau des combinaisons du Phosphore saturé d'oxygène, ou Acide phosphorique avec les substances salifiables dans l'ordre de leur affinité avec cet acide *.
| Nomenclature nouvelle. | |||
| Noms des bases. | Noms des sel neutres. | ||
| Combinaisons de l'acide phosphorique avec: | La chaux. | Phosphate de chaux. | |
| La baryte. | Phosphate de baryte. | ||
| La magnésie. | Phosphate de magnésie. | ||
| La potasse. | Phosphate de potasse. | ||
| La soude. | Phosphate de soude. | ||
| L'ammoniaque. | Phosphate d'ammoniaque. | ||
| L'alumine. | Phosphate d'alumine. | ||
| L'oxide de zinc. | Phosphate de zinc. | ||
| L'oxide de fer. | Phosphate de fer. | ||
| L'oxide de manganèse. | Phosphate de manganèse. | ||
| L'oxide de cobalt. | Phosphate de cobalt. | ||
| L'oxide de nickel. | Phosphate de nickel. | ||
| L'oxide de plomb. | Phosphate de plomb. | ||
| L'oxide d'étain. | Phosphate d'étain. | ||
| L'oxide de cuivre. | Phosphate de cuivre. | ||
| L'oxide de bismuth. | Phosphate de bismuth. | ||
| L'oxide d'antimoine. | Phosphate d'antimoine. | ||
| L'oxide d'arsenic. | Phosphate d'arsenic. | ||
| L'oxide de mercure. | Phosphate de mercure. | ||
| L'oxide d'argent. | Phosphate d'argent. | ||
| L'oxide d'or. | Phosphate d'or. | ||
| L'oxide de platine. | Phosphate de platine. | ||
* La plupart de ces sels ne sont connus que depuis très-peu de tems, & n'avoient point encore été nommés.
248
OBSERVATIONS
Sur les Acides phosphoreux & phosphorique, & sur les Tableaux de leurs combinaisons.
On a vu, à l'article Phosphore, un précis historique de la découverte de cette singulière substance, & quelques observations sur la manière dont il existe dans les végétaux & dans les animaux.
Le moyen le plus sûr pour obtenir l'acide phosphorique pur & exempt de tout mélange, est de prendre du phosphore en nature, & de le faire brûler sous des cloches de verre, dont on a humecté l'intérieur en y promenant de l'eau distillée. Il absorbe dans cette opération 2 fois 1/2 son poids d'oxygène. On peut obtenir cet acide concret en faisant cette même combustion sur du mercure au lieu de la faire sur de l'eau: il se présente alors dans l'état de floccons blancs qui attirent l'humidité de l'air avec une prodigieuse activité. Pour avoir ce même acide dans l'état d'acide phosphoreux, c'est-à-dire, moins oxygéné, il faut abandonner le phosphore à une combustion extrêmement lente, & le laisser tomber en quelque façon en déliquium à l'air dans un entonnoir placé sur un 249 flacon de cristal. Au bout de quelques jours on trouve le phosphore oxygéné; l'acide phosphoreux, à mesure qu'il s'est formé, s'est emparé d'une portion d'humidité de l'air, & a coulé dans le flacon. L'acide phosphoreux se convertit au surplus aisément en acide phosphorique par une simple exposition à l'air long-tems continuée. Comme le phosphore a une assez grande affinité avec l'oxygène pour l'enlever à l'acide nitrique & à l'acide muriatique oxygéné, il en résulte encore un moyen simple & peu dispendieux d'obtenir l'acide phosphorique. Lorsqu'on veut opérer par l'acide nitrique, on prend une cornue tubulée bouchée avec un bouchon de cristal; on l'emplit à moitié d'acide nitrique concentré, on fait chauffer légèrement, puis on introduit par la tubulure de petits morceaux de phosphore. Ils se dissolvent avec effervescence; en même tems le gaz nitreux s'échappe sous la forme de vapeurs rutilantes. On continue ainsi d'ajouter du phosphore jusqu'à ce qu'il refuse de se dissoudre. On pousse alors le feu un peu plus fort pour chasser les dernières portions d'acide nitrique, & on trouve l'acide phosphorique dans la cornue, en partie sous forme concrète, & en partie sous forme liquide.
250
Tableau des combinaisons du Radical carbonique oxygéné, ou Acide carbonique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide *.
| Noms des bases. | Noms des sels neutres. | |||
| Nomenclature nouvelle. | Nomenclature ancienne. | |||
| Combinaisons de l'acide carbonique avec: | Carbonate | |||
| La baryte. | de baryte. | Terre pesante aérée ou effervescente. | ||
| La chaux. | de chaux. | Terre calcaire, spath calcaire, craie. | ||
| La potasse. | de potasse. | Alkali fixe végétal effervescent, méphite de potasse. | ||
| La soude. | de soude. | Alkali fixe minéral effervescent, méphite de soude. | ||
| La magnésie. | de magnésie. | Magnésie effervescente, base du sel d'Epsom effervescente, méphite de magnésie. | ||
| L'ammoniaque. | d'ammoniaque. | Alkali volatil effervescent, méphite d'ammoniaque. | ||
| L'alumine. | d'alumine. | Méphite argileux, terre d'alun aérée. | ||
| L'oxide de zinc. | de zinc. | Zinc spathique, méphite de zinc. | ||
| L'oxide de fer. | de fer. | Fer spathique, méphite de fer. | ||
| L'oxide de manganèse. | de manganèse. | Méphite de manganèse. | ||
| L'oxide de cobalt. | de cobalt. | Méphite de cobalt. | ||
| L'oxide de nickel. | de nickel. | Méphite de nickel. | ||
| L'oxide de plomb. | de plomb. | Plomb spathique ou méphite de plomb. | ||
| L'oxide d'étain. | d'étain. | Méphite d'étain. | ||
| L'oxide de cuivre. | de cuivre. | Méphite de cuivre. | ||
| L'oxide de bismuth. | de bismuth. | Méphite de bismuth. | ||
| L'oxide d'antimoine. | d'antimoine. | Méphite d'antimoine. | ||
| L'oxide d'arsenic. | d'arsenic. | Méphite d'arsenic. | ||
| L'oxide de mercure. | de mercure. | Méphite de mercure. | ||
| L'oxide d'argent. | d'argent. | Méphite d'argent. | ||
| L'oxide d'or. | d'or. | Méphite d'or. | ||
| L'oxide de platine. | de platine. | Méphite de platine. | ||
* Ces sels n'étant connus & définis que depuis quelques années, il n'existe pas, à proprement parler, pour eux de nomenclature ancienne. On a cru cependant devoir les désigner ici sous les noms que M. de Morveau leur a donnés dans son premier volume de l'Encyclopédie. M. Bergman désignoit les bases saturées de cet acide par l'épithète aérée; ainsi, la terre calcaire aérée exprimoit la terre calcaire saturée d'acide carbonique. M. de Fourcroy avoit donné le nom d'acide crayeux à l'acide carbonique, & le nom de craie à tous les sels qui résultent de la combinaison de cet acide avec les bases salifiables.
251
OBSERVATIONS
Sur l'Acide carbonique & sur le Tableau de ses combinaisons.
De tous les acides que nous connoissons, l'acide carbonique est peut-être celui qui est le plus abondamment répandu dans la nature. Il est tout formé dans les craies, dans les marbres, dans toutes les pierres calcaires, & il y est neutralisé principalement par une terre particulière connue sous le nom de chaux. Pour le dégager de ces substances, il ne faut que verser dessus de l'acide sulfurique, ou tout autre acide qui ait plus d'affinité avec la chaux que n'en a l'acide carbonique: il se fait une vive effervescence, laquelle n'est produite que par le dégagement de cet acide, qui prend la forme de gaz dès qu'il est libre. Ce gaz n'est susceptible de se condenser par aucun des degrés de refroidissement & de pression auxquels il a été exposé jusqu'ici: il ne s'unit avec l'eau qu'à peu près à volume égal, & il en résulte un acide extrêmement foible.
On peut encore obtenir l'acide carbonique assez pur, en le dégageant de la matière sucrée en fermentation; mais alors il tient une petite portion d'alkool en dissolution.
Le carbone est le radical de l'acide carbonique. On peut en conséquence former artificiellement 252 cet acide, en brûlant du charbon dans du gaz oxygène, ou bien en combinant de la poudre de charbon avec un oxide métallique dans de justes proportions. L'oxygène de l'oxide se combine avec le charbon, forme du gaz acide carbonique, & le métal devenu libre reparoît sous sa forme métallique.
C'est à M. Black que nous devons les premières connoissances qu'on ait eues sur cet acide. La propriété qu'il a de n'exister que sous forme de gaz au degré de température & de pression dans lequel nous vivons, l'avoit soustrait aux recherches des anciens Chimistes.
Si on pouvoit parvenir à décomposer cet acide par des moyens peu dispendieux, on auroit fait une découverte bien précieuse pour l'humanité, puisqu'on pourroit obtenir libres les masses immenses de carbone que contiennent les terres calcaires, les marbres, &c. On ne le peut pas par des affinités simples, puisque le corps qu'il faudroit employer pour décomposer l'acide carbonique, devroit être au moins aussi combustible que le charbon même, & qu'alors on ne feroit que changer un combustible contre un autre: mais il n'est pas impossible d'y parvenir par des affinités doubles; & ce qui porte à le croire, c'est que la nature résout complètement ce problême, & avec des matériaux qui ne lui coûtent rien dans l'acte de la végétation.
253
Tableau des combinaisons du Radical muriatique oxygéné, ou Acide muriatique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases. | Noms des sels neutres. | |||||
| Nomenclature nouvelle. | Nomenclature ancienne. | |||||
| Combinaisons de l'acide muriatique avec: | Muriate | |||||
| La baryte. | de baryte. | Sel marin à base de terre pesante. | ||||
| La potasse. | de potasse. | Sel fébrifuge de Sylvius. | ||||
| Sel marin à base d'alkali fixe végétal. | ||||||
| La soude. | de soude. | Sel marin. | ||||
| La chaux. | de chaux. | Sel marin à base terreuse. | ||||
| Huile de chaux. | ||||||
| La magnésie. | de magnésie. | Sel d'Epsom marin, sel marin à base de sel d'Epsom ou de magnésie. | ||||
| L'ammoniaque. | d'ammoniaque. | Sel ammoniac. | ||||
| L'alumine. | d'alumine. | Alun marin, sel marin à base de terre d'alun. | ||||
| L'oxide de zinc. | de zinc. | Sel marin de zinc. | ||||
| L'oxide de fer. | de fer. | Sel de fer, sel marin martial. | ||||
| L'oxide de manganèse. | de manganèse. | Sel marin de manganèse. | ||||
| L'oxide de cobalt. | de cobalt. | Sel marin de cobalt. | ||||
| L'oxide de nickel. | de nickel. | Sel marin de nickel. | ||||
| L'oxide de plomb. | de plomb. | Plomb corné. | ||||
| L'oxide d'étain. | d'étain fumant. | Liqueur fumante de Libavius. | ||||
| d'étain solide. | Beurre d'étain solide. | |||||
| L'oxide de cuivre. | de cuivre. | Sel marin de cuivre. | ||||
| L'oxide de bismuth. | de bismuth. | Sel marin de bismuth. | ||||
| L'oxide d'antimoine. | d'antimoine. | Sel marin d'antimoine. | ||||
| L'oxide d'arsenic. | d'arsenic. | Sel marin d'arsenic. | ||||
| L'oxide de mercure | de mercure doux. | Mercure sublimé doux, aquila alba. | ||||
| de mercure corrosif. | Mercure sublimé corrosif. | |||||
| L'oxide d'argent. | d'argent. | Argent corné. | ||||
| L'oxide d'or. | d'or. | Sel marin d'or. | ||||
| L'oxide de platine. | de platine. | Sel marin de platine. | ||||
254
Tableau des combinaisons de l'Acide muriatique oxigéné avec les différentes bases salifiables avec lesquelles il est susceptible de s'unir.
| Noms des bases. | Noms des sels neutres. | ||||
| Nomenclature nouvelle. | Nomenclature ancienne. | ||||
| Combinaisons de l'acide muriatique oxigéné avec: | La baryte. | Muriate oxygéné de baryte. | Cet ordre de sels qui étoit absolument inconnu aux anciens, a été découvert en 1786 par M. Berthollet. | ||
| La potasse. | Muriate oxygéné de potasse. | ||||
| La soude. | Muriate oxygéné de soude. | ||||
| La chaux. | Muriate oxygéné de chaux. | ||||
| La magnésie. | Muriate oxygéné de magnésie. | ||||
| L'alumine. | Muriate oxygéné d'alumine. | ||||
| L'oxide de zinc. | Muriate oxygéné de zinc. | ||||
| L'oxide de fer. | Muriate oxygéné de fer. | ||||
| L'oxide de manganèse. | Muriate oxygéné de manganèse. | ||||
| L'oxide de cobalt. | Muriate oxygéné de cobalt. | ||||
| L'oxide de nickel. | Muriate oxygéné de nickel. | ||||
| L'oxide de plomb. | Muriate oxygéné de plomb. | ||||
| L'oxide d'étain. | Muriate oxygéné d'étain. | ||||
| L'oxide de cuivre. | Muriate oxygéné de cuivre. | ||||
| L'oxide de bismuth. | Muriate oxygéné de bismuth. | ||||
| L'oxide d'antimoine. | Muriate oxygéné d'antimoine. | ||||
| L'oxide d'arsenic. | Muriate oxygéné d'arsenic. | ||||
| L'oxide de mercure. | Muriate oxygéné de mercure. | ||||
| L'oxide d'argent. | Muriate oxygéné d'argent. | ||||
| L'oxide d'or. | Muriate oxygéné d'or. | ||||
| L'oxide de platine. | Muriate oxygéné de platine. | ||||
255
OBSERVATIONS
Sur l'Acide muriatique & sur le Tableau de ses combinaisons.
L'Acide muriatique est répandu très-abondamment dans le règne minéral: il y est uni avec différentes bases, principalement avec la soude, la chaux & la magnésie. C'est avec ces trois bases qu'on le rencontre dans l'eau de la mer & dans celle de plusieurs lacs: il est plus communément uni avec la soude dans les mines de sel gemme. Cet acide ne paroît pas avoir été décomposé jusqu'à ce jour dans aucune expérience chimique; en sorte que nous n'avons nulle idée de la nature de son radical: ce n'est même que par analogie que nous concluons qu'il contient le principe acidifiant ou oxygène. M. Berthollet avoit soupçonné que ce radical pouvoit être de nature métallique; mais comme il paroît que l'acide muriatique se forme journellement dans les lieux habités, par la combinaison de miasmes & de fluides aériformes, il faudroit supposer qu'il existe un gaz métallique dans l'atmosphère; ce qui n'est pas sans doute impossible, mais ce qu'on ne peut admettre, au moins que d'après des preuves. 256
L'acide muriatique ne tient que médiocrement aux bases avec lesquelles il est uni: l'acide sulfurique l'en chasse, & c'est principalement par l'intermède de cet acide que les Chimistes ont coutume de se le procurer. On pourroit employer d'autres acides pour remplir ce même objet, par exemple, l'acide nitrique, mais cet acide étant volatil, il auroit l'inconvénient de se mêler avec l'acide muriatique dans la distillation. Il faut dans cette opération employer environ une partie d'acide sulfurique concentré, & deux de sel marin. On se sert d'une cornue tubulée dans laquelle on introduit d'abord le sel; on y adapte un récipient également tubulé, à la suite duquel on ajoute deux ou trois bouteilles remplies d'eau, & qui sont jointes par des tubes, à la manière de M. Woulfe. La figure 1, planche IV, représente cet appareil. On lutte bien toutes les jointures, après quoi on introduit l'acide sulfurique dans la cornue par la tubulure, & on la referme aussitôt avec son bouchon de cristal. C'est une propriété de l'acide muriatique, de ne pouvoir exister que dans l'état de gaz, à la température & au degré de pression dans lequel nous vivons: il seroit donc impossible de le coercer, si on ne lui présentoit de l'eau avec laquelle il a une grande affinité. Il s'unit dans une très-grande proportion à celle 257 contenue dans les bouteilles adaptées au ballon; & lorsqu'elles en sont saturées, il en résulte ce que les anciens appeloient esprit de sel fumant, & ce que nous appelons aujourd'hui acide muriatique.
Celui qu'on obtient par ce procédé, n'est pas saturé d'oxygène autant qu'il le peut être, il est susceptible d'en prendre une nouvelle dose, si on le distille sur des oxides métalliques, tels que l'oxide de manganèse, l'oxide de plomb ou celui de mercure: l'acide qui se forme alors, & que nous nommons acide muriatique oxygéné, ne peut exister comme le précédent, lorsqu'il est libre, que dans l'état gazeux; il n'est plus susceptible d'être absorbé par l'eau en aussi grande quantité. Si on en imprègne ce fluide au-delà d'une certaine proportion, l'acide se précipite au fond du vase sous forme concrète. L'acide muriatique oxygéné est susceptible comme l'a démontré M. Berthollet, de se combiner avec un grand nombre de bases salifiables; les sels qu'il forme sont susceptibles de détoner avec le carbone & avec plusieurs substances métalliques: ces détonations sont d'autant plus dangereuses, que l'oxygène entre dans la composition du muriate oxygéné avec une très-grande quantité de calorique qui donne lieu par son expansion à des explosions très-dangereuses.
258
Tableau des combinaisons de l'Acide nitro-muriatique avec les bases salifiables, rangées par ordre alphabétique, attendu que les affinités de cet acide ne sont point assez connues.
| Nomenclature nouvelle. | |||
| Noms des bases. | Noms des sel neutres. | ||
| Combinaisons de l'acide nitro-muriatique avec: | L'alumine. | Nitro-muriate d'alumine. | |
| L'ammoniaque. | Nitro-muriate d'ammoniaque. | ||
| L'antimoine. | Nitro-muriate d'antimoine. | ||
| L'argent. | Nitro-muriate d'argent. | ||
| L'arsenic. | Nitro-muriate d'arsenic. | ||
| La baryte. | Nitro-muriate de baryte. | ||
| Le bismuth. | Nitro-muriate de bismuth. | ||
| La chaux. | Nitro-muriate de chaux. | ||
| Le cobalt. | Nitro-muriate de cobalt. | ||
| Le cuivre. | Nitro-muriate de cuivre. | ||
| L'étain. | Nitro-muriate d'étain. | ||
| Le fer. | Nitro-muriate de fer. | ||
| La magnésie. | Nitro-muriate de magnésie. | ||
| Le manganèse. | Nitro-muriate de manganèse. | ||
| Le mercure. | Nitro-muriate de mercure. | ||
| Le molybdène. | Nitro-muriate de molybdène. | ||
| Le nickel. | Nitro-muriate de nickel. | ||
| L'or. | Nitro-muriate d'or. | ||
| Le platine. | Nitro-muriate de platine. | ||
| Le plomb. | Nitro-muriate de plomb. | ||
| La potasse. | Nitro-muriate de potasse. | ||
| La soude. | Nitro-muriate de soude. | ||
| Le tungstène. | Nitro-muriate de tungstène. | ||
| Le zinc. | Nitro-muriate de zinc. | ||
Nota. La plupart de ces combinaisons, sur-tout celles de l'acide nitro-muriatique avec les terres & les alkalis ont été peu examinées, on ignore s'il se forme un sel mixte, ou si les deux acides se séparent pour former deux sels distincts.
259
OBSERVATIONS
Sur l'Acide nitro-muriatique & sur le Tableau de ses combinaisons.
L'Acide nitro-muriatique, anciennement appelé eau régale, est formé par un mêlange d'acide nitrique & d'acide muriatique. Les radicaux de ces deux acides s'unissent ensemble dans cette combinaison, & il en résulte un acide à deux bases, qui a des propriétés particulières qui n'appartiennent à aucun des deux séparément, notamment celle de dissoudre l'or & le platine.
Dans les dissolutions nitro-muriatiques, comme dans toutes les autres, les métaux commencent par s'oxider avant de se dissoudre; ils s'emparent d'une portion de l'oxygène de l'acide, il se dégage en même-tems un gaz nitro-muriatique d'une espèce particulière, qui n'a encore été bien décrit par personne. Son odeur est très-désagréable, & il est aussi funeste qu'aucun autre aux animaux qui le respirent; il attaque les instrumens de fer & les rouille; l'eau en absorbe une assez grande quantité, & prend quelques caractères d'acidité. J'ai eu occasion de faire ces observations, lorsque j'ai traité le 260 platine & que je l'ai fait dissoudre très-en grand dans l'acide nitro-muriatique.
J'avois d'abord soupçonné que dans le mélange de l'acide nitrique & de l'acide muriatique, ce dernier s'emparoit d'une partie de l'oxygène de l'acide nitrique, & qu'alors porté à l'état d'acide muriatique oxygéné, il devenoit susceptible de dissoudre l'or; mais plusieurs faits se refusent à cette explication. S'il en étoit ainsi, en faisant chauffer de l'acide nitro-muriatique, il s'en dégageroit du gaz nitreux; & cependant on n'en obtient pas sensiblement. Je reviens donc à considérer l'acide nitro-muriatique comme un acide à deux bases, & j'adopte entièrement à cet égard les idées de M. Berthollet.
261
Tableau des combinaisons du Radical fluorique oxigéné, ou Acide fluorique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases. | Noms des sels neutres. | ||||
| Nomenclature nouvelle. | Nomenclat. ancienne. | ||||
| Combinaisons de l'acide fluorique avec: | La chaux. | Fluate de chaux. | Toutes ces combinaisons ont été inconnues aux anciens Chimistes. | ||
| La baryte. | Fluate de baryte. | ||||
| La magnésie. | Fluate de magnésie. | ||||
| La potasse. | Fluate de potasse. | ||||
| La soude. | Fluate de soude. | ||||
| L'ammoniaque. | Fluate d'ammoniaque. | ||||
| L'oxide de zinc. | Fluate de zinc. | ||||
| L'oxide de manganèse. | Fluate de manganèse. | ||||
| L'oxide de fer. | Fluate de fer. | ||||
| L'oxide de plomb. | Fluate de plomb. | ||||
| L'oxide d'étain. | Fluate d'étain. | ||||
| L'oxide de cobalt. | Fluate de cobalt. | ||||
| L'oxide de cuivre. | Fluate de cuivre. | ||||
| L'oxide de nickel. | Fluate de nickel. | ||||
| L'oxide d'arsenic. | Fluate d'arsenic. | ||||
| L'oxide de bismuth. | Fluate de bismuth. | ||||
| L'oxide de mercure. | Fluate de mercure. | ||||
| L'oxide d'argent. | Fluate d'argent. | ||||
| L'oxide d'or. | Fluate d'or. | ||||
| L'oxide de platine. Et par la voie sèche. |
Fluate de platine. | ||||
| L'alumine. | Fluate d'alumine. | ||||
262
OBSERVATIONS
Sur l'Acide fluorique, & sur le Tableau de ses combinaisons.
La nature nous offre l'acide fluorique tout formé dans le spath fluor, spath phosphorique ou fluate de chaux: il y est combiné avec la terre calcaire, & forme un sel insoluble.
Pour obtenir l'acide fluorique seul & dégagé de toute combinaison, on met du spath fluor ou fluate de chaux dans une cornue de plomb; on verse dessus de l'acide sulfurique, & on adapte à la cornue un récipient également de plomb, à moitié rempli d'eau. On donne une chaleur douce, & l'acide fluorique est absorbé par l'eau du récipient, à mesure qu'il se dégage. Comme cet acide est naturellement sous forme de gaz au degré de chaleur & de pression dans lequel nous vivons, on peut le recueillir dans cet état dans l'appareil pneumato-chimique au mercure, comme on y reçoit le gaz acide marin, le gaz acide sulfureux, le gaz acide carbonique.
On est obligé de se servir pour cette opération de vaisseaux métalliques, parce que l'acide 263 fluorique dissout le verre & la terre siliceuse; il communique même de la volatilité à ces deux substances, & il les enlève avec lui dans l'état de gaz.
C'est à M. Margraff que nous devons la première connoissance de cet acide; mais il ne l'a jamais obtenu que combiné avec une quantité considérable de silice: il ignoroit d'ailleurs que ce fût un acide particulier & sui generis.
M. le duc de Liancourt, dans un Mémoire imprimé sous le nom de M. Boulanger, a étendu beaucoup plus loin nos connoissances sur les propriétés de l'acide fluorique; enfin M. Schéele semble avoir mis la dernière main à ce travail.
Il ne reste plus aujourd'hui qu'à déterminer quelle est la nature du radical fluorique; mais comme il ne paroît pas qu'on soit encore parvenu à décomposer l'acide, on ne peut avoir aucun apperçu de la nature du radical. S'il y avoit quelques expériences à tenter à cet égard, ce ne pourroit être que par la voie des doubles affinités qu'on pourroit espérer quelque succès.
264
Tableau des combinaisons du Radical boracique oxigéné, avec les différentes bases salifiables auxquelles il est susceptible de s'unir dans l'ordre de leur affinité avec cet acide.
| Nomenclature nouvelle. | |||
| Noms des bases. | Noms des sel neutres. | ||
| Combinaisons de l'acide boracique avec: | La chaux. | Borate de chaux. | |
| La baryte. | Borate de baryte. | ||
| La magnésie. | Borate de magnésie. | ||
| La potasse. | Borate de potasse. | ||
| La soude. | Borate de soude, ou borax. | ||
| L'ammoniaque. | Borate d'ammoniaque. | ||
| L'oxide de zinc. | Borate de zinc. | ||
| L'oxide de fer. | Borate de fer. | ||
| L'oxide de plomb. | Borate de plomb. | ||
| L'oxide d'étain. | Borate d'étain. | ||
| L'oxide de cobalt. | Borate de cobalt. | ||
| L'oxide de cuivre. | Borate de cuivre. | ||
| L'oxide de nickel. | Borate de nickel. | ||
| L'oxide de mercure. | Borate de mercure. | ||
| L'alumine. | Borate d'alumine. | ||
Nota. La plupart de ces combinaisons n'ont été ni nommées, ni connues par les anciens; ils donnoient à l'acide boracique le nom de sel sédatif, & ils donnoient le nom de borax à base d'alkali fixe végétal, borax à base d'alkali fixe minéral, borax à base de terre calcaire, aux combinaisons du sel sédatif avec la potasse, la soude & la chaux.
265
OBSERVATIONS
Sur l'Acide boracique, & sur le Tableau de ses combinaisons.
On donne le nom de boracique à un acide concret qu'on retire du borax, sel qui nous vient de l'Inde par le commerce. Quoique le borax ait été employé très-anciennement dans les arts, on n'a que des notions très-incertaines sur son origine, sur la manière de l'extraire & de le purifier. On a lieu de soupçonner que c'est un sel natif, qui se trouve naturellement dans les terres de quelques contrées de l'Inde & dans l'eau des lacs: tout le commerce de ce sel se fait par les Hollandois; ils ont été long-tems seuls en possession de le purifier; mais MM. l'Eguillier, dans une fabrique qu'ils ont élevée à Paris, sont parvenus à rivaliser avec eux: le procédé de cette purification, au surplus, est encore un mystère. L'analyse chimique nous a appris que le borax étoit un sel neutre avec excès de base; que cette base étoit la soude, & qu'elle étoit en partie neutralisée par un acide particulier, qui a été long-tems appelé sel sédatif de Homberg, & que nous avons désigné sous le nom d'acide boracique. On le rencontre 266 quelquefois libre dans l'eau des lacs; celle du lac Cherchiaio en Italie en contient 94 grains & demi par pinte.
Pour séparer l'acide boracique & l'obtenir libre, on commence par dissoudre le borax dans l'eau bouillante; on filtre la liqueur très-chaude & on y verse de l'acide sulfurique, ou un autre acide quelconque qui ait plus d'affinité avec la soude que n'en a l'acide boracique. Ce dernier se sépare aussitôt, & on l'obtient sous forme cristalline par refroidissement.
On a cru long-tems que l'acide boracique étoit un produit de l'opération par laquelle on l'obtenoit: on se persuadoit en conséquence qu'il étoit différent, suivant l'acide qu'on avoit employé pour le séparer d'avec la soude. Aujourd'hui il est bien reconnu que l'acide boracique est toujours identiquement le même, de quelque manière qu'il ait été dégagé, pourvu toutefois qu'il ait été bien dépouillé de tout acide étranger par le lavage, & qu'on l'ait purifié par une ou deux cristallisations successives.
L'acide boracique est soluble dans l'eau & dans l'alkool. Il a la propriété de communiquer à la flamme de ce dernier dans lequel on l'a dissous, une couleur verte, & cette circonstance avoit fait croire qu'il contenoit du cuivre: mais aucune expérience décisive n'a confirmé 267 ce résultat; il y a apparence que si le borax contient quelquefois du cuivre, il lui est accidentel.
Cet acide se combine avec les substances salifiables, par la voie humide & par la voie sèche. Il ne dissout pas directement les métaux par la voie humide, mais on peut parvenir à opérer la combinaison par double affinité.
Le Tableau ci-dessus présente les différentes substances avec lesquelles l'acide boracique peut s'unir dans l'ordre des affinités qui s'observent par la voie humide; il exige un changement notable, lorsqu'on opère par la voie sèche: alors l'alumine qui est placée la dernière, doit être placée immédiatement après la soude.
Le radical boracique est entièrement inconnu; l'oxygène y tient tellement, qu'il n'a pas encore été possible de l'en séparer par aucun moyen. Ce n'est même que par analogie qu'on peut conclure que l'oxygène fait partie de sa combinaison, comme de celle de tous les acides.
268
Tableau des combinaisons de l'Arsenic oxygéné, ou Acide arsenique avec les bases salifiables dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | Observation. | |||
| Combinaisons de l'acide arsenique avec: | La chaux. | Arseniate de chaux. | Ce genre de sels étoit absolument inconnu aux anciens. M. Macquer, qui a découvert en 1746 la combinaison de l'acide arsenique avec la potasse & la soude, les avoit nommés sels neutres arsenicaux. | ||
| La baryte. | Arseniate de baryte. | ||||
| La magnésie. | Arseniate de magnésie. | ||||
| La potasse. | Arseniate de potasse. | ||||
| La soude. | Arseniate de soude. | ||||
| L'ammoniaque. | Arseniate d'ammoniaque. | ||||
| L'oxide de zinc. | Arseniate de zinc. | ||||
| L'oxide de manganèse. | Arseniate de manganèse. | ||||
| L'oxide de fer. | Arseniate de fer. | ||||
| L'oxide de plomb. | Arseniate de plomb. | ||||
| L'oxide d'étain. | Arseniate d'étain. | ||||
| L'oxide de cobalt. | Arseniate de cobalt. | ||||
| L'oxide de cuivre. | Arseniate de cuivre. | ||||
| L'oxide de nickel. | Arseniate de nickel. | ||||
| L'oxyde de bismuth. | Arseniate de bismuth. | ||||
| L'oxide de mercure. | Arseniate de mercure. | ||||
| L'oxide d'antimoine. | Arseniate d'antimoine. | ||||
| L'oxide d'argent. | Arseniate d'argent. | ||||
| L'oxide d'or. | Arseniate d'or. | ||||
| L'oxide de platine. | Arseniate de platine. | ||||
| L'alumine. | Arseniate d'alumine. | ||||
269
OBSERVATIONS
Sur l'Acide arsenique, & sur le Tableau de ses combinaisons.
Dans un Mémoire imprimé dans le recueil de l'Académie, année 1746, M. Macquer a fait voir qu'en poussant au feu un mêlange d'oxide blanc d'arsenic & de nitre, on obtenoit un sel neutre, qu'il a nommé sel neutre arsenical. On ignoroit entièrement, à l'époque où M. Macquer a publié ce Mémoire, la cause de ce singulier phénomène, & comment une substance métallique pouvoit jouer le rôle d'un acide. Des expériences plus modernes nous ont appris que l'arsenic s'oxygénoit dans cette opération; qu'il enlevoit l'oxygène à l'acide nitrique, & qu'à l'aide de ce principe il se convertissoit en un véritable acide, qui se combinoit ensuite avec la potasse. On connoît aujourd'hui d'autres moyens, non-seulement d'oxygéner l'arsenic, mais encore d'obtenir l'acide arsenique libre & dégagé de toute combinaison. Le plus simple est de dissoudre l'oxide blanc d'arsenic dans trois fois son poids d'acide muriatique: on ajoute dans cette dissolution, pendant qu'elle est encore bouillante, une quantité d'acide nitrique 270 double du poids de l'arsenic, & on évapore jusqu'à siccité. L'acide nitrique se décompose dans cette opération; son oxygène s'unit à l'oxide d'arsenic pour l'acidifier; le radical nitrique se dissipe sous forme de gaz nitreux. A l'égard de l'acide muriatique, il se convertit en gaz muriatique, & on peut le retenir par voie de distillation. On s'assure qu'il ne reste plus d'acide étranger, en calcinant l'acide concret jusqu'à ce qu'il commence à rougir: ce qui reste ainsi dans le creuset est de l'acide arsenique pur.
Il y a plusieurs autres manières d'oxygéner l'arsenic & de le convertir en un acide. Le procédé que Schéele a employé & que M. de Morveau a répété avec un grand succès dans le laboratoire de Dijon, consiste à distiller de l'acide muriatique oxygéné sur de la manganèse. Cet acide s'oxygène, comme je l'ai dit ailleurs, & passe sous la forme d'acide muriatique sur-oxygéné. On le reçoit dans un récipient dans lequel on a mis de l'oxide blanc d'arsenic recouvert d'un peu d'eau distillée. L'arsenic blanc décompose l'acide muriatique oxygéné, il lui enlève l'oxygène surabondant; d'une part, il se convertit en acide arsenique, & de l'autre l'acide muriatique oxygéné redevient acide muriatique ordinaire. On sépare ces deux acides 271 en distillant à une chaleur douce, qu'on augmente cependant sur la fin: l'acide muriatique passe & l'acide arsenique reste sous forme blanche & concrète. Dans cet état il est beaucoup moins volatil que l'oxide blanc d'arsenic.
Très-souvent l'acide arsenique tient en dissolution une portion d'oxide blanc d'arsenic qui n'a pas été suffisamment oxygéné. On n'est point exposé à cet inconvénient, quand on a opéré par l'acide nitrique, & qu'on en ajoute de nouveau, jusqu'à ce qu'il ne passât plus de gaz nitreux.
D'après ces différentes observations, je définirai l'acide arsenique, un acide métallique blanc, concret fixe au degré de feu qui le fait rougir, formé par la combinaison de l'arsenic avec l'oxygène, qui se dissout dans l'eau, & qui est susceptible de se combiner avec un grand nombre de bases salifiables.
272
Tableau des combinaisons du Molybdène oxygéné, ou Acide molybdique avec les bases salifiables, par ordre alphabétique *.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide molybdique avec: | L'alumine. | Molybdate d'alumine. | |
| L'ammoniaque. | Molybdate d'ammoniaque. | ||
| L'oxide d'antimoine. | Molybdate d'antimoine. | ||
| L'oxide d'argent. | Molybdate d'argent. | ||
| L'oxide d'arsenic. | Molybdate d'arsenic. | ||
| La baryte. | Molybdate de baryte. | ||
| L'oxide de bismuth. | Molybdate de bismuth. | ||
| La chaux. | Molybdate de chaux. | ||
| L'oxide de cobalt. | Molybdate de cobalt. | ||
| L'oxide de cuivre. | Molybdate de cuivre. | ||
| L'oxide d'étain. | Molybdate d'étain. | ||
| L'oxide de fer. | Molybdate de fer. | ||
| La magnésie. | Molybdate de magnésie. | ||
| L'oxide de manganèse. | Molybdate de manganèse. | ||
| L'oxide de mercure. | Molybdate de mercure. | ||
| L'oxide de nickel. | Molybdate de nickel. | ||
| L'oxide d'or. | Molybdate d'or. | ||
| L'oxide de platine. | Molybdate de platine. | ||
| L'oxide de plomb. | Molybdate de plomb. | ||
| La potasse. | Molybdate de potasse. | ||
| La soude. | Molybdate de soude. | ||
| Le zinc. | Molybdate de zinc. | ||
* On a suivi dans le tableau l'ordre alphabétique, parce que l'on ne connoît pas bien les affinités de cet acide avec les différentes bases. C'est à M. Schéele qu'on doit la découverte de cet acide, comme de beaucoup d'autres.
Nota. Toute cette classe de sels a été nouvellement découverte, & n'avoit point encore été nommée.
273
OBSERVATIONS
Sur l'Acide molybdique, & sur le Tableau de ses combinaisons.
Le molybdène est une substance métallique particulière, qui est susceptible de s'oxygéner au point de se transformer en un véritable acide concret. Pour y parvenir, on introduit dans une cornue une partie de mine de molybdène, telle que la nature nous la présente, & qui est un véritable sulfure de molybdène; on y ajoute cinq ou six parties d'un acide nitrique affoibli d'un quart d'eau environ, & on distille. L'oxygène de l'acide nitrique se porte sur le molybdène & sur le soufre; il transforme l'un en un oxide métallique, & l'autre en acide sulfurique. On repasse de nouvel acide nitrique dans la même proportion & jusqu'à quatre ou cinq fois; & quand il n'y a plus de vapeurs rouges, le molybdène est oxygéné autant qu'il le peut être, du moins par ce moyen, & on le trouve au fond de la cornue sous forme blanche, pulvérulente, comme de la craie. Cet acide est peu soluble, & on peut, sans risquer d'en perdre beaucoup, le laver avec de l'eau chaude. Cette précaution est nécessaire pour le débarrasser des dernières portions d'acide sulfurique, qui pourroient y adhérer.
274
Tableau des combinaisons du Tungstène oxygéné, ou Acide tungstique avec les bases salifiables.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide tungstique avec: | La chaux. | Tungstate de chaux. | |
| La baryte. | Tungstate de baryte. | ||
| La magnésie. | Tungstate de magnésie. | ||
| La potasse. | Tungstate de potasse. | ||
| La soude. | Tungstate de soude. | ||
| L'ammoniaque | Tungstate d'ammoniaque. | ||
| L'alumine. | Tungstate d'alumine. | ||
| L'oxide d'antimoine. | Tungstate d'antimoine. | ||
| L'oxide d'argent. | Tungstate d'argent. | ||
| L'oxide d'arsenic. | Tungstate d'arsenic. | ||
| L'oxide de bismuth. | Tungstate de bismuth. | ||
| L'oxide de cobalt. | Tungstate de cobalt. | ||
| L'oxide de cuivre. | Tungstate de cuivre. | ||
| L'oxide d'étain. | Tungstate d'étain. | ||
| L'oxide de fer. | Tungstate de fer. | ||
| L'oxide de manganèse. | Tungstate de manganèse. | ||
| L'oxide de mercure. | Tungstate de mercure. | ||
| L'oxide de molybdène. | Tungstate de molybdène. | ||
| L'oxide de nickel. | Tungstate de nickel. | ||
| L'oxide d'or. | Tungstate d'or. | ||
| L'oxide de platine. | Tungstate de platine. | ||
| L'oxide de plomb. | Tungstate de plomb. | ||
| L'oxide de zinc. | Tungstate de zinc. | ||
275
OBSERVATIONS
Sur l'Acide tungstique, & sur le Tableau de ses combinaisons.
On donne le nom de tungstène à un métal particulier dont la mine a été souvent confondue avec celles d'étain; dont la cristallisation a du rapport avec celle des grenats; dont la pesanteur spécifique excède 6000, celle de l'eau étant supposée 1000; enfin qui varie du blanc perlé au rougeâtre & au jaune. On le trouve en plusieurs endroits de la Saxe & en Bohême.
Le volfram est aussi une véritable mine de tungstène, qui se rencontre fréquemment dans les mines de Cornouailles.
Le métal qui porte le nom de tungstène, est dans l'état d'oxide dans ces deux espèces de mines. Il paroîtroit même qu'il est porté, dans la mine de tungstène, au-delà de l'état d'oxide; qu'il y fait fonction d'acide: il y est uni à la chaux.
Pour obtenir cet acide libre, on mêle une partie de mine de tungstène avec quatre parties de carbonate de potasse, & on fait fondre le mêlange dans un creuset. Lorsque la matière 276 est refroidie, on la met en poudre & on verse dessus douze parties d'eau bouillante; puis on ajoute de l'acide nitrique qui s'unit à la potasse avec laquelle il a plus d'affinité, & en dégage l'acide tungstique: cet acide se précipite aussitôt sous forme concrète. On peut y repasser de l'acide nitrique qu'on évapore à siccité, & continuer ainsi jusqu'à ce qu'il ne se dégage plus de vapeurs rouges; on est assuré pour lors qu'il est complètement oxygéné. Si on veut obtenir l'acide tungstique pur, il faut opérer la fusion de la mine avec le carbonate de potasse dans un creuset de platine; autrement la terre du creuset se mêleroit avec les produits, & altéreroit la pureté de l'acide.
Les affinités de l'acide tungstique avec les oxides métalliques ne sont point déterminées, & c'est pour cette raison qu'on les a rangées par ordre alphabétique; à l'égard des autres substances salifiables, on les a rangées dans l'ordre de leur affinité avec l'acide tungstique. Toute cette classe de sels n'avoit été ni connue ni nommée par les anciens.
277
Tableau des combinaisons du Radical tartareux oxygéné, ou Acide tartareux avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Nomenclature nouvelle. | |||
| Combinaisons de l'acide tartareux avec: | La chaux. | Tartrite de chaux. | |
| La baryte. | Tartrite de baryte. | ||
| La magnésie. | Tartrite de magnésie. | ||
| La potasse. | Tartrite de potasse. | ||
| La soude. | Tartrite de soude. | ||
| L'ammoniaque. | Tartrite d'ammoniaque. | ||
| L'alumine. | Tartrite d'alumine. | ||
| L'oxide de zinc. | Tartrite de zinc. | ||
| L'oxide de fer. | Tartrite de fer. | ||
| L'oxide de manganèse. | Tartrite de manganèse. | ||
| L'oxide de cobalt. | Tartrite de cobalt. | ||
| L'oxide de nickel. | Tartrite de nickel. | ||
| L'oxide de plomb. | Tartrite de plomb. | ||
| L'oxide d'étain. | Tartrite d'étain. | ||
| L'oxide de cuivre. | Tartrite de cuivre. | ||
| L'oxide de bismuth. | Tartrite de bismuth. | ||
| L'oxide d'antimoine. | Tartrite d'antimoine. | ||
| L'oxide d'arsenic. | Tartrite d'arsenic. | ||
| L'oxide d'argent. | Tartrite d'argent. | ||
| L'oxide de mercure. | Tartrite de mercure. | ||
| L'oxide d'or. | Tartrite d'or. | ||
| L'oxide de platine. | Tartrite de platine. | ||
278
OBSERVATIONS
Sur l'Acide tartareux, & sur le Tableau de ses combinaisons.
Tout le monde connoît le tartre qui s'attache autour des tonneaux dans lesquels la fermentation du vin s'est achevée. Ce sel est composé d'un acide particulier sui generis, combiné avec la potasse, mais de manière que l'acide est dans un excès considérable.
C'est encore M. Schéele qui a enseigné aux Chimistes le moyen d'obtenir l'acide tartareux pur. Il a observé d'abord que cet acide avoit plus d'affinité avec la chaux qu'avec la potasse; il prescrit en conséquence de commencer par dissoudre du tartre purifié dans de l'eau bouillante, & d'y ajouter de la chaux jusqu'à ce que tout l'acide soit saturé. Le tartrite de chaux qui se forme, est un sel presqu'insoluble qui tombe au fond de la liqueur, sur-tout quand elle est refroidie; on l'en sépare par décantation, on le lave avec de l'eau froide & on le sèche; après quoi on verse dessus de l'acide sulfurique étendu de 8 à 9 fois son poids d'eau, on fait digérer pendant douze heures, à une chaleur 279 douce, en observant de remuer de tems en tems: l'acide sulfurique s'empare de la chaux, forme du sulfate de chaux, & l'acide tartareux se trouve libre. Il se dégage pendant cette digestion une petite quantité de gaz qui n'a pas été examiné. Au bout de douze heures on décante la liqueur, on lave le sulfate de chaux avec de l'eau froide pour emporter les portions d'acide tartareux dont il est imprégné; on réunit tous les lavages à la première liqueur, on filtre, on évapore & on obtient l'acide tartareux concret. Deux livres de tartre purifié, donnent environ onze onces d'acide. La quantité d'acide sulfurique nécessaire pour cette quantité de tartre, est de 8 à 10 onces d'acide concentré qu'on étend, comme je viens de le dire, de 8 à 9 parties d'eau.
Comme le radical combustible est en excès dans cet acide, nous lui avons conservé la terminaison en eux, & nous avons nommé tartrites le résultat de sa combinaison avec les substances salifiables.
La base de l'acide tartareux est le radical carbone-hydreux ou hydro-carboneux, & il paroît qu'il y est moins oxygéné que dans l'acide oxalique. Les expériences de M. Hassenfratz paroissent prouver que l'azote entre aussi dans la combinaison de ce radical, même en 280 assez grande quantité. En oxygénant l'acide tartareux, on le convertit en acide oxalique, en acide malique & en acide acéteux: mais il est probable que la proportion de l'hydrogène & du carbone change dans ces conversions, & que la différence du degré d'oxygénation n'est pas la seule cause qui constitue la différence de ces acides.
L'acide tartareux, en se combinant avec les alkalis fixes, est susceptible de deux degrés de saturation: le premier constitue un sel avec excès d'acide, nommé très-improprement crême de tartre, & que nous avons nommé tartrite acidule de potasse. La même combinaison donne par un second degré de saturation un sel parfaitement neutre, que nous nommons simplement tartrite de potasse, & qui est connu en pharmacie sous le nom de sel végétal. Le même acide combiné avec la soude jusqu'à saturation, donne un tartrite de soude connu sous le nom de sel de seignette, ou de sel polycreste de la Rochelle.
281
Tableau des combinaisons du Radical malique oxygéné, ou Acide malique avec les bases salifiables par ordre alphabétique.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Nomenclature nouvelle. | |||
| Combinaisons de l'acide malique avec: | L'alumine. | Malate d'alumine. | |
| L'ammoniaque. | Malate d'ammoniaque. | ||
| L'oxide d'antimoine. | Malate d'antimoine. | ||
| L'oxide d'argent. | Malate d'argent. | ||
| L'oxide d'arsenic. | Malate d'arsenic. | ||
| La baryte. | Malate de baryte. | ||
| L'oxide de bismuth. | Malate de bismuth. | ||
| La chaux. | Malate de chaux. | ||
| L'oxide de cobalt. | Malate de cobalt. | ||
| L'oxide de cuivre. | Malate de cuivre. | ||
| L'oxide d'étain. | Malate d'étain. | ||
| L'oxide de fer. | Malate de fer. | ||
| La magnésie. | Malate de magnésie. | ||
| L'oxide de manganèse. | Malate de manganèse. | ||
| L'oxide de mercure. | Malate de mercure. | ||
| L'oxide de nickel. | Malate de nickel. | ||
| L'oxide d'or. | Malate d'or. | ||
| L'oxide de platine. | Malate de platine. | ||
| L'oxide de plomb. | Malate de plomb. | ||
| La potasse. | Malate de potasse. | ||
| La soude. | Malate de soude. | ||
| L'oxide de zinc. | Malate de zinc. | ||
Nota. Toutes ces combinaisons étoient inconnues aux anciens.
282
OBSERVATIONS
Sur l'Acide malique, & sur le Tableau de ses combinaisons.
L'Acide malique se trouve tout formé dans le jus des pommes acides, mûres ou non mûres, & d'un grand nombre d'autres fruits. Pour l'obtenir, on commence par saturer le jus de pommes avec de la potasse ou de la soude. On verse ensuite sur la liqueur saturée, de l'acétite de plomb dissoute dans l'eau. Il se fait un échange de bases; l'acide malique se combine avec le plomb, & se précipite. On lave bien ce précipité, ou plutôt ce sel qui est à-peu-près insoluble; après quoi on y verse de l'acide sulfurique affoibli qui chasse l'acide malique, s'empare du plomb, forme avec lui un sulfate qui est de même très-peu soluble & qu'on sépare par filtration; il reste l'acide malique libre & en liqueur. Cet acide se trouve mêlé avec l'acide citrique & avec l'acide tartareux dans un grand nombre de fruits: il tient à-peu-près le milieu entre l'acide oxalique & l'acide acéteux; & c'est ce qui a porté M. Hermbstadt à lui donner le nom de vinaigre 283 imparfait. Il est plus oxygéné que l'acide oxalique, mais il l'est moins que l'acide acéteux. Il differe aussi de ce dernier par la nature de son radical, qui contient un peu plus de carbone & un peu moins d'hydrogène. On peut le former artificiellement, en traitant du sucre avec de l'acide nitrique. Si on s'est servi d'un acide étendu d'eau, il ne se forme point de cristaux d'acide oxalique; mais la liqueur contient réellement deux acides, savoir l'acide oxalique, l'acide malique, & probablement même un peu d'acide tartareux. Pour s'en assurer, il ne s'agit que de verser de l'eau de chaux sur la liqueur; il se forme du tartrite & de l'oxalate de chaux, qui se déposent au fond comme insolubles; il se forme en même tems du malate de chaux qui reste en dissolution. Pour avoir l'acide pur & libre, on décompose le malate de chaux par l'acétite de plomb, & on enlève le plomb à l'acide malique par l'acide sulfurique, de la même manière que quand on opère directement sur le jus des pommes.
284
Tableau des combinaisons du Radical citrique oxygéné, ou Acide citrique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide *.
| Noms des bases salifiables. | Noms des sels neutres. | Observation. | |||
| Combinaisons de l'acide citrique avec: | La baryte. | Citrate de baryte. | Toutes ces combinaisons étoient inconnues aux anciens chimistes. | ||
| La chaux. | Citrate de chaux. | ||||
| La magnésie. | Citrate de magnésie. | ||||
| La potasse. | Citrate de potasse. | ||||
| La soude. | Citrate de soude. | ||||
| L'ammoniaque. | Citrate d'ammoniaque. | ||||
| L'oxide de zinc. | Citrate de zinc. | ||||
| L'oxide de manganèse. | Citrate de manganèse. | ||||
| L'oxide de fer. | Citrate de fer. | ||||
| L'oxide de plomb. | Citrate de plomb. | ||||
| L'oxide de cobalt. | Citrate de cobalt. | ||||
| L'oxide de cuivre. | Citrate de cuivre. | ||||
| L'oxide d'arsenic. | Citrate d'arsenic. | ||||
| L'oxide de mercure. | Citrate de mercure. | ||||
| L'oxide d'antimoine. | Citrate d'antimoine. | ||||
| L'oxide d'argent. | Citrate d'argent. | ||||
| L'oxide d'or. | Citrate d'or. | ||||
| L'oxide de platine. | Citrate de platine. | ||||
| L'alumine. | Citrate d'alumine. | ||||
* Les affinités de cet acide ont été déterminées par M. Bergman & par M. de Breney, de l'Académie de Dijon.
285
OBSERVATIONS
Sur l'Acide citrique, & sur le Tableau de ses combinaisons.
On donne le nom de citrique à l'acide en liqueur qu'on retire par expression du citron; on le rencontre dans plusieurs autres fruits mêlé avec l'acide malique. Pour l'obtenir pur & concentré, on lui laisse déposer sa partie muqueuse par un long repos dans un lieu frais, tel que la cave, ensuite on le concentre par un froid de 4 ou 5 degrés au-dessous de zéro du thermomètre de Réaumur: l'eau se gèle & l'acide reste en liqueur. On peut ainsi le réduire à un huitième de son volume. Un trop grand degré de froid nuiroit au succès de l'opération, parce que l'acide se trouveroit engagé dans la glace, & qu'on auroit de la peine à l'en séparer. Cette préparation de l'acide citrique est de M. Georgius. On peut l'obtenir d'une manière plus simple encore, en saturant du jus de citron avec de la chaux. Il se forme un citrate calcaire qui est indissoluble dans l'eau; on lave ce sel, & on verse dessus de l'acide sulfurique, qui s'empare de la chaux & qui forme du sulfate de chaux, sel presque insoluble. L'acide citrique reste libre dans la liqueur.
286
Tableau des combinaisons du Radical pyro-ligneux oxygéné, ou Acide pyro-ligneux avec des bases salifiables dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide pyro-ligneux avec: | La chaux. | Pyro-lignite de chaux. | |
| La baryte. | Pyro-lignite de baryte. | ||
| La potasse. | Pyro-lignite de potasse. | ||
| La soude. | Pyro-lignite de soude. | ||
| La magnésie. | Pyro-lignite de magnésie. | ||
| L'ammoniaque. | Pyro-lignite d'ammoniaque. | ||
| L'oxide de zinc. | Pyro-lignite de zinc. | ||
| L'oxide de manganèse. | Pyro-lignite de manganèse. | ||
| L'oxide de fer. | Pyro-lignite de fer. | ||
| L'oxide de plomb. | Pyro-lignite de plomb. | ||
| L'oxide d'étain. | Pyro-lignite d'étain. | ||
| L'oxide de cobalt. | Pyro-lignite de cobalt. | ||
| L'oxide de cuivre. | Pyro-lignite de cuivre. | ||
| L'oxide de nickel. | Pyro-lignite de nickel. | ||
| L'oxide d'arsenic. | Pyro-lignite d'arsenic. | ||
| L'oxide de bismuth. | Pyro-lignite de bismuth. | ||
| L'oxide de mercure. | Pyro-lignite de mercure. | ||
| L'oxide d'antimoine. | Pyro-lignite d'antimoine. | ||
| L'oxide d'argent. | Pyro-lignite d'argent. | ||
| L'oxide d'or. | Pyro-lignite d'or. | ||
| L'oxide de platine. | Pyro-lignite de platine. | ||
| L'alumine. | Pyro-lignite d'alumine. | ||
Nota. Toutes ces combinaisons étoient inconnues aux anciens Chimistes.
287
OBSERVATIONS
Sur l'Acide pyro-ligneux, & sur le Tableau de ses combinaisons.
Les anciens Chimistes avoient observé que la plupart des bois, & sur-tout ceux qui sont lourds & compactes, donnoient par la distillation à feu nud un esprit acide d'une nature particulière; mais personne, avant M. Goettling, ne s'étoit occupé d'en rechercher la nature. Le travail qu'il a donné sur ce sujet, se trouve dans le Journal de Crell, année 1779. L'acide pyro-ligneux qu'on obtient par la distillation du bois à feu nud, est de couleur brune; il est très-chargé d'huile & de charbon; pour l'obtenir plus pur, on le rectifie par une seconde distillation. Il paroît qu'il est à peu près le même, de quelque bois qu'il ait été tiré. M. de Morveau & M. Eloi Boursier de Clervaux se sont attachés à déterminer les affinités de cet acide avec les différentes bases salifiables; & c'est dans l'ordre qu'ils leur ont assigné, qu'on les présente ici. Le radical de cet acide est principalement formé d'hydrogène & de carbone.
288
Tableau des combinaisons du Radical pyro-tartareux oxygéné, ou Acide pyro-tartareux avec les différentes bases salifiables dans l'ordre de leur affinité avec cet acide *.
| Noms des bases. | Noms des sels neutres. | ||
| Combinaisons de l'acide pyro-tartareux avec: | La potasse. | Pyro-tartrite de potasse. | |
| La soude. | Pyro-tartrite de soude. | ||
| La baryte . | Pyro-tartrite de baryte. | ||
| La chaux. | Pyro-tartrite de chaux. | ||
| La magnésie. | Pyro-tartrite de magnésie. | ||
| L'ammoniaque. | Pyro-tartrite d'ammoniaque. | ||
| L'alumine. | Pyro-tartrite d'alumine. | ||
| L'oxide de zinc. | Pyro-tartrite de zinc. | ||
| L'oxide de manganèse. | Pyro-tartrite de manganèse. | ||
| L'oxide de fer. | Pyro-tartrite de fer. | ||
| L'oxide de plomb. | Pyro-tartrite de plomb. | ||
| L'oxide d'étain. | Pyro-tartrite d'étain. | ||
| L'oxide de cobalt. | Pyro-tartrite de cobalt. | ||
| L'oxide de cuivre. | Pyro-tartrite de cuivre. | ||
| L'oxide de nickel. | Pyro-tartrite de nickel. | ||
| L'oxide d'arsenic. | Pyro-tartrite d'arsenic. | ||
| L'oxide de bismuth. | Pyro-tartrite de bismuth. | ||
| L'oxide de mercure. | Pyro-tartrite de mercure. | ||
| L'oxide d'antimoine. | Pyro-tartrite d'antimoine. | ||
| L'oxide d'argent. | Pyro-tartrite d'argent. | ||
Nota. Toutes ces combinaisons étoient inconnues aux anciens Chimistes.
* On ne connoît pas encore les affinités de cet acide: mais comme il a beaucoup de rapport avec l'acide pyro-muqueux, on les a supposées les mêmes.
289
OBSERVATIONS
Sur l'Acide pyro-tartareux, & sur le Tableau de ses combinaisons.
On donne le nom de pyro-tartareux à un acide empyreumatique peu concentré qu'on retire du tartre purifié par voie de distillation. Pour l'obtenir, on remplit à moitié de tartrite acidule de potasse ou tartre en poudre, une cornue de verre; on y adapte un récipient tubulé auquel on ajoute un tube qui s'engage sous une cloche dans l'appareil pneumato-chimique. En graduant le feu, on obtient une liqueur acide empyreumatique mêlée avec de l'huile: on sépare ces deux produits au moyen d'un entonnoir, & c'est la liqueur acide qu'on a nommée acide pyro-tartareux. Il se dégage dans cette distillation une prodigieuse quantité de gaz acide carbonique. L'acide pyro-tartareux qu'on obtient, n'est pas parfaitement pur; il contient toujours de l'huile qu'il seroit à souhaiter qu'on en pût séparer. Quelques auteurs ont conseillé de le rectifier; mais les Académiciens de Dijon ont constaté que cette opération étoit dangereuse, & qu'il y avoit explosion.
290
Tableau des combinaisons du Radical pyro-muqueux oxygéné, ou Acide pyro-muqueux avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases. | Noms des sels neutres. | ||
| Combinaisons de l'acide pyro-muqueux avec: | La potasse. | Pyro-mucite de potasse. | |
| La soude. | Pyro-mucite de soude. | ||
| La baryte. | Pyro-mucite de baryte. | ||
| La chaux. | Pyro-mucite de chaux. | ||
| La magnésie. | Pyro-mucite de magnésie. | ||
| L'ammoniaque. | Pyro-mucite d'ammoniaque. | ||
| L'alumine. | Pyro-mucite d'alumine. | ||
| L'oxide de zinc. | Pyro-mucite de zinc. | ||
| L'oxide de manganèse. | Pyro-mucite de manganèse. | ||
| L'oxide de fer. | Pyro-mucite de fer. | ||
| L'oxide de plomb. | Pyro-mucite de plomb. | ||
| L'oxide d'étain. | Pyro-mucite d'étain. | ||
| L'oxide de cobalt. | Pyro-mucite de cobalt. | ||
| L'oxide de cuivre. | Pyro-mucite de cuivre. | ||
| L'oxide de nickel. | Pyro-mucite de nickel. | ||
| L'oxide d'arsenic. | Pyro-mucite d'arsenic. | ||
| L'oxide de bismuth. | Pyro-mucite de bismuth. | ||
| L'oxide d'antimoine. | Pyro-mucite d'antimoine. | ||
Nota. Toutes ces combinaisons étoient inconnues aux anciens Chimistes.
291
OBSERVATIONS
Sur l'Acide pyro-muqueux, & sur le Tableau de ses combinaisons.
On retire l'acide pyro-muqueux du sucre & de tous les corps sucrés par la distillation à feu nud. Comme ces substances se boursouflent considérablement au feu, on doit laisser vuides les sept huitièmes de la cornue. Cet acide est d'un jaune qui tire sur le rouge: on l'obtient moins coloré en le rectifiant par une seconde distillation. Il est principalement composé d'eau & d'une petite portion d'huile légèrement oxygénée. Quand il en tombe sur les mains, il les tache en jaune, & ces taches ne s'en vont qu'avec l'épiderme. La manière la plus simple de le concentrer, est de l'exposer à la gelée ou bien à un froid artificiel: si on l'oxygène par l'acide nitrique, on le convertit en partie en acide oxalique & en acide malique.
C'est mal à-propos qu'on a prétendu qu'il se dégage beaucoup de gaz pendant la distillation de cet acide; il n'en passe presque point quand la distillation est conduite lentement & par un degré de feu modéré.
292
Tableau des combinaisons du Radical oxalique oxygéné, ou Acide oxalique avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide oxalique avec: | La chaux. | Oxalate de chaux. | |
| La baryte. | Oxalate de baryte. | ||
| La magnésie. | Oxalate de magnésie. | ||
| La potasse. | Oxalate de potasse. | ||
| La soude. | Oxalate de soude. | ||
| L'ammoniaque. | Oxalate d'ammoniaque. | ||
| L'alumine. | Oxalate d'alumine. | ||
| L'oxide de zinc. | Oxalate de zinc. | ||
| L'oxide de fer. | Oxalate de fer. | ||
| L'oxide de manganèse. | Oxalate de manganèse. | ||
| L'oxide de cobalt. | Oxalate de cobalt. | ||
| L'oxide de nickel. | Oxalate de nickel. | ||
| L'oxide de plomb. | Oxalate de plomb. | ||
| L'oxide de cuivre. | Oxalate de cuivre. | ||
| L'oxide de bismuth. | Oxalate de bismuth. | ||
| L'oxide d'antimoine. | Oxalate d'antimoine. | ||
| L'oxide d'arsenic. | Oxalate d'arsenic. | ||
| L'oxide de mercure. | Oxalate de mercure. | ||
| L'oxide d'argent. | Oxalate d'argent. | ||
| L'oxide d'or. | Oxalate d'or. | ||
| L'oxide de platine. | Oxalate de platine. | ||
Nota. Toutes ces combinaisons étoient inconnues aux anciens Chimistes.
293
OBSERVATIONS
Sur l'Acide oxalique, & sur le Tableau de les combinaisons.
L'Acide oxalique se prépare principalement en Suisse & en Allemagne; il se tire du suc de l'oseille qu'on exprime, & dans lequel ses cristaux se forment par un long repos. Dans cet état il est en partie saturé par de l'alkali fixe végétal ou potasse; en sorte que c'est, à proprement parler, un sel neutre avec un grand excès d'acide. Quand on veut obtenir l'acide pur, il faut le former artificiellement, & on y parvient en oxygénant le sucre, qui paroît être le véritable radical oxalique. On verse en conséquence sur une partie de sucre six à huit parties d'acide nitrique, & on fait chauffer à une chaleur douce; il se produit une vive effervescence, & il se dégage une grande abondance de gaz nitreux; après quoi en laissant reposer la liqueur, il s'y forme des cristaux qui sont de l'acide oxalique très-pur. On les sèche sur un papier gris pour en séparer les dernières portions d'acide nitrique dont il pourroit être imbibé; & pour être encore plus sûr de la pureté de l'acide, on le dissout dans de l'eau distillée & on le fait cristalliser une seconde fois.
294
L'acide oxalique n'est pas le seul qu'on puisse obtenir du sucre en l'oxygénant. La même liqueur qui a donné des cristaux d'acide oxalique, par refroidissement contient en outre l'acide malique, qui est un peu plus oxigéné. Enfin, en oxygénant encore davantage le sucre, on le convertit en acide acéteux ou vinaigre.
L'acide oxalique uni à une petite quantité de soude ou de potasse, a, comme l'acide tartareux, la propriété d'entrer tout entier dans un grand nombre de combinaisons, sans se décomposer: il en résulte des sels à deux bases, qu'il a bien fallu nommer. Nous avons appelé le sel d'oseille oxalate acidule de potasse.
Il y a plus d'un siècle que l'acide oxalique est connu des Chimistes. M. Duclos en a fait mention dans les Mémoires de l'Académie des Sciences, année 1688. Il a été décrit avec assez de soin par Boerhaave: mais M. Schéele est le premier qui ait reconnu qu'il contenoit de la potasse toute formée, & qui ait démontré son identité avec l'acide qu'on forme par l'oxygénation du sucre.
295
Tableau des combinaisons du Radical acéteux oxygéné, par un premier degré d'oxigénation avec les bases salifiables, suivant l'ordre de leur affinité avec cet acide.
| Nomenclature nouvelle. | |||
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide acéteux avec: | La baryte. | Acétite de baryte. | |
| La potasse. | Acétite de potasse. | ||
| La soude. | Acétite de soude. | ||
| La chaux. | Acétite de chaux. | ||
| La magnésie. | Acétite de magnésie. | ||
| L'ammoniaque. | Acétite d'ammoniaque. | ||
| L'oxide de zinc. | Acétite de zinc. | ||
| L'oxide de manganèse. | Acétite de manganèse. | ||
| L'oxide de fer. | Acétite de fer. | ||
| L'oxide de plomb. | Acétite de plomb. | ||
| L'oxide d'étain. | Acétite d'étain. | ||
| L'oxide de cobalt. | Acétite de cobalt. | ||
| L'oxide de cuivre. | Acétite de cuivre. | ||
| L'oxide de nickel. | Acétite de nickel. | ||
| L'oxide d'arsenic. | Acétite d'arsenic. | ||
| L'oxide de bismuth. | Acétite de bismuth. | ||
| L'oxide de mercure. | Acétite de mercure. | ||
| L'oxide d'antimoine. | Acétite d'antimoine. | ||
| L'oxide d'argent. | Acétite d'argent. | ||
| L'oxide d'or. | Acétite d'or. | ||
| L'oxide de platine. | Acétite de platine. | ||
| L'alumine. | Acétite d'alumine. | ||
| Nomenclature ancienne. | |||
| Noms des bases. | Noms des sels neutres. | ||
| Combinaisons de l'acide du vinaigre avec: | La terre pesante. | Inconnue des anciens. La découverte en est due à M. de Morveau qui l'a nommée acète barotique. | |
| L'alkali fixe végétal. | Terre foliée de tartre très-secrète de Muller, arcane de tartre de Basile Valentin, & de Paracelse, Magistère purgatif de tartre de Schroëder, sel essentiel de vin de Zwelfer, tartre régénéré de Tachénius, sel diurétique de Sylvius, de Wilson. | ||
| L'alkali fixe minéral. | Terre foliée à base d'alkali minéral, terre foliée minérale, terre foliée cristallisable, sel acéteux minéral. | ||
| La terre calcaire. | Sel de craie, sel de corail, sel d'yeux d'écrevisses; Hartman en a fait mention. | ||
| La base du sel d'epsom. | Inconnue des anciens; M. Wenzel est le premier qui en ait parlé. | ||
| L'alkali volatil. | Esprit de Mendérérus ou de Menderet, sel acéteux ammoniacal. | ||
| La chaux de zinc. | Cette combinaison a été connue de Glauber, Schwedemberg, Respour, Pott, de M. de Lassone, & de M. Wenzel, mais ils ne l'ont pas désignée par un nom particulier. | ||
| La chaux de manganèse. | Inconnue des anciens. | ||
| La chaux de fer. | Vinaigre martial. Cette combinaison a été décrite par Scheffer, par MM. Monnet, Wenzel & le Duc d'Ayen. | ||
| La chaux de plomb. | Sucre de Saturne, vinaigre de Saturne, sel de Saturne. | ||
| La chaux d'étain. | Cette combinaison a été connue de MM. Lémery, Margraff, Monnet, Weslendorf & Wenzel, mais ils ne lui ont pas donné de nom. | ||
| La chaux de cobalt. | Encre de simpathie de M. Cadet. | ||
| La chaux de cuivre. | Verd de gris, cristaux de verdet, cristaux de Vénus, verdet, verdet distillé. | ||
| La chaux de nickel. | Inconnue des anciens. | ||
| La chaux d'arsenic. | Liqueur fumante, arsenico-acéteuse, ou phosphore liquide de M. Cadet. | ||
| La chaux de bismuth. | Sucre de bismuth de M. Geoffroi. Cette combinaison a été connue de MM. Gellert, Pott, Weslendorf, Bergman & de Morveau. | ||
| La chaux de mercure. | Terre foliée mercurielle. M. Gebaver a fait mention en 1748, de cette combinaison; elle a été décrite par MM. Hellot, Margraff, Baumé, Navier, Monnet, Wenzel: c'est le fameux reméde anti-vénérien de Keyser. | ||
| La chaux d'antimoine. | |||
| La chaux d'argent. | Inconnue des anciens, décrite par MM. Margraff, Monnet & Wenzel. | ||
| La chaux d'or. | Cette combinaison est peu connue, Schroëder & Juncker en ont fait mention. | ||
| La chaux de platine. | Cette combinaison est inconnue. | ||
| L'alumine. | Le vinaigre ne dissout, comme s'en est assuré M. Wenzel, que très-peu d'alumine. | ||
* Les anciens Chimistes n'ont guère connu de ces sels que l'acétite de potasse, celui de soude, celui d'ammoniaque, celui de cuivre & celui de plomb; la découverte de l'acétite d'arsenic est due à M. Cadet, (voyez tome III des Savans Etrangers.) On doit principalement à M. Wenzel, aux Académiciens de Dijon, à M. de Lassonne & à M. Proust, la connoissance que nous avons des propriétés des autres acétites. Il seroit possible que le radical acéteux, outre l'hydrogène & le carbone, contînt encore un peu d'azote. Il y a lieu de le soupçonner d'après la propriété qu'a l'acétite de potasse de donner de l'ammoniaque par la distillation, à moins cependant que l'azote qui concoure à la formation de cette ammoniaque, ne soit dû à la décomposition de la potasse elle-même.
OBSERVATIONS
Sur le Radical acéteux oxygéné par un premier degré d'oxygénation, ou Acide acéteux, & sur ses combinaisons avec les bases salifiables.
Le radical acéteux est composé de la réunion du carbone & de l'hydrogène portés à l'état d'acide par l'addition de l'oxygène. Cet acide est par conséquent composé des mêmes principes que l'acide tartareux, que l'acide oxalique, que l'acide citrique, que l'acide malique, &c. mais la proportion des principes est différente pour chacun de ces acides, & il paroît que l'acide acéteux est le plus oxygéné de tous. J'ai quelques raisons de croire qu'il contient aussi un peu d'azote, & que ce principe qui n'existe pas dans les autres acides végétaux que je viens de nommer, si ce n'est peut-être dans l'acide tartareux, est une des causes qui le différencie. Pour produire l'acide acéteux ou vinaigre, on expose le vin à une température douce, en y ajoutant un ferment, qui consiste principalement dans la lie qui s'est précédemment séparée d'autre vinaigre pendant sa fabrication, ou dans d'autres matières de 296 même nature. La partie spiritueuse du vin (le carbone & l'hydrogène) s'oxygènent dans cette opération, c'est par cette raison qu'elle ne peut se faire qu'à l'air libre, & qu'elle est toujours accompagnée d'une diminution du volume de l'air. Il faut en conséquence, pour faire de bon vinaigre, que le tonneau dans lequel on opère ne soit qu'à moitié plein. L'acide qui se forme ainsi est très-volatil; il est étendu d'une très-grande quantité d'eau & mêlé de beaucoup de substances étrangères. Pour l'avoir pur on le distille à une chaleur douce, dans des vaisseaux de grès ou de verre: mais ce qui paroît avoir échappé aux Chimistes, c'est que l'acide acéteux change de nature dans cette opération; l'acide qui passe dans la distillation, n'est pas exactement de même nature que celui qui reste dans l'alambic; ce dernier paroîtroit être plus oxygéné.
La distillation ne suffit pas pour débarrasser l'acide acéteux du phlegme étranger qui s'y trouve mêlé; le meilleur moyen de le concentrer sans en altérer la nature, consiste à l'exposer à un froid de quatre ou six degrés au-dessous de la congellation: la partie aqueuse gèle, & l'acide reste liquide. Il paroît que l'acide acéteux libre de toute combinaison, est naturellement dans l'état de gaz, au degré de 297 température & de pression dans lequel nous vivons, & que nous ne pouvons le retenir qu'en le combinant avec une grande quantité d'eau.
Il est d'autres procédés plus chimiques pour obtenir l'acide acéteux: ils consistent à oxygéner l'acide du tartre, l'acide oxalique ou l'acide malique par l'acide nitrique; mais il y a lieu de croire que la proportion des bases qui composent le radical, change dans cette opération. Au surplus M. Hassenfratz est occupé dans ce moment à répéter les expériences d'après lesquelles on a prétendu établir la possibilité de ces conversions.
La combinaison de l'acide acéteux avec les différentes bases salifiables, se fait avec assez de facilité; mais la plupart des sels qui en résultent ne sont pas cristallisables; à la différence des sels formés par l'acide tartareux & l'acide oxalique, qui sont en général peu solubles. Le tartrite & l'oxalate de chaux ne le sont pas même sensiblement. Les malates tiennent un espèce de milieu entre les oxalates & les acétates pour la solubilité, comme l'acide qui les forme en tient un pour le degré d'oxigénation.
Il faut, comme pour tous les autres acides, que les métaux soient oxygénés, pour pouvoir être dissous dans l'acide acéteux.
298
Tableau des combinaisons du Radical acéteux oxygéné par un second degré d'oxygénation, ou Acide acétique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | Observation. | |||
| Combinaisons de l'acide acétique avec: | La baryte. | Acétate de baryte. | Tous ces sels étoient inconnus des anciens, & même aujourd'hui, les Chimistes qui sont les plus au courant des découvertes modernes, ne peuvent pas prononcer avec certitude, si la plupart des sels acéteux doivent être rangés dans la classe des acétites ou des acétates. | ||
| La potasse. | Acétate de potasse. | ||||
| La soude. | Acétate de soude. | ||||
| La chaux. | Acétate de chaux. | ||||
| La magnésie. | Acétate de magnésie. | ||||
| L'ammoniaque. | Acétate d'ammoniaque. | ||||
| L'oxide de zinc. | Acétate de zinc. | ||||
| L'oxide de manganèse. | Acétate de manganèse. | ||||
| L'oxide de fer. | Acétate de fer. | ||||
| L'oxide de plomb. | Acétate de plomb. | ||||
| L'oxide d'étain. | Acétate d'étain. | ||||
| L'oxide de cobalt. | Acétate de cobalt. | ||||
| L'oxide de cuivre. | Acétate de cuivre. | ||||
| L'oxide de nickel. | Acétate de nickel. | ||||
| L'oxide d'arsenic. | Acétate d'arsenic. | ||||
| L'oxide de bismuth. | Acétate de bismuth. | ||||
| L'oxide de mercure. | Acétate de mercure. | ||||
| L'oxide d'antimoine. | Acétate d'antimoine. | ||||
| L'oxide d'argent. | Acétate d'argent. | ||||
| L'oxide d'or. | Acétate d'or. | ||||
| L'oxide de platine. | Acétate de platine. | ||||
| L'alumine. | Acétate d'alumine. | ||||
299
OBSERVATIONS
Sur l'Acide acétique, & sur le Tableau de ses combinaisons.
Nous avons donné au vinaigre radical le nom d'acide acétique, parce que nous avons supposé qu'il étoit plus chargé d'oxygène que le vinaigre ou acide acéteux. Dans cette supposition, le vinaigre radical ou acide acétique seroit le dernier degré d'oxygénation que puisse prendre le radical hydro-carboneux; mais quelque probable que soit cette conséquence, elle demande à être confirmée par des expériences plus décisives. Quoi qu'il en soit, pour préparer le vinaigre radical, on prend de l'acétite de potasse, qui est une combinaison d'acide acéteux & de potasse, ou de l'acétite de cuivre, qui est une combinaison du même acide avec du cuivre; on verse dessus un tiers de son poids d'acide sulfurique concentré, & par la distillation on obtient un vinaigre très-concentré, qu'on nomme vinaigre radical ou acide acétique. Mais, comme je viens de l'indiquer, il n'est point encore rigoureusement démontré que cet acide soit plus oxygéné que l'acide acéteux ordinaire, ni même qu'il n'en differe pas par la différence de proportion des principes du radical.
300
Tableau des combinaisons du Radical succinique oxygéné, ou Acide succinique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide succinique avec: | La baryte. | Succinate de baryte. | |
| La chaux. | Succinate de chaux. | ||
| La potasse. | Succinate de potasse. | ||
| La soude. | Succinate de soude. | ||
| L'ammoniaque. | Succinate d'ammoniaque. | ||
| La magnésie. | Succinate de magnésie. | ||
| L'alumine. | Succinate d'alumine. | ||
| L'oxide de zinc. | Succinate de zinc. | ||
| L'oxide de fer. | Succinate de fer. | ||
| L'oxide de manganèse. | Succinate de manganèse. | ||
| L'oxide de cobalt. | Succinate de cobalt. | ||
| L'oxide de nickel. | Succinate de nickel. | ||
| L'oxide de plomb. | Succinate de plomb. | ||
| L'oxide d'étain. | Succinate d'étain. | ||
| L'oxide de cuivre. | Succinate de cuivre. | ||
| L'oxide de bismuth. | Succinate de bismuth. | ||
| L'oxide d'antimoine. | Succinate d'antimoine. | ||
| L'oxide d'arsenic. | Succinate d'arsenic. | ||
| L'oxide de mercure. | Succinate de mercure. | ||
| L'oxide d'argent. | Succinate d'argent. | ||
| L'oxide d'or. | Succinate d'or. | ||
| L'oxide de platine. | Succinate de platine. | ||
Nota. Toutes ces combinaisons étoient inconnues aux anciens Chimistes.
301
OBSERVATIONS
Sur l'Acide succinique, & sur le Tableau de ses combinaisons.
L'Acide succinique se retire du succin, karabé ou ambre jaune, par distillation. Il suffit de mettre cette substance dans une cornue, & de donner une chaleur douce; l'acide succinique se sublime sous forme concrète dans le col de la cornue. Il faut éviter de pousser trop loin la distillation, pour ne pas faire passer l'huile. L'opération finie, on met le sel égoutter sur du papier gris; après quoi on le purifie par des dissolutions & cristallisations répétées.
Cet acide exige 24 parties d'eau froide pour être tenu en dissolution, mais il est beaucoup plus dissoluble dans l'eau chaude; il n'altère que foiblement les teintures bleues végétales, & il n'a pas dans un degré très-éminent les qualités d'acide. M. de Morveau est le premier des Chimistes qui ait essayé de déterminer ses différentes affinités, & c'est d'après lui qu'elles sont indiquées dans le Tableau joint à ces observations.
302
Tableau des combinaisons du Radical benzoïque oxygéné, ou Acide benzoïque, avec les différentes bases salifiables, rangées par ordre alphabétique.
| Noms des bases. | Noms des sels neutres. | ||
| Combinaisons de l'acide benzoïque avec: | L'alumine. | Benzoate d'alumine. | |
| L'ammoniaque. | Benzoate d'ammoniaque. | ||
| La baryte. | Benzoate de baryte. | ||
| La chaux. | Benzoate de chaux. | ||
| La magnésie. | Benzoate de magnésie. | ||
| La potasse. | Benzoate de potasse. | ||
| La soude. | Benzoate de soude. | ||
| L'oxide d'antimoine. | Benzoate d'antimoine. | ||
| L'oxide d'argent. | Benzoate d'argent. | ||
| L'oxide d'arsenic. | Benzoate d'arsenic. | ||
| L'oxide de bismuth. | Benzoate de bismuth. | ||
| L'oxide de cobalt. | Benzoate de cobalt. | ||
| L'oxide de cuivre. | Benzoate de cuivre. | ||
| L'oxide d'étain. | Benzoate d'étain. | ||
| L'oxide de fer. | Benzoate de fer. | ||
| L'oxide de manganèse. | Benzoate de manganèse. | ||
| L'oxide de mercure. | Benzoate de mercure. | ||
| L'oxide de molybdène. | Benzoate de molybdène. | ||
| L'oxide de nickel. | Benzoate de nickel. | ||
| L'oxide de plomb. | Benzoate de plomb. | ||
| L'oxide de tungstène. | Benzoate de tungstène. | ||
| L'oxide de zinc. | Benzoate de zinc. | ||
Nota. Toutes ces combinaisons étoient inconnues aux anciens Chimistes, & même encore aujourd'hui, on n'a rien de satisfaisant encore sur les propriétés de l'acide benzoïque & sur ses affinités.
303
OBSERVATIONS
Sur l'Acide benzoïque, & sur le Tableau de ses combinaisons avec les bases salifiables.
Cet acide a été connu des anciens Chimistes, sous le nom de fleurs de benjoin; on l'obtenoit par voie de sublimation. Depuis, M. Geoffroy a découvert qu'on pouvoit, également l'extraire par la voie humide: enfin M. Schéele, d'après un grand nombre d'expériences qu'il a faites sur le benjoin, s'est arrêté au procédé qui suit. On prend de bonne eau de chaux, dans laquelle même il est avantageux de laisser de la chaux en excès; on la fait digérer portion par portion sur du benjoin réduit en poudre fine, en remuant continuellement le mêlange. Après une demi-heure de digestion, on décante & on remet de nouvelle eau de chaux, & ainsi plusieurs fois, jusqu'à ce qu'on s'apperçoive que l'eau de chaux ne se neutralise plus. On rassemble toutes les liqueurs, on les rapproche par évaporation; & quand elles sont réduites autant qu'elles le peuvent être sans cristalliser, on laisse refroidir: on verse de l'acide muriatique goutte à goutte, jusqu'à ce qu'il ne se fasse plus de précipité. La substance qu'on obtient par ce procédé, est l'acide benzoïque concret.
304
Tableau des combinaisons du Radical camphorique oxygéné, ou Acide camphorique, avec les bases salifiables, par ordre alphabétique.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide camphorique avec: | L'alumine. | Camphorate d'alumine. | |
| L'ammoniaque. | Camphorate d'ammoniaque. | ||
| L'oxide d'antimoine. | Camphorate d'antimoine. | ||
| L'oxide d'argent. | Camphorate d'argent. | ||
| L'oxide d'arsenic. | Camphorate d'arsenic. | ||
| La baryte. | Camphorate de baryte. | ||
| L'oxide de bismuth. | Camphorate de bismuth. | ||
| La chaux. | Camphorate de chaux. | ||
| L'oxide de cobalt. | Camphorate de cobalt. | ||
| L'oxide de cuivre. | Camphorate de cuivre. | ||
| L'oxide d'étain. | Camphorate d'étain. | ||
| L'oxide de fer. | Camphorate de fer. | ||
| La magnésie. | Camphorate de magnésie. | ||
| L'oxide de manganèse. | Camphorate de manganèse. | ||
| L'oxide de mercure. | Camphorate de mercure. | ||
| L'oxide de nickel. | Camphorate de nickel. | ||
| L'oxide d'or. | Camphorate d'or. | ||
| L'oxide de platine. | Camphorate de platine. | ||
| L'oxide de plomb. | Camphorate de plomb. | ||
| La potasse. | Camphorate de potasse. | ||
| La soude. | Camphorate de soude. | ||
| L'oxide de zinc. | Camphorate de zinc. | ||
Nota. Toutes ces combinaisons étoient inconnues aux anciens Chimistes.
305
OBSERVATIONS
Sur l'Acide camphorique, & sur le Tableau de ses combinaisons.
Le camphre est une espèce d'huile essentielle concrète, qu'on retire par sublimation d'un laurier qui croît à la Chine & au Japon. M. Kosegarten a distillé jusqu'à huit fois de l'acide nitrique sur du camphre, & il est parvenu ainsi à l'oxygéner & à le convertir en un acide très-analogue à l'acide oxalique. Il en differe cependant à quelques égards, & c'est ce qui nous a déterminé à lui conserver, jusqu'à nouvel ordre, un nom particulier.
Le camphre étant un radical carbone-hydreux ou hydro-carboneux, il n'est pas étonnant qu'en l'oxygénant il forme de l'acide oxalique, de l'acide malique & plusieurs autres acides végétaux. Les expériences rapportées par M. Kosegarten, ne démentent pas cette conjecture, & la plus grande partie des phénomènes qu'il a observés dans la combinaison de cet acide avec les bases salifiables s'observent de même dans les combinaisons de l'acide oxalique ou de l'acide malique; je serois donc assez porté à regarder l'acide camphorique comme un mêlange d'acide oxalique & d'acide malique.
306
Tableau des combinaisons du Radical gallique oxygéné, ou Acide gallique, avec les bases salifiables rangées par ordre alphabétique.
| Noms des bases. | Noms des sels neutres. |
| Nomenclature nouvelle. | |
| L'alumine. | Gallate d'alumine. |
| L'ammoniaque. | Gallate d'ammoniaque. |
| L'oxide d'antimoine. | Gallate d'antimoine. |
| L'oxide d'argent. | Gallate d'argent. |
| L'oxide d'arsenic. | Gallate d'arsenic. |
| La baryte. | Gallate de baryte. |
| L'oxide de bismuth. | Gallate de bismuth. |
| La chaux. | Gallate de chaux. |
| L'oxide de cobalt. | Gallate de cobalt. |
| L'oxide de cuivre. | Gallate de cuivre. |
| L'oxide d'étain. | Gallate d'étain. |
| L'oxide de fer. | Gallate de fer. |
| La magnésie. | Gallate de magnésie. |
| L'oxide de manganèse. | Gallate de manganèse. |
| L'oxide de mercure. | Gallate de mercure. |
| L'oxide de nickel. | Gallate de nickel. |
| L'oxide d'or. | Gallate d'or. |
| L'oxide de platine. | Gallate de platine. |
| L'oxide de plomb. | Gallate de plomb. |
| La potasse. | Gallate de potasse. |
| La soude. | Gallate de soude. |
| L'oxide de zinc. | Gallate de zinc. |
Nota. Toutes ces combinaisons ont été inconnues aux anciens Chimistes.
307
OBSERVATIONS
Sur l'Acide gallique, & sur le Tableau de ses combinaisons.
L'acide gallique ou principe astringent se tire de la noix de galle, soit par la simple infusion ou décoction dans l'eau, soit par une distillation à un feu très-doux. Ce n'est que depuis un très petit nombre d'années qu'on a donné une attention plus particulière à cette substance. MM. les Commissaires de l'Académie de Dijon en ont suivi toutes les combinaisons & ont donné le travail le plus complet qu'on eût fait jusqu'alors. Quoique les propriétés acides de ce principe ne soient pas très-marquées, il rougit la teinture de tournesol, il décompose les sulfures, il s'unit à tous les métaux, quand ils ont été préalablement dissous par un autre acide, & il les précipite sous différentes couleurs. Le fer, par cette combinaison, donne un précipité d'un bleu ou d'un violet foncé. Cet acide, si toutefois il mérite ce nom, se trouve dans un grand nombre de végétaux, tels que le chêne, le saule, l'iris des marais, le fraisier, le nimphea, le quinquina, l'écorce & la fleur de grenade, & dans beaucoup de bois & d'écorces. On ignore absolument quel est son radical.
308
Tableau des combinaisons du Radical lactique oxygéné, ou Acide lactique, avec les bases salifiables, par ordre alphabétique.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Nomenclature nouvelle. | |||
| Combinaisons de l'acide lactique avec: | L'alumine. | Lactate d'alumine. | |
| L'ammoniaque. | Lactate d'ammoniaque. | ||
| L'oxide d'antimoine. | Lactate d'antimoine. | ||
| L'oxide d'argent. | Lactate d'argent. | ||
| L'oxide d'arsenic. | Lactate d'arsenic. | ||
| La baryte. | Lactate de baryte. | ||
| L'oxide de bismuth. | Lactate de bismuth. | ||
| La chaux. | Lactate de chaux. | ||
| L'oxide de cobalt. | Lactate de cobalt. | ||
| L'oxide de cuivre. | Lactate de cuivre. | ||
| L'oxide d'étain. | Lactate d'étain. | ||
| L'oxide de fer. | Lactate de fer. | ||
| L'oxide de manganèse. | Lactate de manganèse. | ||
| L'oxide de mercure. | Lactate de mercure. | ||
| L'oxide de nickel. | Lactate de nickel. | ||
| L'oxide d'or. | Lactate d'or. | ||
| L'oxide de platine. | Lactate de platine. | ||
| L'oxide de plomb. | Lactate de plomb. | ||
| La potasse. | Lactate de potasse. | ||
| La soude. | Lactate de soude. | ||
| L'oxide de zinc. | Lactate de zinc. | ||
Nota. Toutes ces combinaisons ont été inconnues aux anciens Chimistes.
309
OBSERVATIONS
Sur l'Acide lactique, & sur le Tableau de ses combinaisons.
M. Schéele est celui auquel nous devons les seules connoissances exactes que nous ayons sur l'acide lactique. Cet acide se rencontre dans le petit lait, & il y est uni à un peu de terre. Pour l'obtenir on fait réduire par évaporation du petit lait au huitième de son volume; on filtre pour bien séparer toute la partie caseuse; on ajoute de la chaux, qui s'empare de l'acide dont il est question & qu'on en dégage ensuite par l'addition de l'acide oxalique: on sait en effet que ce dernier acide forme avec la chaux un sel insoluble. Après que l'oxalate de chaux a été séparé par décantation, on évapore la liqueur jusqu'à consistance de miel; on ajoute de l'esprit-de-vin qui dissout l'acide, & on filtre pour en séparer le sucre de lait & les autres substances étrangères. Il ne reste plus ensuite, pour avoir l'acide lactique seul, que de chasser l'esprit-de-vin par évaporation ou par distillation.
Cet acide s'unit avec presque toutes les bases salifiables, & forme avec elles des sels incristallisables. Il paroît se rapprocher, à beaucoup d'égards, de l'acide acéteux.
310
Tableau des combinaisons du Radical saccholactique oxygéné, ou Acide saccholactique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Nomenclature nouvelle. | |||
| Combinaisons de l'acide saccholactique avec: | La chaux. | Saccholate de chaux. | |
| La baryte. | Saccholate de baryte. | ||
| La magnésie. | Saccholate de magnésie. | ||
| La potasse. | Saccholate de potasse. | ||
| La soude. | Saccholate de soude. | ||
| L'ammoniaque. | Saccholate d'ammoniaque. | ||
| L'alumine. | Saccholate d'alumine. | ||
| L'oxide de zinc. | Saccholate de zinc. | ||
| L'oxide de manganèse. | Saccholate de manganèse. | ||
| L'oxide de fer. | Saccholate de fer. | ||
| L'oxide de plomb. | Saccholate de plomb. | ||
| L'oxide d'étain. | Saccholate d'étain. | ||
| L'oxide de cobalt. | Saccholate de cobalt. | ||
| L'oxide de cuivre. | Saccholate de cuivre. | ||
| L'oxide de nickel. | Saccholate de nickel. | ||
| L'oxide d'arsenic. | Saccholate d'arsenic. | ||
| L'oxide de bismuth. | Saccholate de bismuth. | ||
| L'oxide de mercure. | Saccholate de mercure. | ||
| L'oxide d'antimoine. | Saccholate d'antimoine. | ||
| L'oxide d'argent. | Saccholate d'argent. | ||
Nota. Toutes ces combinaisons ont été inconnues des anciens Chimistes.
311
OBSERVATIONS
Sur l'Acide saccholactique, & sur le Tableau de ses combinaisons.
On peut extraire du petit lait par évaporation, une espèce de sucre qui a beaucoup de rapports avec celui des cannes à sucre, & qui est très-anciennement connu dans la pharmacie.
Ce sucre est susceptible, comme le sucre ordinaire, de s'oxygéner par différens moyens, & principalement par sa combinaison avec l'acide nitrique: on repasse à cet effet plusieurs fois de nouvel acide; on concentre ensuite la liqueur par évaporation; on met à cristalliser & on obtient de l'acide oxalique: en même tems il se sépare une poudre blanche très-fine, qui est susceptible de se combiner avec les alkalis, avec l'ammoniaque, avec les terres, même avec quelques métaux. C'est à cet acide concret découvert par Schéele, qu'on a donné le nom d'acide saccho-lactique. Son action sur les métaux est peu connue; on sait seulement qu'il forme avec eux des sels très-peu solubles. L'ordre des affinités qu'on a suivi dans le Tableau, est celui indiqué par M. Bergman.
312
Tableau des combinaisons du Radical formique oxigéné, ou Acide formique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Nomenclature nouvelle. | |||
| Combinaisons de l'acide formique avec: | La baryte. | Formiate de baryte. | |
| La potasse. | Formiate de potasse. | ||
| La soude. | Formiate de soude. | ||
| La chaux. | Formiate de chaux. | ||
| La magnésie. | Formiate de magnésie. | ||
| L'ammoniaque. | Formiate d'ammoniaque. | ||
| L'oxide de zinc. | Formiate de zinc. | ||
| L'oxide de manganèse. | Formiate de manganèse. | ||
| L'oxide de fer. | Formiate de fer. | ||
| L'oxide de plomb. | Formiate de plomb. | ||
| L'oxide d'étain. | Formiate d'étain. | ||
| L'oxide de cobalt. | Formiate de cobalt. | ||
| L'oxide de cuivre. | Formiate de cuivre. | ||
| L'oxide de nickel. | Formiate de nickel. | ||
| L'oxide de bismuth. | Formiate de bismuth. | ||
| L'oxide d'argent. | Formiate d'argent. | ||
| L'alumine. | Formiate d'alumine. | ||
Nota. Toutes ces combinaisons ont été inconnues des anciens Chimistes.
313
OBSERVATIONS
Sur l'Acide formique, & sur le Tableau de ses combinaisons.
L'Acide formique a été connu dès le siècle dernier. Samuel Ficher est le premier qui l'ait obtenu en distillant des fourmis. M. Margraff a suivi ce même objet dans un Mémoire qu'il a publié en 1749, & MM. Ardwisson & OEhrn, dans une dissertation qu'ils ont publiée à Léipsic en 1777.
L'acide formique se tire d'une grosse espèce de fourmi rousse, formica rufa, qui habite les bois & qui y forme de grandes fourmillières. Si c'est par distillation qu'on veut opérer, on introduit les fourmis dans une cornue de verre ou dans une cucurbite garnie de son chapiteau; on distille à une chaleur douce, & on trouve l'acide formique dans le récipient: on en tire environ moitié du poids des fourmis.
Lorsqu'on veut procéder par voie de lixiviation, on lave les fourmis à l'eau froide, on les étend sur un linge, & on y passe de l'eau bouillante, qui se charge de la partie acide; on peut même exprimer légèrement ces insectes dans le linge, & l'acide en est plus fort. Pour l'obtenir pur & concentré, on le rectifie & on en sépare le phlegme par la gelée.
314
Tableau des combinaisons du Radical bombique oxygéné, ou Acide bombique, avec les substances salifiables, par ordre alphabétique.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Nomenclature nouvelle. | |||
| Combinaisons de l'acide bombique avec: | L'alumine. | Bombiate d'alumine. | |
| L'ammoniaque. | Bombiate d'ammoniaque. | ||
| L'oxide d'antimoine. | Bombiate d'antimoine. | ||
| L'oxide d'argent. | Bombiate d'argent. | ||
| L'oxide d'arsenic. | Bombiate d'arsenic. | ||
| La baryte. | Bombiate de baryte. | ||
| L'oxide de bismuth. | Bombiate de bismuth. | ||
| La chaux. | Bombiate de chaux. | ||
| L'oxide de cobalt. | Bombiate de cobalt. | ||
| L'oxide de cuivre. | Bombiate de cuivre. | ||
| L'oxide d'étain. | Bombiate d'étain. | ||
| L'oxide de fer. | Bombiate de fer. | ||
| L'oxide de manganèse. | Bombiate de manganèse. | ||
| La magnésie. | Bombiate de magnésie. | ||
| L'oxide de mercure. | Bombiate de mercure. | ||
| L'oxide de nickel. | Bombiate de nickel. | ||
| L'oxide d'or. | Bombiate d'or. | ||
| L'oxide de platine. | Bombiate de platine. | ||
| L'oxide de plomb. | Bombiate de plomb. | ||
| La potasse. | Bombiate de potasse. | ||
| La soude. | Bombiate de soude. | ||
| L'oxide de zinc. | Bombiate de zinc. | ||
Nota. Toutes ces combinaisons ont été inconnues aux anciens Chimistes.
315
OBSERVATIONS
Sur l'Acide bombique, & sur le Tableau de ses combinaisons.
Lorsque le ver à soie se change en crisalide, ses humeurs paroissent prendre un caractère d'acidité. Il laisse même échapper au moment où il se transforme en papillon, une liqueur rousse très-acide, qui rougit le papier bleu, & qui a fixé l'attention de M. Chaussier, membre de l'Académie de Dijon. Après plusieurs tentatives pour obtenir cet acide pur, voici le procédé auquel il a cru devoir s'arrêter. On fait infuser des crisalides de vers à soie dans de l'alcohol: ce dissolvant se charge de l'acide, sans attaquer les parties muqueuses ou gommeuses; & en faisant évaporer l'esprit-de-vin, on a l'acide bombique assez pur. On n'a pas encore déterminé avec précision les propriétés & les affinités de cet acide. Il y a apparence que la famille des insectes en fourniroit beaucoup d'analogues. Son radical, ainsi que celui de tous les acides du règne animal, paroît être composé de carbone, d'hydrogène, d'azote & peut-être de phosphore.
316
Tableau des combinaisons du Radical sébacique oxygéné, ou Acide sébacique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Nomenclature nouvelle. | |||
| Combinaisons de l'acide sébacique avec: | La baryte. | Sébate de baryte. | |
| La potasse. | Sébate de potasse. | ||
| La soude. | Sébate de soude. | ||
| La chaux. | Sébate de chaux. | ||
| La magnésie. | Sébate de magnésie. | ||
| L'ammoniaque. | Sébate d'ammoniaque. | ||
| L'alumine. | Sébate d'alumine. | ||
| L'oxide de zinc. | Sébate de zinc. | ||
| L'oxide de manganèse. | Sébate de manganèse. | ||
| L'oxide de fer. | Sébate de fer. | ||
| L'oxide de plomb. | Sébate de plomb. | ||
| L'oxide d'étain. | Sébate d'étain. | ||
| L'oxide de cobalt. | Sébate de cobalt. | ||
| L'oxide de cuivre. | Sébate de cuivre. | ||
| L'oxide de nickel. | Sébate de nickel. | ||
| L'oxide d'arsenic. | Sébate d'arsenic. | ||
| L'oxide de bismuth. | Sébate de bismuth. | ||
| L'oxide de mercure. | Sébate de mercure. | ||
| L'oxide d'antimoine. | Sébate d'antimoine. | ||
| L'oxide d'argent. | Sébate d'argent. | ||
Nota. Toutes ces combinaisons ont été inconnues aux anciens Chimistes.
317
OBSERVATIONS
Sur l'Acide sébacique, & sur le Tableau de ses combinaisons.
Pour obtenir l'acide sébacique, on prend du suif qu'on fait fondre dans un poëlon de fer; on y jette de la chaux vive pulvérisée, & on remue continuellement. La vapeur qui s'élève du mêlange est très-piquante, & on doit tenir les vaisseaux élevés afin d'éviter de la respirer. Sur la fin on hausse le feu. L'acide sébacique dans cette opération se porte sur la chaux & forme du sébate calcaire, espèce de sel peu soluble: pour le séparer des parties grasses dont il est empâté, on fait bouillir à grande eau la masse; le sébate calcaire se dissout, le suif se fond & surnage. On sépare ensuite le sel en faisant évaporer l'eau, on le calcine à une chaleur modérée; on redissout, on fait cristalliser de nouveau & on parvient à l'avoir pur.
Pour obtenir l'acide libre, on verse de l'acide sulfurique sur le sébate de chaux ainsi purifié, & on distille; l'acide sébacique passe clair dans le récipient.
318
Tableau des combinaisons du Radical lithique oxygéné, ou Acide lithique, avec les bases salifiables, rangées par ordre alphabétique.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide lithique avec: | L'alumine. | Lithiate d'alumine. | |
| L'ammoniaque. | Lithiate d'ammoniaque. | ||
| L'oxide d'antimoine. | Lithiate d'antimoine. | ||
| L'oxide d'argent. | Lithiate d'argent. | ||
| L'oxide d'arsenic. | Lithiate d'arsenic. | ||
| La baryte. | Lithiate de baryte. | ||
| L'oxide de bismuth. | Lithiate de bismuth. | ||
| La chaux. | Lithiate de chaux. | ||
| L'oxide de cobalt. | Lithiate de cobalt. | ||
| L'oxide de cuivre. | Lithiate de cuivre. | ||
| L'oxide d'étain. | Lithiate d'étain. | ||
| L'oxide de fer. | Lithiate de fer. | ||
| La magnésie. | Lithiate de magnésie. | ||
| L'oxide de manganèse. | Lithiate de manganèse. | ||
| L'oxide de mercure. | Lithiate de mercure. | ||
| L'oxide de nickel. | Lithiate de nickel. | ||
| L'oxide d'or. | Lithiate d'or. | ||
| L'oxide de platine. | Lithiate de platine. | ||
| L'oxide de plomb. | Lithiate de plomb. | ||
| La potasse. | Lithiate de potasse. | ||
| La soude. | Lithiate de soude. | ||
| L'oxide de zinc. | Lithiate de zinc. | ||
Nota. Toutes ces combinaisons ont été inconnues aux anciens.
319
OBSERVATIONS
Sur l'Acide lithique, & sur le Tableau de ses combinaisons.
Le calcul de la vessie, d'après les dernières expériences de Bergman & de Schéele, paroîtroit être une espèce de sel concret à base terreuse, légèrement acide, qui demande une grande quantité d'eau pour être dissous. Mille grains d'eau bouillante en dissolvent à peine trois grains, & la majeure partie recristallise par le refroidissement. C'est cet acide concret auquel M. de Morveau a donné le nom d'acide lithiasique, & que nous nommons acide lithique. La nature & les propriétés de cet acide sont encore peu connues. Il y a quelqu'apparence que c'est un sel acidule déjà combiné à une base, & plusieurs raisons me portent à croire que c'est un phosphate acidule de chaux. Si cette présomption se confirme, il faudra le rayer de la classe des acides particuliers.
320
Tableau des combinaisons du Radical prussique oxygéné, ou Acide prussique, avec les bases salifiables, dans l'ordre de leur affinité avec cet acide.
| Noms des bases salifiables. | Noms des sels neutres. | ||
| Combinaisons de l'acide prussique avec: | La potasse. | Prussiate de potasse. | |
| La soude. | Prussiate de soude. | ||
| L'ammoniaque. | Prussiate d'ammoniaque. | ||
| La chaux. | Prussiate de chaux. | ||
| La baryte. | Prussiate de baryte. | ||
| La magnésie. | Prussiate de magnésie. | ||
| L'oxide de zinc. | Prussiate de zinc. | ||
| L'oxide de fer. | Prussiate de fer. | ||
| L'oxide de manganèse. | Prussiate de manganèse. | ||
| L'oxide de cobalt. | Prussiate de cobalt. | ||
| L'oxide de nickel. | Prussiate de nickel. | ||
| L'oxide de plomb. | Prussiate de plomb. | ||
| L'oxide d'étain. | Prussiate d'étain. | ||
| L'oxide de cuivre. | Prussiate de cuivre. | ||
| L'oxide de bismuth. | Prussiate de bismuth. | ||
| L'oxide d'antimoine. | Prussiate d'antimoine. | ||
| L'oxide d'arsenic. | Prussiate d'arsenic. | ||
| L'oxide d'argent. | Prussiate d'argent. | ||
| L'oxide de mercure. | Prussiate de mercure. | ||
| L'oxide d'or. | Prussiate d'or. | ||
| L'oxide de platine. | Prussiate de platine. | ||
Nota. Toutes ces combinaisons ont été inconnues aux anciens.
321
OBSERVATIONS
Sur l'Acide prussique, & sur le Tableau de ses combinaisons.
Je ne m'étendrai point ici sur les propriétés de l'acide prussique, ni sur les procédés qu'on emploie pour l'obtenir pur & dégagé de toute combinaison. Les expériences qui ont été faites à cet égard, me paroissent laisser encore quelques nuages sur la vraie nature de cet acide. Il me suffira de dire qu'il se combine avec le fer, & qu'il lui donne la couleur bleue; qu'il est également susceptible de s'unir avec presque tous les métaux, mais que les alkalis, l'ammoniaque & la chaux le leur enlèvent en vertu de leur plus grande force d'affinité. On ne connoît point le radical de l'acide prussique; mais les expériences de M. Schéele & sur-tout celles de M. Berthollet, donnent lieu de croire qu'il est composé de carbone & d'azote; c'est donc un acide à base double: quant à l'acide phosphorique qui s'y rencontre, il paroît, d'après les expériences de M. Hassenfratz, qu'il y est accidentel.
Quoique l'acide prussique s'unisse avec les 322 métaux, avec les alkalis & avec les terres, à la manière des acides, il n'a cependant qu'une partie des propriétés qu'on a coutume d'attribuer aux acides. Il seroit donc possible que ce fût improprement qu'on l'eût rangé dans cette classe. Mais, comme je l'ai déjà fait observer, il me paroît difficile de prendre une opinion déterminée sur la nature de cette substance, jusqu'à ce que la matière ait été éclaircie par de nouvelles expériences.
Fin du Tome premier.
TRAITÉ
ÉLÉMENTAIRE
DE CHIMIE.
TOME SECOND.
TRAITÉ
ÉLÉMENTAIRE
DE CHIMIE,
PRÉSENTÉ DANS UN ORDRE NOUVEAU
ET D'APRÈS LES DÉCOUVERTES MODERNES;
Avec Figures:
Par M. Lavoisier, de l'Académie des Sciences, de la Société Royale de Médecine, des Sociétés d'Agriculture de Paris & d'Orléans, de la Société Royale de Londres, de l'Institut de Bologne, de la Société Helvétique de Basle, de celles de Philadelphie, Harlem, Manchester, Padoue, &c.
TOME SECOND.

A PARIS,
Chez Cuchet, Libraire, rue & hôtel Serpente.
M. DCC. LXXXIX.
Sous le Privilège de l'Académie des Sciences & de la Société Royale de Médecine.
v
TABLE
DES CHAPITRES
DU TOME SECOND.
| TROISIEME PARTIE. Description des Appareils & des Opérations manuelles de la Chimie. |
|
| Introduction, | 323 |
| Chap. I. Des instrumens propres à déterminer le poids absolu & la pesanteur spécifique des corps solides & liquides, | 327 |
| Chap. II. De la Gazométrie, ou de la mesure du poids & du volume des substances aériformes, | 342 |
| §. I. Description des Appareils pneumato-chimiques, | ibid. |
| §. II. Du Gazomètre, | 346 |
| vj§. III. De quelques autres manières de mesurer le volume des Gaz, | 360 |
| §. IV. De la manière de séparer les unes des autres les différentes espèces de Gaz, | 365 |
| §. V. Des corrections à faire au volume des Gaz obtenus dans les expériences, relativement à la pression de l'atmosphère, | 370 |
| §. VI. Des corrections relatives aux différens degrés du Thermomètre, | 378 |
| §. VII. Modèle de calcul pour les corrections relatives au degré de pression & de température, | 380 |
| §. VIII. De la manière de déterminer le poids absolu des différens Gaz, | 384 |
| Chap. III. Des Appareils relatifs à la mesure du Calorique, | 387 |
| Description du Calorimètre, | ibid. |
| Chap. IV. Des opérations purement mécaniques qui ont pour objet de diviser les corps, | 403 |
| §. I. De la Trituration, de la Porphirisation, & de la Pulvérisation, | ibid. |
| §. II. Du Tamisage & du Lavage, | 409 |
| §. III. De la Filtration, | 412 |
| §. IV. De la Décantation, | 419 |
| vijChap. V. Des moyens que la Chimie emploie pour écarter les unes des autres les molécules des corps sans les décomposer, & réciproquement pour les réunir, | 422 |
| §. I. De la Solution des Sels, | 423 |
| §. II. De la Lixiviation, | 428 |
| §. III. De l'Evaporation, | 431 |
| §. IV. De la Cristallisation, | 436 |
| §. V. De la Distillation simple, | 442 |
| §. VI. De la Sublimation, | 448 |
| Chap. VI. Des Distillations pneumato-chimiques, des Dissolutions métalliques, & de quelques autres opérations qui exigent des Appareils très-compliqués, | 449 |
| §. I. Des Distillations composées, & des Distillations pneumato-chimiques, | 449 |
| §. II. Des dissolutions métalliques, | 458 |
| §. III. Des Appareils relatifs aux fermentations vineuse & putride, | 461 |
| §. IV. Appareil particulier pour la décomposition de l'eau, | 465 |
| §. V. De la préparation & de l'emploi des Luts, | 468 |
| viijChap. VII. Des Opérations relatives à la combustion proprement dite & à la détonation, | 478 |
| §. I. De la Combustion du Phosphore & du Charbon, | 482 |
| §. II. De la Combustion des Huiles, | 493 |
| §. III. De la Combustion de l'Esprit-de-vin ou Alkool, | 501 |
| §. IV. De la Combustion de l'Ether, | 503 |
| §. V. De la Combustion du Gaz hydrogène, & de la Formation de l'Eau, | 506 |
| §. VI. De l'Oxidation des Métaux, | 513 |
| §. VII. De la Détonation, | 524 |
| Chap. VIII. Des Instrumens nécessaires pour opérer sur les corps à de très-hautes températures, | 534 |
| §. I. De la Fusion, | ibid. |
| §. II. Des Fourneaux, | 537 |
| §. III. Des moyens d'augmenter considérablement l'action du feu, en substituant le gaz oxygène à l'air de l'atmosphère, | 552 |
| Tables a l'usage des Chimistes. | 559 |
| Table des matieres. | 592 |
| EXTRAIT des Registres de l'Académie Royale des Sciences. Du 4 Février 1789. | 620 |
| EXTRAIT des Registres de la Société Royale de Médecine. Du 6 Février 1789. | 629 |
| EXTRAIT des Registres de la Société Royale d'Agriculture. Du 5 Février 1789. | 650 |
| Errata. | 654 |
| Planches. | 656 |
323

TROISIÈME PARTIE.
Description des appareils & des opérations manuelles de la Chimie.
INTRODUCTION.
Ce n'est pas sans dessein que je ne me suis pas étendu davantage dans les deux premières parties de cet Ouvrage, sur les opérations manuelles de la Chimie. J'ai reconnu, d'après ma propre expérience, que des descriptions minutieuses, des détails de procédés & des explications de planches, figuroient mal dans un ouvrage de raisonnement; qu'elles interrompoient la marche des idées, & qu'elles rendoient la lecture de l'ouvrage fastidieuse & difficile.
D'un autre côté, si je m'en fusse tenu aux simples descriptions sommaires que j'ai données jusqu'ici, les commençans n'auroient pu prendre 324 dans cet Ouvrage que des idées très-vagues de la Chimie-pratique. Des opérations qu'il leur auroit été impossible de répéter, ne leur auroient inspiré ni confiance ni intérêt: ils n'auroient pas même eu la ressource de chercher dans d'autres ouvrages de quoi suppléer à ce qui auroit manqué à celui-ci. Indépendamment de ce qu'il n'en existe aucun où les expériences modernes se trouvent décrites avec assez d'étendue, il leur auroit été impossible de recourir à des traités où les idées n'auroient point été présentées dans le même ordre, où l'on n'auroit pas parlé le même langage; en sorte que le but d'utilité que je me suis proposé n'auroit pas été rempli.
J'ai pris, d'après ces réflexions, la résolution de réserver pour une troisième partie la description sommaire de tous les appareils & de toutes les opérations manuelles qui ont rapport à la Chimie élémentaire. J'ai préféré de placer ce traité particulier à la fin plutôt qu'au commencement de cet Ouvrage, parce qu'il m'auroit été impossible de n'y pas supposer des connoissances que les commençans ne peuvent avoir, & qu'ils ne peuvent acquérir que par la lecture de l'Ouvrage même. Toute cette troisième partie doit être en quelque façon considérée comme l'explication des figures qu'on a coutume de rejetter 325 à la fin des Mémoires, pour ne point en couper le texte par des descriptions trop étendues.
Quelque soin que j'aye pris pour mettre de la clarté & de la méthode dans cette partie de mon travail, & pour n'omettre la description d'aucun appareil essentiel, je suis loin de prétendre que ceux qui veulent prendre des connoissances exactes en Chimie, puissent se dispenser de suivre des cours, de fréquenter les laboratoires & de se familiariser avec les instrumens qu'on y emploie. Nihil est in intellectu quod non prius fuerit in sensu: grande & importante vérité que ne doivent jamais oublier ceux qui apprennent comme ceux qui enseignent, & que le célèbre Rouelle avoit fait tracer en gros caractères dans le lieu le plus apparent de son laboratoire.
Les opérations chimiques se divisent naturellement en plusieurs classes, suivant l'objet qu'elles se proposent de remplir: les unes peuvent être regardées comme purement mécaniques; telle est la détermination du poids des corps, la mesure de leur volume, la trituration, la porphyrisation, le tamisage, le lavage, la filtration: les autres sont des opérations véritablement chimiques, parce qu'elles emploient des forces & des agens chimiques, telles que la dissolution, la fusion, &c. Enfin les unes 326 ont pour objet de séparer les principes des corps, les autres de les réunir; souvent même elles ont ce double but, & il n'est pas rare que dans une même opération, comme dans la combustion, par exemple, il y ait à la fois décomposition & recomposition.
Sans adopter particulièrement aucune de ces divisions, auxquelles il seroit difficile de s'astreindre, du moins d'une manière rigoureuse, je vais présenter le détail des opérations chimiques, dans l'ordre qui m'a paru le plus propre à en faciliter l'intelligence. J'insisterai particulièrement sur les appareils relatifs à la Chimie moderne, parce qu'ils sont encore peu connus, même de ceux qui font une étude particulière de cette science, je pourrois presque dire, d'une partie de ceux qui la professent.

327
CHAPITRE PREMIER.
Des instrumens propres à déterminer le poids absolu & la pesanteur spécifique des corps solides & liquides.
On ne connoît jusqu'à présent aucun meilleur moyen pour déterminer les quantités de matières qu'on emploie dans les opérations chimiques, & celles qu'on obtient par le résultat des expériences, que de les mettre en équilibre avec d'autres corps qu'on est convenu de prendre pour terme de comparaison. Lors, par exemple, que nous voulons allier ensemble douze livres de plomb & six livres d'étain, nous nous procurons un levier de fer assez fort pour qu'il ne fléchisse pas; nous le suspendons dans son milieu & de manière que ses deux bras soient parfaitement égaux; nous attachons à l'une de ses extrêmités un poids de douze livres; nous attachons à l'autre du plomb, & nous en ajoutons jusqu'à ce qu'il y ait équilibre, c'est-à-dire jusqu'à ce que le levier demeure parfaitement horisontal. Après avoir ainsi opéré sur le plomb, on opère sur l'étain; & on en use de la même manière pour toutes les autres matières dont on veut déterminer la 328 quantité. Cette opération se nomme peser; l'instrument dont on se sert se nomme balance: il est principalement composé, comme tout le monde le sait, d'un fléau, de deux bassins & d'une aiguille.
Quant au choix des poids & à la quantité de matière qui doit composer une unité, une livre, par exemple, c'est une chose absolument arbitraire; aussi voyons-nous que la livre differe d'un royaume à un autre, d'une province & souvent même d'une ville à une autre. Les sociétés n'ont même d'autre moyen de conserver l'unité qu'elles se sont choisie, & d'empêcher qu'elle ne varie & ne s'altère par la révolution des tems, qu'en formant ce qu'on nomme des étalons, qui sont déposés & soigneusement conservés dans les greffes des jurisdictions.
Il n'est point indifférent sans doute dans le commerce & pour les usages de la société, de se servir d'une livre ou d'une autre, puisque la quantité absolue de matière n'est pas la même, & que les différences même sont très-considérables. Mais il n'en est pas de même pour les Physiciens & pour les Chimistes. Peu importe dans la plupart des expériences, qu'ils ayent employé une quantité A ou une quantité B de matière, pourvu qu'ils expriment clairement les produits qu'ils ont obtenus de l'une ou de l'autre 329 de ces quantités, en fractions d'un usage commode, & qui réunies toutes ensemble fassent un produit égal au tout. Ces considérations m'ont fait penser qu'en attendant que les hommes, réunis en société, se soient déterminés à n'adopter qu'un seul poids & qu'une seule mesure, les Chimistes, de toutes les parties du monde, pourroient sans inconvénient se servir de la livre de leur pays, quelle qu'elle fût, pourvu qu'au lieu de la diviser, comme on l'a fait jusqu'ici, en fractions arbitraires, on se déterminât par une convention générale à la diviser en dixièmes, en centièmes, en millièmes, en dix-millièmes, &c. c'est-à-dire, en fractions décimales de livres. On s'entendroit alors dans tous les pays, comme dans toutes les langues: on ne seroit pas sûr, il est vrai, de la quantité absolue de matière qu'on auroit employée dans une expérience; mais on connoîtroit sans difficulté, sans calcul, le rapport des produits entr'eux; ces rapports seroient les mêmes pour les savans du monde entier, & l'on auroit véritablement pour cet objet un langage universel.
Frappé de ces considérations, j'ai toujours eu le projet de faire diviser la livre poids de marc en fractions décimales, & ce n'est que depuis peu que j'y suis parvenu. 330 M. Fourché, Balancier, successeur de M. Chemin, rue de la Ferronnerie, a rempli cet objet avec beaucoup d'intelligence & d'exactitude, & j'invite tous ceux qui s'occupent d'expériences, à se procurer de semblables divisions de la livre: pour peu qu'ils ayent d'usage du calcul des décimales, ils seront étonnés de la simplicité & de la facilité que cette division apportera dans toutes leurs opérations. Je détaillerai dans un Mémoire particulier destiné pour l'Académie, les précautions & les attentions que cette division de la livre exige.
En attendant que cette méthode soit adoptée par les savans de tous les pays, il est un moyen simple, sinon d'atteindre au même but, au moins d'en approcher & de simplifier les calculs. Il consiste à convertir à chaque pesée les onces, gros & grains qu'on a obtenus, en fractions décimales de livre; & pour diminuer la peine que ce calcul pourroit présenter, j'ai formé une table où ces calculs se trouvent tous faits ou au moins réduits à de simples additions. Elle se trouve à la fin de cette troisième partie: voici la manière de s'en servir.
Je suppose qu'on ait employé dans une expérience 4 livres de matières, & que par le résultat de l'opération on ait obtenu quatre produits différens A, B, C, D, pesant savoir,
331
| liv. | onc. | gros | grains. | |
| Produit A | 2 | 5 | 3 | 63 |
| Produit B | 1 | 2 | 7 | 15 |
| Produit C | » | 3 | 1 | 37 |
| Produit D | » | 4 | 3 | 29 |
| Total | 4 | » | » | » |
On transformera, au moyen de la table, ces fractions vulgaires en décimales, comme il suit:
| Pour le produit A. | |||||||
| Fractions vulgaires. | Fractions décimales correspondantes. | ||||||
| liv. | onc. | gros | gr. | = | liv. | ||
| 2 | » | » | » | = | 2,0000000 | ||
| 5 | » | » | = | 0,3125000 | |||
| 3 | » | = | 0,0234375 | ||||
| 63 | = | 0,0068359 | |||||
| Total | 2 | 5 | 3 | 63 | = | 2,3427734 | |
| Pour le produit B. | |||||||
| liv. | onc. | gros | gr. | = | liv. | ||
| 1 | » | » | » | = | 1,0000000 | ||
| 2 | » | » | = | 0,1250000 | |||
| 7 | » | = | 0,0546875 | ||||
| 15 | = | 0,0016276 | |||||
| Total | 1 | 2 | 7 | 15 | = | 1,1813151 | |
332
| Pour le produit C. | ||||||
| Fractions vulgaires. | Fractions décimales correspondantes. | |||||
| onc. | gros | gr. | = | liv. | ||
| 3 | » | » | = | 0,1875000 | ||
| 1 | » | = | 0,0078125 | |||
| 37 | = | 0,0040148 | ||||
| Total | 3 | 1 | 37 | = | 0,1993273 | |
| Pour le produit D. | ||||||
| onc. | gros | gr. | = | liv. | ||
| 4 | » | » | = | 0,2500000 | ||
| 3 | » | = | 0,0234375 | |||
| 29 | = | 0,0031467 | ||||
| Total | 4 | 3 | 29 | = | 0,2765842 | |
En récapitulant ces résultats, on aura en fractions décimales:
| Pour le produit A | 2,3427734 |
| Pour le produit B | 1,1813151 |
| Pour le produit C | 0,1993273 |
| Pour le produit D | 0,2765842 |
| Total | 4,0000000 |
Les produits ainsi exprimés en fractions décimales, sont ensuite susceptibles de toute espèce 333 de réduction & de calcul, & on n'est plus obligé de réduire continuellement en grains les nombres sur lesquels on veut opérer, & de reformer ensuite avec ces mêmes nombres des livres, onces & gros.
La détermination du poids des matières & des produits, avant & après les expériences, étant la base de tout ce qu'on peut faire d'utile & d'exact en Chimie, on ne sauroit y apporter trop d'exactitude. La première chose, pour remplir cet objet, est de se munir de bons instrumens. On ne peut se dispenser d'avoir, pour opérer commodément, trois excellentes balances. La première doit peser jusqu'à 15 & 20 livres, sans fatiguer le fléau. Il n'est pas rare d'être obligé dans des expériences chimiques de déterminer à un demi-grain près ou un grain tout au plus la tarre & le poids de très-grands vases & d'appareils très-pesans. Il faut, pour arriver à ce degré de précision, des balances faites par un artiste habile & avec des précautions particulières; il faut sur-tout se faire une loi de ne jamais s'en servir dans un laboratoire où elles seroient immanquablement rouillées & gâtées: elles doivent être conservées dans un cabinet séparé, où il n'entre jamais d'acides. Celles dont je me sers ont été construites par M. Fortin; leur fléau a trois pieds de long, & elles 334 réunissent toutes les sûretés & les commodités qu'on peut desirer. Je ne crois pas que, à l'exception de celles de Ramsden, il en existe qui puissent leur être comparées pour la justesse & pour la précision. Indépendamment de cette forte balance, j'en ai deux autres qui sont bannies, comme la première, du laboratoire; l'une pèse jusqu'à 18 ou 20 onces, à la précision du dixième de grain; la troisième ne pèse que jusqu'à un gros, & les 512es de grain y sont très-sensibles.
Je donnerai à l'Académie, dans un Mémoire particulier, une description de ces trois balances, avec des détails sur le degré de précision qu'on en obtient.
Ces instrumens au surplus dont on ne doit se servir que pour les expériences de recherche, ne dispensent pas d'en avoir d'autres moins précieux pour les usages courans du laboratoire. On y a continuellement besoin d'une grosse balance à fléau de fer peint en noir, qui puisse peser des terrines entières pleines de liquide, & des quantités d'eau de 40 à 50 livres, à un demi-gros près; d'une seconde balance susceptible de peser jusqu'à 8 à 10 livres, à 12 ou 15 grains près; enfin d'une petite balance à la main, pesant environ une livre, à la précision du grain.
335
Mais ce n'est pas encore assez d'avoir d'excellentes balances; il faut les connoître, les avoir étudiées, savoir s'en servir, & l'on n'y parvient que par un long usage & avec beaucoup d'attention. Il est sur-tout important de vérifier souvent les poids dont on se sert: ceux fournis chez les balanciers ayant été ajustés avec des balances qui ne sont pas extrêmement sensibles, ne se trouvent plus rigoureusement exacts quand on les éprouve avec des balances aussi parfaites que celles que je viens d'annoncer.
Ce seroit une excellente manière, pour éviter les erreurs dans les pesées, que de les répéter deux fois, en employant pour les unes des fractions vulgaires de livre, & pour les autres des fractions décimales.
Tels sont les moyens qui ont paru jusqu'ici les plus propres à déterminer les quantités de matières employées dans les expériences, c'est-à-dire, pour me servir de l'expression ordinaire, à déterminer le poids absolu des corps. Mais en adoptant cette expression, je ne puis me dispenser d'observer que, prise dans un sens strict, elle n'est pas absolument exacte. Il est certain qu'à la rigueur nous ne connoissons & nous ne pouvons connoître que des pesanteurs relatives; que nous ne pouvons les exprimer qu'en partant d'une unité conventionnelle: 336 il seroit donc plus vrai de dire que nous n'avons aucune mesure du poids absolu des corps.
Passons maintenant à ce qui concerne la pesanteur spécifique. On a désigné sous ce nom le poids absolu des corps divisé par leur volume, ou ce qui revient au même, le poids que pèse un volume déterminé d'un corps. C'est la pesanteur de l'eau qu'on a choisie, en général, pour l'unité qui exprime ce genre de pesanteur. Ainsi quand on parle de la pesanteur spécifique de l'or, on dit qu'il est dix-neuf fois aussi pesant que l'eau; que l'acide sulfurique concentré est deux fois aussi pesant que l'eau, & ainsi des autres corps.
Il est d'autant plus commode de prendre ainsi la pesanteur de l'eau pour unité, que c'est presque toujours dans l'eau que l'on pèse les corps dont on veut déterminer la pesanteur spécifique. Si, par exemple, on se propose de reconnoître la pesanteur spécifique d'un morceau d'or pur écroui à coups de marteau, & si ce morceau d'or pèse dans l'air 8 onces 4 gros 2 grains & demi, comme celui que M. Brisson a éprouvé, page 5 de son Traité de la Pesanteur spécifique, on suspend cet or à un fil métallique très-fin & assez fort cependant pour pouvoir le supporter sans se rompre; on attache ce fil 337 sous le bassin d'une balance hydrostatique, & on pèse l'or entièrement plongé dans un vase rempli d'eau. Le morceau d'or dont il est ici question, a perdu dans l'expérience de M. Brisson 3 gros 37 grains. Or, il est évident que le poids que perd un corps quand on l'a pesé dans l'eau, n'est autre que le poids du volume d'eau qu'il déplace, ou, ce qui est la même chose, qu'un poids d'eau égal à son volume; d'où l'on peut conclure qu'à volume égal l'or pèse 4898 grains & demi, & l'eau 253: ce qui donne 193617 pour la pesanteur spécifique de l'or, celle de l'eau étant supposée 10000. On peut opérer de la même manière pour toutes les substances solides.
Il est au surplus assez rare qu'on ait besoin en Chimie de déterminer la pesanteur spécifique des corps solides, à moins qu'on ne travaille sur les alliages ou sur les verres métalliques: on a au contraire besoin presqu'à chaque instant de connoître la pesanteur spécifique des fluides, parce que c'est souvent le seul moyen qu'on ait de juger de leur degré de pureté & de concentration.
On peut également remplir ce dernier objet avec un très-grand degré de précision, au moyen de la balance hydrostatique, & en pesant successivement un corps solide, tel, par exemple, 338 qu'une boule de cristal de roche suspendue à un fil d'or très-fin, dans l'air & dans le fluide dont on veut déterminer la pesanteur spécifique. Le poids que perd la boule plongée dans le fluide, est celui d'un volume égal de ce fluide. En répétant successivement cette opération dans l'eau & dans différens fluides, on peut par un calcul très-simple en conclure leur rapport de pesanteur spécifique, soit entr'eux, soit avec l'eau: mais ce moyen ne seroit pas encore suffisamment exact, ou au moins il seroit très-embarrassant à l'égard des liqueurs dont la pesanteur spécifique differe très-peu de celle de l'eau, par exemple, à l'égard des eaux minérales & de toutes celles en général qui sont très-peu chargées de sels.
Dans quelques travaux que j'ai entrepris sur cet objet & qui ne sont point encore publics, je me suis servi avec beaucoup d'avantages de pèse-liqueurs très-sensibles & dont je vais donner une idée. Ils consistent dans un cylindre creux Abcf, planche VII, fig. 6, de cuivre jaune, ou mieux encore d'argent, & lesté par le bas en bcf avec de l'étain. Ce pèse-liqueur est ici représenté nageant dans un bocal lmno rempli d'eau. A la partie supérieure du cylindre est adaptée une tige faite d'un fil d'argent de 3/4 de ligne de diamètre tout au plus, & surmonté d'un 339 petit bassin d destiné à recevoir des poids. On fait sur cette tige une marque en g, dont on va expliquer l'usage. On peut faire cet instrument de différentes dimensions; mais il n'est suffisamment exact qu'autant qu'il déplace au moins quatre livres d'eau.
Le poids de l'étain dont cet instrument est lesté, doit être tel qu'il soit presqu'en équilibre dans de l'eau distillée, & qu'il ne faille plus y ajouter pour le faire entrer jusqu'à la marque g, qu'un demi-gros ou un gros tout au plus.
On commence par déterminer une première fois avec beaucoup d'exactitude le poids de cet instrument & le nombre de gros ou de grains dont il faut le charger dans de l'eau distillée, à une température donnée pour le faire entrer jusqu'à la marque g. On fait la même opération dans toutes les eaux dont on veut connoître la pesanteur spécifique, & on rapporte ensuite par le calcul les différences au pied cube, à la pinte ou à la livre, ou bien on les réduit en fractions décimales. Cette méthode, jointe à quelques expériences faites avec les réactifs, est une des plus sûres pour déterminer la qualité des eaux, & on y apperçoit des différences qui auroient échappé aux analyses chimiques les plus exactes. Je donnerai un jour le détail d'un grand travail que j'ai fait sur cet objet.
340
Les pèse-liqueurs métalliques ne peuvent servir que pour déterminer la pesanteur spécifique des eaux qui ne contiennent que des sels neutres ou des substances alkalines: on peut aussi en faire construire de particuliers lestés pour l'esprit-de-vin & les liqueurs spiritueuses. Mais toutes les fois qu'il est question de déterminer la pesanteur spécifique des acides, on ne peut employer que du verre. On prend alors un cylindre creux de verre abc, planche VII, figure 14, qu'on ferme hermétiquement à la lampe en bcf; on y soude dans sa partie supérieure un tube capillaire ad surmonté par un petit bassin d. On leste cet instrument avec du mercure, & on en introduit plus ou moins, suivant la pesanteur des liqueurs qu'on se propose d'examiner. On peut introduire dans le tube ad, qui forme le col de cet instrument, une petite bande de papier qui porte des divisions; & quoique ces divisions ne répondent pas aux mêmes fractions de grains dans des liqueurs dont la pesanteur spécifique est différente, elles sont cependant commodes pour les évaluations.
Je ne m'étendrai pas davantage sur les moyens qui servent pour déterminer, soit le poids absolu, soit la pesanteur spécifique des solides & des liquides; les instrumens qu'on emploie 341 à ce genre d'expériences, sont entre les mains de tout le monde, on peut se les procurer aisément, & de plus grands détails seroient inutiles. Il n'en sera pas de même de la mesure des gaz: la plupart des instrumens dont je me sers ne se trouvant nulle part & n'ayant été décrits dans aucun ouvrage, il m'a paru nécessaire d'en donner une connoissance plus détaillée: c'est l'objet que je me suis proposé dans le Chapitre suivant.

342
CHAPITRE II.
De la Gazométrie, ou de la mesure du poids & du volume des substances aériformes.
§. I.
Description des Appareils pneumato-chimiques.
Les Chimistes françois ont donné dans ces derniers tems le nom de pneumato-chimique à un appareil à la fois très-ingénieux & très-simple, imaginé par M. Priestley, & qui est devenu absolument indispensable dans tous les laboratoires. Il consiste en une caisse ou cuve de bois plus ou moins grande, planche V, figures 1 & 2, doublée de plomb laminé ou de feuilles de cuivre étamé. La figure 1 représente cette cuve vue en perspective; on en a supposé le devant & un des côtés enlevés dans la figure 2, afin de faire mieux sentir la manière dont elle est construite dans son intérieur.
On distingue dans tout appareil de cette espèce, la tablette de la cuve ABCD, figures 1 & 2, & le fond de la cuve FGHI, fig. 2. L'intervalle qui se trouve entre ces deux plans est la cuve proprement dite, ou la fosse de la 343 cuve. C'est dans cette partie creuse qu'on emplit les cloches: on les retourne ensuite & on les pose sur la tablette ABCD, voyez la cloche F, planche X. On peut encore distinguer les bords de la cuve, & l'on donne ce nom à tout ce qui excède le niveau de la tablette.
La cuve doit être suffisamment remplie, pour que la tablette soit toujours recouverte d'un pouce ou d'un pouce & demi d'eau; elle doit avoir assez de largeur & de profondeur, pour qu'il y en ait alors au moins un pied en tout sens dans la fosse de la cuve. Cette quantité suffit pour les expériences ordinaires; mais il est un grand nombre de circonstances où il est commode, où il est même indispensable de se donner encore plus d'espace. Je conseille donc à ceux qui veulent s'occuper utilement & habituellement d'expériences de Chimie, de construire très en grand ces appareils, si le local le leur permet. La fosse de ma cuve principale contient quatre pieds cubes d'eau, & la surface de sa tablette est de quatorze pieds quarrés. Malgré cette grandeur qui me paroissoit d'abord démésurée, il m'arrive encore souvent de manquer de place.
Il ne suffit pas encore dans un laboratoire où l'on est livré à un courant habituel d'expériences, d'avoir un seul de ces appareils, quelque 344 grand qu'il soit: il faut, indépendamment du magasin général, en avoir de plus petits & de portatifs même, qu'on place où le besoin l'exige & près du fourneau où l'on opère. Ce n'est qu'ainsi qu'on peut faire marcher plusieurs expériences à la fois. Il y a d'ailleurs des opérations qui salissent l'eau de l'appareil, & qu'il est nécessaire de faire dans une cuve particulière.
Il est sans doute beaucoup plus économique de se servir de cuves de bois, ou de baquets cerclés de fer & faits tout simplement avec des douves, plutôt que d'employer des caisses de bois doublées de cuivre ou de plomb. Je m'en suis moi-même servi dans mes premières expériences; mais j'ai bientôt reconnu les inconvéniens qui y sont attachés. Si l'eau n'y est pas toujours entretenue au même niveau, les douves qui se trouvent à sec prennent de la retraite; elles se disjoignent, & quand on vient ensuite à mettre plus d'eau, elle s'échappe par les jointures, & les planchers sont inondés.
Les vaisseaux dont on se sert pour recevoir & pour contenir les gaz dans cet appareil, sont des cloches de cristal A, figure 9. Pour les transporter d'un appareil à un autre, ou même pour les mettre en réserve quand la cuve est trop embarrassée, on se sert de plateaux 345 BC, même figure, garnis d'un rebord & de deux anses DE, pour les transporter.
A l'égard de l'appareil pneumato-chimique au mercure, après avoir essayé d'en construire de différentes matières, je me suis arrêté définitivement au marbre. Cette substance est absolument imperméable au mercure; on n'a pas à craindre, comme avec le bois, que les assemblages se déjoignent, ou que le mercure s'échappe par des gerçures; on n'a point non plus l'inquiétude de la cassure, comme avec le verre, la fayence & la porcelaine.
On choisit donc un bloc de marbre BCDE, planche V, figures 3 & 4, de deux pieds de long, de 15 à 18 pouces de large, & de 10 pouces d'épaisseur; on le fait creuser jusqu'à une profondeur mn, figure 5, d'environ quatre pouces, pour former la fosse qui doit contenir le mercure: & pour qu'on puisse y remplir plus commodément les cloches ou jarres, on y fait creuser en outre une profonde rigole TV, figures 3, 4 & 5, de quatre autres pouces au moins de profondeur: enfin, comme cette rigole pourroit être embarrassante dans quelques expériences, il est bon qu'on puisse la boucher & la condamner à volonté, & l'on remplit cet objet au moyen de petites planches qui entrent dans une rainure xy, figure 5. Je me suis 346 déterminé à faire construire deux cuves de marbre semblables à celle que je viens de décrire, mais de grandeurs différentes; j'en ai toujours par ce moyen une des deux qui me sert de réservoir pour conserver le mercure, & c'est de tous les réservoirs le plus sûr & le moins sujet aux accidens.
On peut opérer dans le mercure avec cet appareil, exactement comme dans l'eau: il faut seulement employer des cloches très-fortes & d'un petit diamètre, ou des tubes de cristal qui ont un empâtement par le bas, comme celui représenté fig. 7; les fayenciers qui les tiennent, les nomment eudiomètres. On voit une de ces cloches en place A, fig. 5, & ce qu'on nomme une jarre, fig. 6.
L'appareil pneumato-chimique au mercure est nécessaire pour toutes les opérations où il se dégage des gaz susceptibles d'être absorbés par l'eau, & ce cas n'est pas rare, puisqu'il a lieu généralement dans toutes les combustions, à l'exception de celle des métaux.
§. II.
Du Gazomètre.
Je donne le nom de gazomètre à un instrument dont j'ai eu la première idée, & que j'avois fait exécuter dans la vue de former un soufflet qui pût fournir continuellement & uniformément 347 un courant de gaz oxygène pour des expériences de fusion. Depuis, nous avons fait, M. Meusnier & moi, des corrections & des additions considérables à ce premier essai, & nous l'avons transformé en un instrument pour ainsi dire universel, dont il sera difficile de se passer toutes les fois qu'on voudra faire des expériences exactes.
Le nom seul de cet instrument indique assez qu'il est destiné à mesurer le volume des gaz. Il consiste en un grand fléau de balance, de trois pieds de longueur DE, planche VIII, fig. 1, construit en fer & très-fort. A chacune de ses extrêmités DE, est solidement fixée une portion d'arc de cercle également en fer.
Ce fléau ne repose pas, comme dans les balances ordinaires, sur un couteau; on y a substitué un tourillon cylindrique d'acier F, fig. 9, qui porte sur des rouleaux mobiles: on est parvenu ainsi à diminuer considérablement la résistance qui pouvoit mettre obstacle au libre mouvement de la machine, puisque le frottement de la première espèce se trouve converti en un de la seconde. Ces rouleaux sont en cuivre jaune & d'un grand diamètre: on a pris de plus la précaution de garnir les points qui supportent l'axe ou tourillon du fléau, avec des bandes de cristal de roche. Toute cette suspension 348 est établie sur une colonne solide, de bois BC, fig. 1.
A l'extrêmité D de l'un des bras du fléau, est suspendu un plateau de balance P, destiné à recevoir des poids. La chaîne qui est plate s'applique contre la circonférence de l'arc nDo, dans une rainure pratiquée à cet effet. A l'extrêmité E de l'autre bras du levier, est attachée une chaîne également plate ikm, qui par sa construction n'est pas susceptible de s'allonger ni de se raccourcir, lorsqu'elle est plus ou moins chargée. A cette chaîne est adapté solidement en i un étrier de fer à trois branches ai, ci, hi, qui supporte une grande cloche A de cuivre battu, de 18 pouces de diamètre sur environ 20 pouces de hauteur.
On a représenté toute cette machine en perspective dans la planche VIII, fig. 1; on l'a supposée au contraire, planche IX, fig. 2 & 4, partagée en deux par un plan vertical, pour laisser voir l'intérieur. Tout autour de la cloche dans le bas, planche IX, fig. 2, est un rebord relevé en-dehors & qui forme une capacité partagée en différentes cases 1, 2, 3, 4, &c. Ces cases sont destinées à recevoir des poids de plomb représentés séparément 1, 2, 3. Ils servent à augmenter la pesanteur de la cloche dans les cas où l'on a besoin d'une pression 349 considérable, comme on le verra dans la suite; ces cas au surplus sont extrêmement rares. La cloche cylindrique A est entièrement ouverte par son fond de, planc. IX, fig. 4; elle est fermée par le haut au moyen d'une calotte de cuivre abc, ouverte en bf, & fermée par le moyen d'un robinet g. Cette calotte, comme on le voit par l'inspection des figures, n'est pas placée tout-à-fait à la partie supérieure du cylindre; elle est rentrée en-dedans de quelques pouces, afin que la cloche ne soit jamais plongée en entier sous l'eau, & qu'elle n'en soit pas recouverte. Si j'étois dans le cas de faire reconstruire un jour cette machine, je desirerois que la calotte fût beaucoup plus surbaissée, de manière qu'elle ne formât presque qu'un plan.
Cette cloche ou réservoir à air est reçue dans un vase cylindrique LMNO, planche VIII, figure 1, également de cuivre & qui est plein d'eau.
Au milieu de ce vase cylindrique LMNO, planche IX, fig. 4, s'élèvent perpendiculairement deux tuyaux st, xy, qui se rapprochent un peu l'un de l'autre par leur extrêmité supérieure ty. Ces tuyaux se prolongent jusqu'un peu au-dessus du niveau du bord supérieur LM du vase LMNO. Quand la cloche abcde touche le fond NO, ils entrent d'un demi-pouce 350 environ dans la capacité conique b, qui conduit au robinet g.
La figure 3, pl. IX, représente le fond du vase LMNO. On voit au milieu une petite calotte sphérique creuse en-dessous, assujettie & soudée par ses bords au fond du vase. On peut la considérer comme le pavillon d'un petit entonnoir renversé, auquel s'adaptent en s & en x les tuyaux st, xy, fig. 4. Ces tuyaux se trouvent par ce moyen en communication avec ceux mm, nn, oo, pp, qui sont placés horisontalement sur le fond de la machine, fig. 3, & qui, tous quatre, se réunissent dans la calotte sphérique sx.
De ces quatre tuyaux, trois sortent en-dehors du vase LMNO, & on peut les suivre planche VIII, fig 1. L'un désigné par les chiffres arabes 1, 2, 3, s'ajuste en 3 avec la partie supérieure d'une cloche V, & par l'intermède du robinet 4. Cette cloche est posée sur la tablette d'une petite cuve GHIK, doublée de plomb & dont l'intérieur se voit pl. IX, fig. 1.
Le second tuyau est appliqué contre le vase LMNO, de 6 en 7: il se continue ensuite en 7, 8, 9 & 10, & vient s'engager en 11 sous la cloche V. Le premier de ces deux tuyaux est destiné à introduire le gaz dans la machine; le second à en faire passer des essais 351 sous des cloches. On détermine le gaz à entrer ou à sortir, suivant le degré de pression qu'on donne, & on parvient à faire varier cette pression en chargeant plus ou moins le bassin P. Lors donc qu'on veut introduire de l'air, on donne une pression nulle & quelquefois même négative. Lorsqu'au contraire on veut en faire sortir, on augmente la pression jusqu'au degré où on le juge à propos.
Le troisième tuyau 12, 13, 14, 15 est destiné à conduire l'air ou le gaz à telle distance qu'on le juge à propos pour les combustions, combinaisons ou autres opérations de ce genre.
Pour entendre l'usage du quatrième tuyau, il est nécessaire que j'entre dans quelques explications. Je suppose que le vase LMNO, fig. 1, soit rempli d'eau, & que la cloche A soit en partie pleine d'air & en partie pleine d'eau: il est évident qu'on peut proportionner tellement les poids placés dans le bassin P, qu'il y ait un juste équilibre & que l'air ne tende ni à rentrer dans la cloche A, ni à en sortir; l'eau dans cette supposition sera au même niveau en-dedans & au-dehors de la cloche. Il n'en sera plus de même, sitôt qu'on aura diminué le poids placé dans le bassin P, & qu'il y aura pression du côté de la cloche: alors le niveau de l'eau sera plus bas dans l'intérieur qu'à l'extérieur 352 de la cloche, & l'air de l'intérieur se trouvera plus chargé que celui du dehors, d'une quantité qui sera mesurée exactement par le poids d'une colonne d'eau d'une hauteur égale à la différence des deux niveaux.
M. Meusnier, en partant de cette observation, a imaginé d'en déduire un moyen de reconnoître dans tous les instans le degré de pression qu'éprouveroit l'air contenu dans la capacité de la cloche A, planche VIII, fig. 1. Il s'est servi à cet effet d'un siphon de verre à deux branches 19, 20, 21, 22 & 23, solidement mastiqué en 19 & en 23. L'extrêmité 19 de ce siphon communique librement avec l'eau de la cuve ou vase extérieur. L'extrêmité 23 au contraire communique avec le quatrième tuyau dont je me suis réservé il n'y a qu'un moment d'expliquer l'usage, & par conséquent avec l'air de l'intérieur de la cloche, par le tuyau st, pl. IX, fig. 4. Enfin M. Meusnier a mastiqué en 16, planche VIII, fig. 1, un autre tube droit de verre 16, 17, 18, qui communique par son extrêmité 16 avec l'eau du vase extérieur: il est ouvert à l'air libre par son extrêmité supérieure 18.
Il est clair, d'après ces dispositions, que l'eau doit se tenir dans le tube 16, 17 & 18, constamment au niveau de celle de la cuve ou 353 vase extérieur; que l'eau au contraire dans la branche 19, 20 & 21, doit se tenir plus haut ou plus bas, suivant que l'air de l'intérieur de la cloche est plus ou moins pressé que l'air extérieur, & que la différence de hauteur entre ces deux colonnes, observée dans le tube 16, 17 & 18, & dans celui 19, 20 & 21, doit donner exactement la mesure de la différence de pression. On a fait placer en conséquence entre ces deux tubes une règle de cuivre graduée & divisée en pouces & lignes, pour mesurer ces différences.
On conçoit que l'air & en général tous les fluides élastiques aériformes étant d'autant plus lourds qu'ils sont plus comprimés, il étoit nécessaire pour en évaluer les quantités & pour convertir les volumes en poids, d'en connoître l'état de compression: c'est l'objet qu'on s'est proposé de remplir par le méchanisme qu'on vient d'exposer.
Mais ce n'est pas encore assez pour connoître la pesanteur spécifique de l'air ou des gaz & pour déterminer leur poids sous un volume connu, que de savoir quel est le degré de compression qu'ils éprouvent, il faut encore en connoître la température, & c'est à quoi nous sommes parvenus à l'aide d'un petit thermomètre dont la boule plonge dans la cloche A, & dont la 354 graduation s'élève en-dehors: il est solidement mastiqué dans une virole de cuivre qui se visse à la calote supérieure de la cloche A. Voyez 24 & 25, planche VIII, fig. 1, & pl. IX, fig. 4. Ce même thermomètre est représenté séparément, pl. VIII, fig. 10.
L'usage du gazomètre auroit encore présenté de grands embarras & de grandes difficultés, si nous nous fussions bornés à ces seules précautions. La cloche, en s'enfonçant dans l'eau du vase extérieur LMNO, perd de son poids, & cette perte de poids est égale à celui de l'eau qu'elle déplace. Il en résulte que la pression qu'éprouve l'air ou le gaz contenu dans la cloche, diminue continuellement à mesure qu'elle s'enfonce; que le gaz qu'elle a fourni dans le premier instant, n'est pas de la même densité que celui qu'elle fournit à la fin; que sa pesanteur spécifique va continuellement en décroissant; &, quoiqu'à la rigueur ces différences puissent être déterminées par le calcul, on auroit été obligé à des recherches mathématiques qui auroient rendu l'usage de cet appareil embarrassant & difficile. Pour remédier à cet inconvénient, M. Meusnier a imaginé d'élever perpendiculairement au milieu du fléau une tige quarrée de fer 26 & 27, pl. VIII, fig. 1, qui traverse une lentille creuse de cuivre 28, qu'on 355 ouvre & qu'on peut remplir de plomb. Cette lentille glisse le long de la tige 26 & 27; elle se meut par le moyen d'un pignon denté qui engraîne dans une crémaillère, & elle se fixe à l'endroit qu'on juge à propos.
Il est clair que quand le levier DE est horisontal, la lentille 28 ne pèse ni d'un côté ni d'un autre; elle n'augmente donc ni ne diminue la pression. Il n'en est plus de même quand la cloche A s'enfonce davantage & que le levier s'incline d'un côté, comme on le voit fig. 1. Alors le poids 28 qui n'est plus dans la ligne verticale qui passe par le centre de suspension, pèse du côté de la cloche & augmente sa pression. Cet effet est d'autant plus grand, que la lentille 28 est plus élevée vers 27, parce que le même poids exerce une action d'autant plus forte, qu'il est appliqué à l'extrêmité d'un levier plus long. On voit donc qu'en promenant le poids 28 le long de la tige 26 & 27, suivant laquelle il est mobile, on peut augmenter ou diminuer l'effet de la correction qu'il opère; & le calcul comme l'expérience, prouvent qu'on peut arriver au point de compenser fort exactement la perte de poids que la cloche éprouve à tous les degrés de pression.
Je n'ai encore rien dit de la manière d'évaluer les quantités d'air ou de gaz fournies par 356 la machine, & cet article est de tous le plus important. Pour déterminer avec une rigoureuse exactitude ce qui s'est dépensé dans le cours d'une expérience, & réciproquement pour savoir ce qui en a été fourni, nous avons établi sur l'arc de cercle qui termine le levier DE, fig. 1, un limbe de cuivre lm divisé en degrés & demi-degrés; cet arc est fixé au levier DE, & il est emporté par un mouvement commun. On mesure les quantités dont il s'abaisse, au moyen d'un index fixe 29, 30, qui se termine en 30 par un nonnius qui donne les centièmes de degré.
On voit, planche VIII, les détails des différentes parties que nous venons de décrire.
1o. Figure 2, la chaîne plate qui soutient le bassin de balance P; c'est celle de M. Vaucanson: mais comme elle a l'inconvénient de s'allonger ou de se raccourcir suivant qu'elle est plus ou moins chargée, il y auroit eu de l'inconvénient à l'employer à la suspension de la cloche A.
2o. Figure 5, la chaîne ikm, qui, dans la figure 1 porte la cloche A: elle est toute formée de plaques de fer limées, enchevêtrées les unes dans les autres, & maintenues par des chevilles de fer. Quelque fardeau qu'on fasse supporter à ce genre de chaîne, elle ne s'alonge pas sensiblement.
357
3o. Figure 6, l'étrier à trois branches, par le moyen duquel est suspendue la cloche A avec des vis de rappel, pour la fixer dans une position bien verticale.
4o. Figure 3, la tige 26, 27, qui s'élève perpendiculairement au milieu du fléau, & qui porte la lentille 28.
5o. Figures 7 & 8, les rouleaux avec la bande z de cristal de roche, sur laquelle portent les contacts, pour diminuer encore le frottement.
6o. Figure 4, la pièce qui porte l'axe des rouleaux.
7o. Figure 9, le milieu du fléau avec le tourillon sur lequel il est mobile.
8o. Figure 10, le thermomètre qui donne le degré de l'air contenu dans la cloche.
Quand on veut se servir du gazomètre qu'on vient de décrire, il faut commencer par remplir d'eau le vase extérieur LMNO, planche VIII, fig. 1, jusqu'à une hauteur déterminée, qui doit toujours être la même dans toutes les expériences. Le niveau de l'eau doit être pris quand le fléau de la machine est horisontal. Ce niveau, quand la cloche est à fond, se trouve augmenté de toute la quantité d'eau qu'elle a déplacée; il diminue au contraire à mesure que la cloche approche de son plus haut point d'élévation. On cherche ensuite par tâtonnemens 358 quelle est l'élévation à laquelle doit être fixée la lentille 28, pour que la pression soit égale dans toutes les positions du fléau. Je dis à peu près, parce que la correction n'est pas rigoureuse, & que des différences d'un quart de ligne & même d'une demi-ligne ne sont d'aucune conséquence. Cette hauteur à laquelle il faut élever la lentille, n'est pas la même pour tous les degrés de pression; elle varie suivant que cette pression est de 1 pouce, 2 pouces, 3 pouces, &c. Toutes ces déterminations doivent être écrites à mesure sur un registre avec beaucoup d'ordre.
Ces premières dispositions faites, on prend une bouteille de huit à dix pintes, dont on détermine bien la capacité en pesant exactement la quantité d'eau qu'elle peut contenir. On renverse cette bouteille ainsi pleine dans la cuve GHIK, fig. 1. On en pose le gouleau sur la tablette à la place de la cloche V, en engageant l'extrêmité 11 du tuyau 7, 8, 9, 10, 11 dans son gouleau. On établit la machine à zéro de pression, & on observe bien exactement le degré marqué par l'index sur le limbe: puis ouvrant le robinet 8 & appuyant un peu sur la cloche A, on fait passer autant d'air qu'il en faut pour remplir entièrement la bouteille. Alors on observe de nouveau le limbe, & on est en état 359 de calculer le nombre de pouces cubes qui répondent à chaque degré.
Après cette première bouteille on en remplit une seconde, une troisième, &c. on recommence même plusieurs fois cette opération, & même avec des bouteilles de différentes capacités; & avec du tems & une scrupuleuse attention on parvient à jauger la cloche A dans toutes ses parties. Le mieux est de faire en sorte qu'elle soit bien tournée & bien cylindrique, afin d'éviter les évaluations & les calculs.
L'instrument que je viens de décrire & que j'ai nommé gazomètre, a été construit par M. Meignié le jeune, ingénieur, constructeur d'instrumens de physique, bréveté du Roi. Il y a apporté un soin, une exactitude & une intelligence rares. C'est un instrument précieux par le grand nombre des applications qu'on en peut faire, & parce qu'il est des expériences à peu près impossibles sans lui. Ce qui le renchérit, c'est qu'un seul ne suffit pas, il le faut double dans un grand nombre de cas, comme dans la formation de l'eau, dans celle de l'acide nitreux, &c. C'est un effet inévitable de l'état de perfection dont la Chimie commence à s'approcher, que d'exiger des instrumens & des appareils dispendieux & compliqués: il faut s'attacher sans doute à les simplifier, 360 mais il ne faut pas que ce soit aux dépens de leur commodité & sur-tout de leur exactitude.
§. III.
De quelques autres manières de mesurer le volume des Gaz.
Le gazomètre dont je viens de donner la description dans le paragraphe précédent, est un instrument trop compliqué & trop cher, pour qu'on puisse l'employer habituellement à la mesure des gaz dans les laboratoires; il s'en faut même beaucoup qu'il soit applicable à toutes les circonstances. Il faut pour une multitude d'expériences courantes, des moyens plus simples & qui soient, si l'on peut se permettre cette expression, plus à la main. Je vais détailler ici ceux dont je me suis servi jusqu'au moment où j'ai eu un gazomètre à ma disposition, & dont je me sers encore aujourd'hui de préférence dans le cours ordinaire de mes expériences.
J'ai décrit dans le paragraphe premier de ce chapitre les appareils pneumato-chimiques à l'eau & au mercure. Ils consistent, comme on l'a vu, en cuves plus ou moins grandes sur la tablette desquelles se posent les cloches destinées 361 à recevoir les gaz. Je suppose qu'à la suite d'une expérience quelconque, on ait dans un appareil de cette espèce un résidu de gaz qui n'est absorbable ni par l'alkali ni par l'eau, qui est contenu dans le haut d'une cloche AEF, planche IV, fig. 3, & dont on veut connoître le volume. On commence par marquer avec une grande exactitude par le moyen de bandes de papier la hauteur EF de l'eau ou du mercure. Il ne faut pas se contenter d'appliquer une seule marque d'un des côtés de la cloche, parce qu'il pourroit rester de l'incertitude sur le niveau du liquide: il en faut au moins trois ou même quatre en opposition les unes aux autres.
On doit ensuite, si c'est sur du mercure qu'on opère, faire passer sous la cloche de l'eau pour déplacer le mercure. Cette opération se fait facilement avec une bouteille qu'on emplit d'eau à rase: on en bouche l'orifice avec le doigt, on la renverse & on engage son col sous la cloche; puis retournant la bouteille, on en fait sortir l'eau qui s'élève au-dessus de la colonne de mercure & qui la déplace. Lorsque tout le mercure est ainsi déplacé, on verse de l'eau sur la cuve ABCD, de manière que le mercure en soit couvert d'un pouce environ. On passe une assiète ou un vase quelconque très-plat sous la cloche, & on l'enlève pour la 362 transporter sur une cuve à eau, planc. V, figures 1 & 2. Alors on transvase l'air dans une cloche qui a été graduée de la manière dont je vais l'expliquer, & on juge de la quantité du gaz par les graduations de la cloche.
A cette première manière de déterminer le volume du gaz, on peut en substituer une autre qu'il est bon d'employer comme moyen de vérification. L'air ou le gaz une fois transvasé, on retourne la cloche qui le contenoit, & on y verse de l'eau jusqu'aux marques EF; on pèse cette eau, & de son poids on en conclut le volume, d'après cette donnée qu'un pied cube ou 1728 pouces d'eau pèsent 70 liv. On trouvera à la fin de cette troisième partie une Table où ces réductions se trouvent toutes faites.
La manière de graduer les cloches est extrêmement facile, & je vais en donner le procédé afin que chacun puisse s'en procurer. Il est bon d'en avoir de plusieurs grandeurs, & même un certain nombre de chaque grandeur, pour y avoir recours en cas d'accident.
On prend une cloche de cristal un peu forte, longue & étroite; on l'emplit d'eau dans la cuve représentée planche V, fig. 1, & on la pose sur la tablette ABCD. On doit avoir une place déterminée qui serve constamment à 363 ce genre d'opération, afin que le niveau de la tablette sur laquelle on pose la cloche soit toujours le même; on évite par-là presque la seule erreur dont ce genre d'opération soit susceptible.
D'un autre côté, on choisit une bouteille à gouleau étroit qui, pleine à rase, contienne juste 6 onces 3 gros 61 grains d'eau, ce qui répond à un volume de 10 pouces cubiques. Si on ne trouvoit pas de bouteille qui eût précisément cette capacité, on en prendroit une un peu plus grande, & on y couleroit un peu de cire fondue avec de la résine, pour en diminuer la capacité: cette bouteille sert d'étalon pour jauger la cloche, & voici comme on y procède. On fait passer l'air contenu dans cette bouteille dans la cloche qu'on se propose de graduer, puis on fait une marque à la hauteur jusqu'à laquelle est descendue l'eau. On ajoute une seconde mesure d'air & on fait une nouvelle marque; on continue ainsi jusqu'à ce que toute l'eau de la cloche ait été déplacée. Il est important pendant le cours de cette opération, que la bouteille & la cloche soient maintenues constamment à la même température, & que cette température differe peu de celle de l'eau de la cuve. On doit donc éviter d'appliquer les mains sur la cloche, ou au 364 moins de les y tenir long-tems, pour ne la pas échauffer: si même on craignoit qu'elle ne l'eût été, il faudroit verser dessus de l'eau de la cuve pour la rafraîchir. La hauteur du baromètre & du thermomètre est indifférente pour cette opération, pourvu qu'elle ne varie pas pendant qu'elle dure.
Lorsque les marques ont été ainsi placées de 10 pouces en 10 pouces sur la cloche, on y trace une graduation avec une pointe de diamant emmanchée dans une petite tige de fer. On trouve des diamans ainsi montés pour un prix modique au Louvre, chez le successeur de Passement. On peut graduer de la même manière des tubes de cristal pour le mercure: on les divise alors de pouce en pouce & même de dixièmes de pouce en dixièmes de pouce. La bouteille qui sert de jauge doit contenir juste 8 onces 6 gros 25 grains de mercure; c'est le poids équivalent à un pouce cubique.
Cette manière de déterminer les volumes d'air, au moyen d'une cloche graduée, comme on vient de l'exposer, a l'avantage de n'exiger aucune correction pour la différence de hauteur qui existe entre le niveau de l'eau dans l'intérieur de la cloche, & celui de l'eau de la cuve: mais il ne dispense pas des corrections relatives à la hauteur du baromètre & du thermomètre. 365 Lorsqu'on détermine au contraire le volume de l'air par le poids de l'eau contenue jusqu'aux marques EF, on a une correction de plus à faire pour la différence des niveaux du fluide en-dedans & en-dehors de la cloche, comme je l'expliquerai dans le §. V de ce chapitre.
§. IV.
De la manière de séparer les unes des autres les différentes espèces
de Gaz.
On n'a présenté dans le paragraphe précédent qu'un cas des plus simples, celui où l'on se propose de déterminer le volume d'un gaz pur non absorbable par l'eau: les expériences conduisent ordinairement à des résultats plus compliqués, & il n'est pas rare d'obtenir à la fois trois ou quatre espèces de gaz différentes. Je vais essayer de donner une idée de la manière dont on parvient à les séparer.
Je suppose que j'aye sous la cloche A, pl. IV, fig. 3, une quantité AEF de différens gaz, mêlés ensemble & contenus par du mercure: on doit commencer par marquer exactement avec des bandes de papier, comme je l'ai prescrit dans le paragraphe précédent, la hauteur du mercure: on fait ensuite passer sous la cloche une très-petite quantité d'eau, d'un pouce 366 cubique, par exemple: si le mêlange de gaz contient du gaz acide muriatique ou du gaz acide sulfureux, il y aura sur-le-champ une absorption très-considérable, parce que c'est une propriété de ces gaz d'être absorbés en grande quantité par l'eau, sur-tout le gaz acide muriatique. Si le pouce cube d'eau qui a été introduit ne produit qu'une très-légère absorption & à peine égale à son volume, on en conclura que le mêlange ne contient ni gaz acide muriatique, ni gaz acide sulfureux, ni même de gaz ammoniaque; mais on commencera dès-lors à soupçonner qu'il est mêlangé de gaz acide carbonique, parce qu'en effet l'eau n'absorbe de ce gaz qu'un volume à peu près égal au sien. Pour vérifier ce soupçon, on introduira sous la cloche de l'alkali caustique en liqueur: s'il y a du gaz acide carbonique, on observera une absorption lente & qui durera plusieurs heures; l'acide carbonique se combinera avec l'alkali caustique ou potasse, & ce qui restera ensuite n'en contiendra pas sensiblement.
On n'oubliera pas à la suite de chaque expérience de coller des marques de papier sur la cloche, à l'endroit où répondra la surface du mercure, & de les vernir dès qu'elles seront sèches, afin qu'on puisse plonger la cloche 367 dans l'eau sans risquer de les décoller. Il sera également nécessaire de tenir note de la différence de niveau entre le mercure de la cloche & celui de la cuve, ainsi que de la hauteur du baromètre & du degré du thermomètre.
Lorsqu'on aura ainsi absorbé par l'eau & par la potasse tous les gaz qui en sont susceptibles, on fera passer de l'eau sous la cloche pour en déplacer tout le mercure; on couvrira, comme je l'ai prescrit dans le paragraphe précédent, le mercure de la cuve d'environ deux pouces d'eau; puis passant par-dessous la cloche une assiète plate, on la transportera sur la cuve pneumato-chimique à l'eau: là on déterminera la quantité d'air ou de gaz restant, en la faisant passer dans une cloche graduée. Cela fait, on en prendra différens essais dans de petites jarres, & par des expériences préliminaires on cherchera à reconnoître quels sont à peu près les gaz auxquels on a affaire. On introduira par exemple dans une des petites jarres remplie de ce gaz une bougie allumée, comme on le voit représenté planche V, fig. 8. Si la bougie ne s'y éteint pas, on en conclura qu'il contient du gaz oxygène, & même, suivant que la flamme de la bougie sera plus ou moins éclatante, on pourra juger s'il en contient plus ou moins que l'air de l'atmosphère. Dans le cas au contraire 368 où la bougie s'y éteindroit, on auroit une forte raison de présumer que ce résidu est, pour la plus grande partie, du gaz azote. Si à l'approche de la bougie le gaz s'enflamme & brûle paisiblement à la surface avec une flamme de couleur blanche, on en conclura que c'est du gaz hydrogène pur; si elle est bleue, on aura lieu d'en conclure que ce gaz est carboné: enfin s'il brûle avec bruit & détonation, c'est un mêlange de gaz oxygène & de gaz hydrogène.
On peut encore mêler une portion du même gaz avec du gaz oxygène; s'il y a vapeurs rouges & absorption, on en conclura qu'il contient du gaz nitreux.
Ces connoissances préliminaires donnent bien une idée de la qualité du gaz & de la nature du mêlange; mais elles ne suffisent pas pour déterminer les proportions & les quantités. Il faut alors avoir recours à toutes les ressources de l'analyse, & c'est beaucoup que de savoir à peu près dans quel sens il faut diriger ses efforts. Je suppose que l'on ait reconnu que le résidu sur lequel on opère soit un mêlange de gaz azote & de gaz oxygène: pour en reconnoître la proportion, on en fait passer une quantité déterminée, 100 parties par exemple, dans un tube gradué de 10 à 12 lignes de diamètre: 369 on y introduit du sulfure de potasse dissous dans l'eau, & on laisse le gaz en contact avec cette liqueur; elle absorbe tout le gaz oxygène, & au bout de quelques jours il ne reste que du gaz azote.
Si au contraire on a reconnu qu'on avoit affaire à du gaz hydrogène, on en fait passer une quantité déterminée dans un eudiomètre de Volta; on y joint une première portion de gaz oxygène, qu'on fait détoner avec lui par l'étincelle électrique: on ajoute une seconde portion du même gaz oxygène, & on fait détoner de nouveau, & ainsi jusqu'à ce qu'on ait obtenu la plus grande diminution possible de volume. Il se forme, comme on sait, dans cette détonation, de l'eau qui est absorbée sur-le-champ; mais si le gaz hydrogène contenoit du carbone, il se forme en même tems de l'acide carbonique qui ne s'absorbe pas aussi promptement, & dont on peut reconnoître la quantité en facilitant son absorption par l'agitation de l'eau.
Enfin si on a du gaz nitreux, on peut encore en déterminer la quantité, du moins à peu près, par une addition de gaz oxygène, & d'après la diminution du volume qui en résulte.
Je m'en tiendrai à ces exemples généraux qui suffisent pour donner une idée de ce genre 370 d'opérations. Un volume entier ne suffiroit pas, si l'on vouloit prévoir tous les cas. L'analyse des gaz est un art avec lequel il faut se familiariser; mais comme ils ont la plupart de l'affinité les uns avec les autres, il faut avouer qu'on n'est pas toujours sûr de les avoir complètement séparés. C'est alors qu'il faut changer de marche & de route, refaire d'autres expériences sous une autre forme, introduire quelque nouvel agent dans la combinaison, en écarter d'autres, jusqu'à ce qu'on soit sûr d'avoir saisi la vérité.
§. V.
Des corrections à faire au volume des Gaz obtenus dans les
expériences, relativement à la pression de l'atmosphère.
C'est une vérité donnée par l'expérience, que les fluides élastiques en général sont compressibles en raison des poids dont ils sont chargés. Il est possible que cette loi souffre quelqu'altération aux approches du degré de compression qui seroit suffisant pour les réduire à l'état liquide, & de même à un degré de dilatation ou de compression extrême: mais nous ne sommes pas près de ces limites pour la plupart des gaz que nous soumettons à des expériences.
Quand je dis que les fluides élastiques sont 371 compressibles en raison des poids dont ils sont chargés, voici comme il faut entendre cette proposition.
Tout le monde sait ce que c'est qu'un baromètre. C'est, à proprement parler, un siphon ABCD, pl. XII, fig. 16, plein de mercure dans la branche AB, plein d'air dans la branche BCD. Si l'on suppose mentalement cette branche BCD prolongée indéfiniment jusqu'au haut de notre atmosphère, on verra clairement que le baromètre n'est autre chose qu'une sorte de balance, un instrument dans lequel on met une colonne de mercure en équilibre avec une colonne d'air. Mais il est facile de s'appercevoir que, pour que cet effet ait lieu, il est parfaitement inutile de prolonger la branche BCD à une aussi grande hauteur, & que comme le baromètre est plongé dans l'air, la colonne AB de mercure sera également en équilibre avec une colonne de même diamètre d'air de l'atmosphère, quoique la branche du siphon BCD soit coupée en C & qu'on en retranche la partie CD.
La hauteur moyenne d'une colonne de mercure capable de faire équilibre avec le poids d'une colonne d'air prise depuis le haut de l'atmosphère jusqu'à la surface de la terre, est de 28 pouces de mercure, du moins à Paris & même dans les quartiers bas de la ville: ce qui 372 signifie en d'autres termes que l'air à la surface de la terre à Paris, est communément pressé par un poids égal à celui d'une colonne de mercure de 28 pouces de hauteur. C'est ce que j'ai voulu exprimer dans cet Ouvrage, lorsque j'ai dit en parlant des différens gaz, par exemple du gaz oxygène, qu'il pesoit 1 once 4 gros le pied cube, sous une pression de 28 pouces. La hauteur de cette colonne de mercure diminue à mesure que l'on s'élève & qu'on s'éloigne de la surface de la terre, ou, pour parler plus rigoureusement, de la ligne de niveau formée par la surface de la mer; parce qu'il n'y a que la colonne d'air supérieure au baromètre qui fasse équilibre avec le mercure, & que la pression de toute la quantité d'air qui est au-dessous du niveau où il est placé, est nulle par rapport à lui.
Mais, suivant quelle loi le baromètre baisse-t-il à mesure que l'on s'élève; ou, ce qui revient au même, quelle est la loi suivant laquelle les différentes couches de l'atmosphère décroissent de densité? C'est ce qui a beaucoup exercé la sagacité des Physiciens du dernier siècle. L'expérience suivante a d'abord jetté beaucoup de lumière sur cet objet.
Si l'on prend un siphon de verre ABCDE, planche XII, fig. 17, fermé en E & ouvert 373 en A, & qu'on y introduise quelques gouttes de mercure pour intercepter la communication entre la branche AB & la branche BE, il est clair que l'air contenu dans la branche BCDE sera pressé, comme tout l'air environnant par une colonne égale au poids de 28 pouces de mercure. Mais si on verse du mercure dans la branche AB, jusqu'à 28 pouces de hauteur, il est clair que l'air de la branche BCDE sera pressé par un poids égal à deux fois 28 pouces de mercure; or l'expérience a démontré qu'alors au lieu d'occuper le volume total BE, il n'occupera plus que celui CE qui en est précisément la moitié. Si à cette première colonne de 28 pouces de mercure, on en ajoute deux autres également de 28 pouces dans la branche AC, l'air de la branche BCDE sera comprimé par quatre colonnes chacune égale au poids de 28 pouces de mercure, & il n'occupera plus que l'espace DE, c'est-à-dire, le quart du volume qu'il occupoit au commencement de l'expérience. De ces résultats qu'on peut varier d'une infinité de manières, on en a déduit cette loi générale qui paroît applicable à tous les fluides élastiques, que leur volume décroît proportionnellement aux poids dont ils sont chargés; ce qui peut aussi s'énoncer en ces termes, que le volume de tout fluide élastique est en raison inverse 374 des poids dont il est comprimé. Les expériences faites pour la mesure des hautes montagnes ont pleinement confirmé l'exactitude de ces résultats, & en supposant qu'ils s'écartent de la vérité, les différences sont si excessivement petites qu'elles peuvent être regardées comme rigoureusement nulles dans les expériences chimiques.
Cette loi de la compression des fluides élastiques une fois bien entendue, il est aisé d'en faire l'application aux corrections qu'il est indispensable de faire au volume des airs ou gaz dans les expériences pneumato-chimiques. Ces corrections sont de deux genres; les unes relatives à la variation du baromètre, les autres relatives à la colonne d'eau ou de mercure contenus dans les cloches. Je vais faire en sorte de me rendre intelligible par des exemples: je commencerai par le cas le plus simple.
Je suppose qu'on ait obtenu 100 pouces de gaz oxygène à 10 degrés de température, le baromètre marquant 28 pouces 6 lignes. On peut demander deux choses; la première quel est le volume que les 100 pouces occuperoient sous une pression de 28 pouces, au lieu de 28 pouces 6 lignes; la seconde quel est le poids des 100 pouces de gaz obtenus?
Pour répondre à ces deux questions, on nommera x le nombre de pouces cubiques qu'occuperoient 375 les 100 pouces de gaz oxygène, à la pression de 28 pouces; & puisque les volumes sont en raison inverse des poids comprimans, on aura 100, pouces : x :: 1/285 : 1/280; d'où l'on déduit aisément x = 101,786 pouces. C'est-à-dire, que le même air qui n'occupoit qu'un espace de 100 pouces cubiques, sous une pression de 28 pouces 6 lignes de mercure, en occuperoit un de 101,786 pouces, à la pression de 28. Il n'est pas plus difficile de conclure le poids des mêmes 100 pouces d'air, sous une pression de 28 pouces 6 lignes. Car puisqu'ils répondent à 101,786 pouces, à la pression de 28 pouces, & qu'à cette pression & à 10 degrés du thermomètre, le pouce cube de gaz oxygène pèse un demi-grain; il s'en suit évidemment que les 100 pouces, sous une pression de 28 pouces 6 lignes, pèsent 50,893 grains. On auroit pu arriver directement à cette conséquence par le raisonnement qui suit: puisque les volumes de l'air, & en général d'un fluide élastique quelconque, sont en raison inverse des poids qui le compriment, il en résulte par une conséquence nécessaire que la pesanteur de ce même air doit croître proportionnellement au poids comprimant. Si donc, 100 pouces cubiques de gaz oxygène pèsent 50 grains, à la pression de 28 pouces, combien peseront-ils à la pression de 376 28,5 pouces, on aura alors cette proportion, 28 : 50 :: 28,5 : x; d'où l'on conclura également x = 50,893 grains.
Je passe à un cas un peu plus compliqué. Je suppose que la cloche A, planche XII, fig. 18, contienne un gaz quelconque dans sa partie supérieure ACD; que le reste de cette même cloche soit rempli de mercure au-dessous de CD, & que le tout soit plongé dans un bassin GHIK contenant du mercure jusqu'en EF. Enfin, je suppose encore que la différence CE de la hauteur du mercure dans la cloche & dans le bassin soit de 6 pouces, & que la hauteur du baromètre soit de 27 pouces 6 lignes. Il est clair que d'après ces données, l'air contenu dans la capacité ACD est pressé par le poids de l'atmosphère, diminué du poids de la colonne de mercure CE. La force qui le presse est donc égale à 27,5 pouces - 6, pouces = 21,5 pouces. Cet air est donc moins pressé que ne l'est l'air de l'atmosphère à la hauteur moyenne du baromètre: il occupe donc plus d'espace qu'il n'en devroit occuper, & la différence est précisément proportionnelle à la différence des poids qui le compriment. Si donc après avoir mesuré l'espace ABC, on l'a trouvé, par exemple, de 120 pouces cubiques, il faudra 377 pour ramener le volume du gaz à celui qu'il occuperoit, à une pression de 28 pouces, faire la proportion suivante: 120 pouces est au volume cherché que j'appellerai x, comme 1/21,5 est à 1/28; d'où l'on déduira x = (120×21,5)/28 = 92,143 pouces.
On a le choix dans ces sortes de calculs, ou de réduire en lignes la hauteur du baromètre, ainsi que la différence du niveau du mercure en-dedans & en-dehors de la cloche, ou de l'exprimer en fractions décimales de pouces. Je préfère ce dernier parti, qui rend le calcul plus court & plus facile. On ne doit point négliger les méthodes d'abréviations pour les opérations qui se répètent souvent: j'ai joint en conséquence à la suite de cette troisième partie, sous le No. IV, une table qui exprime les fractions décimales de pouces correspondantes aux lignes & fractions de lignes. Rien ne sera plus aisé, d'après cette table, que de réduire en fractions décimales de pouces les hauteurs du mercure qu'on aura observées en lignes.
On a des corrections semblables à faire lorsqu'on opère dans l'appareil pneumato-chimique à l'eau. Il faut également, pour obtenir des résultats rigoureux, tenir compte de la différence 378 de hauteur de l'eau en-dehors & en-dedans de la cloche. Mais, comme c'est en pouces & lignes du baromètre, & par conséquent en pouces & lignes de mercure, que s'exprime la pression de l'atmosphère, & qu'on ne peut additionner ensemble que des quantités homogènes, on est obligé de réduire les différences de niveau exprimées en pouces & lignes d'eau, en une hauteur équivalente de mercure. On part, pour cette conversion, de cette donnée, que le mercure est 13,5681fois aussi pesant que l'eau. On trouve à la fin de cet Ouvrage sous le No. V, une table à l'aide de laquelle on peut faire promptement et facilement cette réduction.
§. VI.
Des Corrections relatives aux différens degrés du Thermomètre.
De même que pour avoir le poids de l'air & des gaz il est nécessaire de les réduire à une pression constante, telle que celle de 28 pouces de mercure; de même aussi il est nécessaire de les réduire à une température déterminée: car puisque les fluides élastiques sont susceptibles de se dilater par la chaleur & de se condenser par le froid, il en résulte nécessairement qu'ils changent de densité, & que leur pesanteur 379 n'est plus la même sous un volume donné. La température de 10 degrés étant moyenne entre les chaleurs de l'été & les froids de l'hiver, cette température étant celle des souterrains, & celle en même tems dont il est le plus facile de se rapprocher dans presque toutes les saisons de l'année, c'est celle que j'ai choisie pour y ramener les airs ou gaz.
M. de Luc a trouvé que l'air de l'atmosphère augmentoit de 1/215 de son volume par chaque degré du thermomètre à mercure divisé en 81 degrés de la glace à l'eau bouillante; ce qui donne pour un degré du thermomètre à mercure divisé en 80 parties, 1/211. Les expériences de M. Monge sembleroient annoncer que le gaz hydrogène est susceptible d'une dilatation un peu plus forte; il l'a trouvée de 1/180. A l'égard de la dilatation des autres gaz, nous n'avons pas encore d'expériences très-exactes; celles du moins qui existent n'ont pas été publiées. Il paroît cependant, à en juger par les tentatives que l'on connoît, que leur dilatabilité s'éloigne peu de celle de l'air commun. Je crois donc pouvoir supposer que l'air de l'atmosphère se dilate de 1/210 par chaque degré du thermomètre, & le gaz hydrogène de 1/190: mais comme il reste quelque incertitude sur ces déterminations, 380 il faut, autant qu'il est possible, n'opérer qu'à une température peu éloignée de 10 degrés. Les erreurs qu'on peut alors commettre dans des corrections relatives au degré du thermomètre, ne sont d'aucune conséquence.
Le calcul à faire pour ces corrections est extrêmement facile; il consiste à diviser le volume de l'air obtenu par 210, & à multiplier le nombre trouvé par celui des degrés du thermomètre supérieur ou inférieur à 10 degrés. Cette correction est négative au-dessus de dix degrés, & additive au-dessous. Le résultat qu'on obtient est le volume réel de l'air à la température de 10 degrés.
On abrège & on facilite beaucoup tous ces calculs, en employant des tables de logarithmes.
§. VII.
Modèle de calcul pour les Corrections relatives au degré de pression &
de température.
Maintenant que j'ai indiqué la manière de déterminer le volume des airs ou gaz & de faire à ce volume les corrections relatives à la pression & à la température, il me reste à donner un exemple pris dans un cas compliqué, afin de mieux faire sentir l'usage des tables qui se trouvent à la fin de cet Ouvrage.
381
Exemple.
On a renfermé dans une cloche A, pl. IV, fig. 3, une quantité d'air AEF, qui s'est trouvée occuper un volume de 353 pouces cubiques. Cet air étoit contenu par de l'eau, & la hauteur EL de la colonne d'eau dans l'intérieur de la cloche étoit de 4 pouces & demi au-dessus du niveau de celle de la cuve; enfin le baromètre étoit à 27 pouces 9 lignes & demie, & le thermomètre à 15 degrés.
On a brûlé dans cet air une substance quelconque, telle que du phosphore, dont le résultat est l'acide phosphorique qui, loin d'être dans l'état de gaz, est au contraire dans l'état concret. L'air restant après la combustion occupoit un volume de 295 pouces; la hauteur de l'eau dans l'intérieur de la cloche étoit de 7 pouces au-dessus de celle de la cuve, le baromètre à 27 pouces 9 lignes 1/4, & le thermomètre à 16 degrés.
Il est question, d'après ces données, de déterminer quel est le volume de l'air avant & après la combustion, & d'en conclure le volume de la partie qui a été absorbée.
Calcul avant la combustion.
| 382L'air contenu dans la cloche occupoit un volume de 353 pouces. | ||
| Mais il n'étoit pressé que par une colonne de 27 pouces 9 lignes 1/2, ou en fractions décimales de pouces (voyez table, No. IV.) de | 27,79167 | pouces |
| Sur quoi il y a encore à déduire la différence de niveau de 4 pouces 1/2 d'eau; ce qui répond en mercure (voyez la table, No. V.) à | 0,33166 | |
| La pression réelle dont cet air étoit chargé, n'étoit donc que de | 27,46001 |
Le volume des fluides élastiques diminuant en général en raison inverse des poids qui les compriment, il est clair, d'après ce que nous avons dit plus haut, que pour avoir le volume des 353 pouces sous une pression de 28 pouces, il faudra dire:
353 pouces : x :: 1/27,46001 : 1/28
D'où l'on conclura:
x = (353 x 27,46001)/28 = 346,192 pouces. C'est le volume qu'auroit occupé ce même air sous une pression de vingt-huit pouces. Le 210e de ce volume égale 1,650 pouce; ce qui donné pour les 5 degrés supérieurs au dixième degré du thermomètre, 8,255 pouces; & comme cette correction est 383 soustractive, on en conclura que le volume de l'air, toute correction faite, étoit avant la combustion de 337,942 pouces.
Calcul après la combustion.
En faisant le même calcul sur le volume de l'air après la combustion, on trouvera que la pression étoit alors de 27,77083 pouces - 0,51593 pouces = 27,25490 pouces. Ainsi, pour avoir le volume de l'air à 28 pouces de pression, il faudra multiplier 295 pouces, volume trouvé après la combustion, par 27,25490 pouces, & le diviser par 28; ce qui donnera pour le volume corrigé, 287,150 pouces.
Le 210e de ce volume est 1,368 pouce, qui, multiplié par six degrés, donne pour correction négative de la température, 8,208 pouces.
D'où il résulte que le volume de l'air, toutes corrections faites, étoit après la combustion de 278,942 pouces.
Résultat.
| Le volume, toutes corrections faites, avant la combustion étoit de | 337,942 | pouces |
| Il étoit après la combustion de | 278,942 | |
| Donc quantité d'air absorbée par la combustion du phosphore | 59,000 |
384
§. VIII.
De la manière de déterminer le poids absolu des différens Gaz.
Dans tout ce que je viens d'exposer sur la manière de mesurer le volume des gaz & d'y faire les corrections relatives au degré de pression & de température, j'ai supposé qu'on en connoissoit la pesanteur spécifique, & qu'on pouvoit en conclure leur poids absolu: il me reste à donner une idée des moyens par lesquels on peut parvenir à cette connoissance.
On a un grand ballon A, planc. V, fig. 10, dont la capacité doit être d'un demi-pied cube, c'est-à-dire, de 17 à 18 pintes au moins; on y mastique une virole de cuivre bcde à laquelle s'adapte à vis en de, une platine à laquelle tient un robinet fg. Enfin le tout se visse, au moyen d'un double écrou représenté, figure 12, sur une cloche BCD dont la capacité doit être de quelques pintes plus grande que celle du ballon. Cette cloche est ouverte par le haut, & la tubulure est garnie d'une virole de cuivre hi, & d'un robinet lm; un de ces robinets est représenté séparément, figure 11.
La première opération à faire est de déterminer la capacité de ce ballon; on y parvient en 385 l'emplissant d'eau, & en le pesant pour en connoître la quantité. Ensuite on vuide l'eau, & on sèche le ballon en y introduisant un linge par l'ouverture de; les derniers vestiges d'humidité disparoissent d'ailleurs, lorsqu'on a fait une ou deux fois le vuide dans le ballon.
Quand on veut déterminer la pesanteur d'un gaz, on visse le ballon A sur la platine de la machine pneumatique, au-dessous du robinet fg. On ouvre ce même robinet, & on fait le vuide du mieux qu'il est possible ayant grand soin d'observer la hauteur à laquelle descend le baromètre d'épreuve. Le vuide fait, on referme le robinet, on pèse le ballon avec une scrupuleuse exactitude, après quoi on le revisse sur la cloche BCD, qu'on suppose placée sur la tablette de la cuve ABCD, même planche, fig. 1. On fait passer dans cette cloche le gaz qu'on veut peser; puis ouvrant le robinet fg & le robinet lm, le gaz contenu dans la cloche passe dans le ballon A: en même tems l'eau remonte dans la cloche BCD. Il est nécessaire, si l'on veut éviter une correction embarrassante, d'enfoncer la cloche dans la cuve jusqu'à ce que le niveau de l'eau extérieure concoure avec celui de l'eau contenue dans l'intérieur de la cloche. Alors on ferme les robinets, on dévisse le ballon & on le repèse. Le poids, déduction faite 386 de celui du ballon vuide, donne la pesanteur du volume d'air ou de gaz qu'il contient. En multipliant ce poids par 1728 pouces, & divisant le produit par un nombre de pouces cubes égal à la capacité du ballon, on a le poids du pied cube du gaz mis en expérience.
Il est nécessaire de tenir compte dans ces déterminations de la hauteur du baromètre & du degré du thermomètre; après quoi rien n'est plus aisé que de ramener le poids du pied cube qu'on a trouvé à celui qu'auroit eu le même gaz à 28 pouces de pression & à 10 degrés du thermomètre. J'ai donné dans le paragraphe précédent le détail des calculs qu'exige cette opération.
Il ne faut pas négliger non plus de tenir compte de la petite portion d'air restée dans le ballon, quand on a fait le vuide; portion qu'il est facile d'évaluer, d'après la hauteur à laquelle s'est soutenu le baromètre d'épreuve. Si cette hauteur étoit, par exemple, d'un centième de la hauteur totale du baromètre, il en faudroit conclure qu'il est resté un centième d'air dans le ballon, & le volume du gaz qui y avoit été introduit ne seroit plus que des 99/100 du volume total du ballon.
387
CHAPITRE III.
Des Appareils relatifs à la mesure du Calorique.
Description du Calorimètre.
L'Appareil dont je vais essayer de donner une idée a été décrit dans un mémoire que nous avons publié M. de la Place & moi dans le recueil de l'Académie, année 1780, page 355. C'est de ce mémoire que sera extrait tout ce que contient cet article.
Si après avoir refroidi un corps quelconque à zéro du thermomètre, on l'expose dans une atmosphère, dont la température soit de 25 degrés au-dessus du terme de la congélation, il s'échauffera insensiblement depuis sa surface jusqu'à son centre, & se rapprochera peu-à-peu de la température de 25 degrés qui est celle du fluide environnant.
Il n'en sera pas de même d'une masse de glace qu'on auroit placée dans la même atmosphère: elle ne se rapprochera nullement de la température de l'air ambiant, mais elle restera constamment à zéro de température, c'est-à-dire, 388 à la glace fondante, & ce, jusqu'à ce que le dernier atôme de glace soit fondu.
La raison de ce phénomène est facile à concevoir: il faut pour fondre de la glace, & pour la convertir en eau, qu'il s'y combine une certaine proportion de calorique. En conséquence, tout le calorique des corps environnans s'arrête à la surface de la glace où il est employé à la fondre: cette première couche fondue, la nouvelle quantité de calorique qui survient en fond une seconde, & elle se combine également avec elle pour la convertir en eau, & ainsi successivement de surfaces en surfaces, jusqu'au dernier atôme de glace qui sera encore à zéro du thermomètre, parce que le calorique n'aura pas encore pu y pénétrer.
Que l'on imagine d'après cela une sphère de glace creuse, à la température de zéro degré du thermomètre; que l'on place cette sphère de glace dans une atmosphère, dont la température soit, par exemple, de 10 degrés au-dessus de la congélation, & qu'on place dans son intérieur un corps échauffé d'un nombre de degrés quelconques: il suit de ce qu'on vient d'exposer deux conséquences; 1o. que la chaleur extérieure ne pénétrera pas dans l'intérieur de la sphère; 2o. que la chaleur d'un corps placé dans son intérieur ne se perdra pas non 389 plus au-dehors; mais qu'elle s'arrêtera à la surface intérieure de la cavité, où elle sera continuellement employée à fondre de nouvelles couches de glace, jusqu'à ce que la température du corps soit parvenue à zéro du thermomètre.
Si on recueille avec soin l'eau qui se sera formée dans l'intérieur de la sphère de glace, lorsque la température du corps placé dans son intérieur sera parvenue à zéro du thermomètre, son poids sera exactement proportionnel à la quantité de calorique que ce corps aura perdue, en passant de sa température primitive à celle de la glace fondante; car il est clair qu'une quantité double de calorique doit fondre une quantité double de glace; en sorte que la quantité de glace fondue est une mesure très-précise de la quantité de calorique employée à produire cet effet.
On n'a considéré ce qui se passoit dans une sphère de glace que pour mieux faire entendre la méthode que nous avons employée dans ce genre d'expériences, dont la première idée appartient à M. de la Place. Il seroit difficile de se procurer de semblables sphères, & elles auroient beaucoup d'inconvéniens dans la pratique; mais nous y avons suppléé au moyen de l'appareil suivant, auquel je donnerai le 390 nom de calorimètre. Je conviens que c'est s'exposer à une critique, jusqu'à un certain point fondée, que de réunir ainsi deux dénominations, l'une dérivée du latin, l'autre dérivée du grec; mais j'ai cru qu'en matière de science on pouvoit se permettre moins de pureté dans le langage, pour obtenir plus de clarté dans les idées; & en effet je n'aurois pu employer un mot composé entièrement tiré du grec, sans trop me rapprocher du nom d'autres instrumens connus, & qui ont un usage & un but tout différent.
La figure première de la planche VI représente le calorimètre vu en perspective. La figure 2 de la même planche représente sa coupe horisontale, & la figure 3 une coupe verticale qui laisse voir tout son intérieur. Sa capacité est divisée en trois parties; pour mieux me faire entendre, je les distinguerai par les noms de capacité intérieure, capacité moyenne, & capacité extérieure. La capacité intérieure ffff, fig. 3, pl. VI, est formée d'un grillage de fil de fer, soutenu par quelques montans du même métal; c'est dans cette capacité que l'on place les corps soumis à l'expérience: sa partie supérieure LM se ferme au moyen d'un couvercle GH représenté séparément, figure 4. Il est entièrement ouvert par-dessus, & le dessous 391 est formé d'un grillage de fil de fer.
La capacité moyenne bbbbb, figures 2 & 3, est destinée à contenir la glace qui doit environner la capacité intérieure, & que doit fondre le calorique du corps mis en expérience: cette glace est supportée & retenue par une grille mm sous laquelle est un tamis nn; l'un & l'autre sont représentés séparément, figures 5 & 6. A mesure que la glace est fondue par le calorique qui se dégage du corps placé dans la capacité intérieure, l'eau coule à travers la grille & le tamis; elle tombe ensuite le long du cône ccd, figure 3, & du tuyau xy, & se rassemble dans le vase F, figure 1, placé au-dessous de la machine; u est un robinet au moyen duquel on peut arrêter à volonté l'écoulement de l'eau intérieure. Enfin la capacité extérieure aaaaa, fig. 2 & 3 est destinée à recevoir la glace qui doit arrêter l'effet de la chaleur de l'air extérieur & des corps environnans: l'eau que produit la fonte de cette glace, coule le long du tuyau sT que l'on peut ouvrir ou fermer au moyen du robinet r. Toute la machine est recouverte par le couvercle FF, fig. 7, entièrement ouvert dans sa partie supérieure, & fermé dans sa partie inférieure; elle est composée de fer-blanc peint à l'huile pour le garantir de la rouille.
392
Pour mettre le calorimètre en expérience, on remplit de glace pilée la capacité moyenne bbbbb, & le couvercle GH de la capacité intérieure, la capacité extérieure aaaa, & le couvercle FF, figure 7, de toute la machine. On la presse fortement pour qu'il ne reste point de parties vuides, puis on laisse égouter la glace intérieure; après quoi on ouvre la machine pour y placer le corps que l'on veut mettre en expérience, & on la referme sur le champ. On attend que le corps soit entièrement refroidi, & que la glace qui a fondu soit suffisamment égoutée; ensuite on pèse l'eau qui s'est rassemblée dans le vase F, fig. 1: son poids est une mesure exacte de la quantité de calorique dégagée du corps, pendant qu'il s'est refroidi; car il est visible que ce corps est dans la même position qu'au centre de la sphère dont nous venons de parler, puisque tout le calorique qui s'en dégage est arrêté par la glace intérieure, & que cette glace est garantie de l'impression de toute autre chaleur, par la glace renfermée dans le couvercle & dans la capacité extérieure.
Les expériences de ce genre durent quinze, dix-huit & vingt heures; quelquefois pour les accélérer, on place de la glace bien égoutée dans la capacité intérieure, & on en couvre les corps que l'on veut refroidir.
393
La figure 8 représente un seau de tôle destiné à recevoir les corps sur lesquels on veut opérer; il est garni d'un couvercle percé dans son milieu, & fermé avec un bouchon de liége, traversé par le tube d'un petit thermomètre.
La figure 9 de la même planche représente un matras de verre dont le bouchon est également traversé par le tube d'un petit thermomètre, dont la boule & une partie du tube plonge dans la liqueur; il faut se servir de semblables matras toutes les fois que l'on opère sur les acides, & en général sur les substances qui peuvent avoir quelque action sur les métaux.
RS, figure 10, est un petit cylindre creux que l'on place au fond de la capacité intérieure pour soutenir les matras.
Il est essentiel que dans cette machine, il n'y ait aucune communication entre la capacité moyenne & la capacité extérieure; ce que l'on éprouvera facilement en remplissant d'eau la capacité extérieure. S'il existoit une communication entre ces capacités, la glace fondue par l'atmosphère dont la chaleur agit sur l'enveloppe de la capacité extérieure, pourroit passer dans la capacité moyenne, & alors l'eau qui s'écouleroit de cette dernière capacité, ne seroit plus la mesure du calorique perdu par le corps mis en expérience.
394
Lorsque la température de l'atmosphère n'est que de quelques degrés au-dessus de zéro, sa chaleur ne peut parvenir que très-difficilement jusque dans la capacité moyenne, puisqu'elle est arrêtée par la glace du couvercle & de la capacité extérieure; mais si la température extérieure étoit au-dessous de zéro, l'atmosphère pourroit refroidir la glace intérieure; il est donc essentiel d'opérer dans une atmosphère dont la température ne soit pas au-dessous de zéro: ainsi dans un tems de gelée, il faudra renfermer la machine dans un appartement dont on aura soin d'échauffer l'intérieur. Il est encore nécessaire que la glace dont on fait usage, ne soit pas au-dessous de zéro; si elle étoit dans ce cas, il faudroit la piler, l'étendre par couches fort minces, & la tenir ainsi pendant quelque tems dans un lieu dont la température fût au-dessus de zéro.
La glace intérieure retient toujours une petite quantité d'eau qui adhère à sa surface, & l'on pourroit croire que cette eau doit entrer dans le résultat des expériences: mais il faut observer qu'au commencement de chaque expérience, la glace est déjà imbibée de toute la quantité d'eau qu'elle peut ainsi retenir; en sorte que si une petite partie de la glace fondue par le corps, reste adhérente à la glace intérieure, 395 la même quantité, à très-peu près, d'eau primitivement adhérente à la surface de la glace, doit s'en détacher & couler dans le vase: car la surface de la glace intérieure change extrêmement peu dans l'expérience.
Quelques précautions que nous ayons prises, il nous a été impossible d'empêcher l'air extérieur de pénétrer dans la capacité intérieure, lorsque la température étoit à 9 ou 10 degrés, au-dessus de la congélation. L'air renfermé dans cette capacité étant alors spécifiquement plus pesant que l'air extérieur, il s'écoule par le tuyau xy, fig. 3, & il est remplacé par l'air extérieur qui entre dans le calorimètre, & qui dépose une partie de son calorique sur la glace intérieure: il s'établit ainsi dans la machine un courant d'air d'autant plus rapide, que la température extérieure est plus élevée, ce qui fond continuellement une portion de la glace intérieure; on peut arrêter en grande partie l'effet de ce courant, en fermant le robinet; mais il vaut beaucoup mieux n'opérer que lorsque la température extérieure ne surpasse pas 3 ou 4 degrés; car nous avons observé qu'alors la fonte de la glace intérieure, occasionnée par l'atmosphère, est insensible, en sorte que nous pouvons à cette température, répondre de l'exactitude de nos expériences sur les chaleurs spécifiques des corps, à un quarantième près.
396
Nous avons fait construire deux machines pareilles à celle que je viens de décrire; l'une d'elles est destinée aux expériences dans lesquelles il n'est pas nécessaire de renouveller l'air intérieur; l'autre machine sert aux expériences dans lesquelles le renouvellement de l'air est indispensable, telles que celles de la combustion & de la respiration: cette seconde machine ne differe de la première, qu'en ce que les deux couvercles sont percés de deux trous à travers lesquels passent deux petits tuyaux qui servent de communication entre l'air intérieur & l'air extérieur; on peut par leur moyen souffler de l'air atmosphérique dans l'intérieur du calorimètre pour y entretenir des combustions.
Rien n'est plus simple avec cet instrument que de déterminer les phénomènes qui ont lieu dans les opérations où il y a dégagement, ou même absorption de calorique. Veut-on, par exemple, connoître ce qui se dégage de calorique d'un corps solide, lorsqu'il se refroidit d'un certain nombre de degrés? On élève sa température à 80 degrés, par exemple, puis on le place dans la capacité intérieure ffff du calorimètre, figures 2 & 3, planche VI, & on l'y laisse assez long-tems pour être assuré que sa température est revenue à zéro du thermomètre: on recueille l'eau qui a été produite 397 par la fonte de la glace, pendant son refroidissement; cette quantité d'eau divisée par le produit de la masse du corps & du nombre de degrés dont sa température primitive étoit au-dessus de zéro, sera proportionnelle à ce que les physiciens anglois ont nommé chaleur spécifique.
Quant aux fluides on les renferme dans des vases de matière quelconque, dont on a préalablement déterminé la chaleur spécifique: on opère ensuite de la même manière que pour les solides, en observant seulement de déduire de la quantité totale d'eau qui a coulé, celle due au refroidissement du vase qui contenoit le fluide.
Veut-on connoître la quantité de calorique qui se dégage de la combinaison de plusieurs substances? on les amenera toutes à la température zéro, en les tenant un tems suffisant dans de la glace pilée; ensuite on en fera le mélange dans l'intérieur du calorimètre, dans un vase également à zéro, & on aura soin de les y conserver jusqu'à ce qu'elles soient revenues à la température zéro; la quantité d'eau recueillie sera la mesure du calorique qui se sera dégagé par l'effet de la combinaison.
La détermination des quantités de calorique qui se dégagent dans les combustions & dans 398 la respiration des animaux, n'offre pas plus de difficulté: on brûle les corps combustibles dans la capacité intérieure du calorimètre; on y laisse respirer des animaux tels que des cochons d'inde qui résistent assez bien au froid, & on recueille l'eau qui coule: mais comme le renouvellement de l'air est indispensable dans ce genre d'opérations, il est nécessaire de faire arriver continuellement de nouvel air dans l'intérieur du calorimètre par un petit tuyau destiné à cet objet, & de le faire ressortir par un autre tuyau: mais pour que l'introduction de cet air ne cause aucune erreur dans les résultats, on fait passer le tuyau qui doit l'amener à travers de la glace pilée, afin qu'il arrive dans le calorimètre, à la température zéro. Le tuyau de sortie de l'air doit également traverser de la glace pilée, mais cette dernière portion de glace doit être comprise dans l'intérieur de la capacité ffff du calorimètre, & l'eau qui en découle doit faire partie de celle que l'on recueille, parce que le calorique que contenoit l'air avant de sortir fait partie du produit de l'expérience.
La recherche de la quantité de calorique spécifique contenue dans les différens gaz, est un peu plus difficile à cause de leur peu de densité; car si on se contentoit de les renfermer 399 dans des vases comme les autres fluides, la quantité de glace fondue seroit si peu considérable que le résultat de l'expérience seroit au moins très-incertain. Nous avons employé pour ce genre d'expériences deux espèces de serpentins ou tuyaux métalliques roulés en spirales. Le premier contenu dans un vase rempli d'eau bouillante servoit à échauffer l'air avant qu'il parvînt au calorimètre; le second étoit renfermé dans la capacité intérieure ffff de cet instrument. Un thermomètre adapté à une des extrémités de ce dernier serpentin, indiquoit la chaleur de l'air ou du gaz qui entroit dans la machine; un thermomètre adapté à l'autre extrémité du même serpentin indiquoit la chaleur du gaz ou de l'air à sa sortie. Nous avons été ainsi à portée de déterminer ce qu'une masse quelconque de différens airs ou gaz fondoit de glace en se refroidissant d'un certain nombre de degrés, & d'en déterminer le calorique spécifique. Le même procédé, avec quelques précautions particulières peut être employé pour connoître la quantité de calorique qui se dégage dans la condensation des vapeurs de différens liquides.
Les différentes expériences que l'on peut faire avec le calorimètre, ne conduisent point à des résultats absolus; elles ne donnent que 400 des quantités relatives: il étoit donc question de choisir une unité qui pût former le premier degré d'une échelle avec laquelle on pût exprimer tous les autres résultats. La quantité de calorique nécessaire pour fondre une livre de glace, nous a fourni cette unité: or pour fondre une livre de glace, il faut une livre d'eau élevée à 60 degrés du thermomètre à mercure divisé en 80 parties, de la glace à l'eau bouillante; la quantité de calorique qu'exprime notre unité, est donc celle nécessaire pour élever l'eau de zéro à 60 degrés.
Cette unité déterminée, il n'est plus question que d'exprimer en valeurs analogues les quantités de calorique qui se dégagent des différens corps, en se refroidissant, d'un certain nombre de degrés, & voici le calcul simple par le moyen duquel on y parvient: je l'applique à une de nos premières expériences.
Nous avons pris des morceaux de tôle coupés par bandes & roulés, qui pesoient ensemble 7 livres 11 onces 2 gros 36 grains, c'est-à-dire en fractions décimales de livres, 7,7070319 livres. Nous avons échauffé cette masse dans un bain d'eau bouillante, dans laquelle elle a pris environ 78 degrés de chaleur; & l'ayant tirée de l'eau prestement, nous l'avons introduite dans la capacité intérieure du calorimètre. 401 Au bout de onze heures, lorsque l'eau produite par la fonte de la glace intérieure a été suffisamment égoutée, la quantité s'en est trouvée de 1 livre 1 once 5 gros 4 grains = 1,109795 livre. Maintenant je puis dire si le calorique dégagé de la tôle par un refroidissement de 78 degrés, a fondu 1,109795 livre de glace, combien un refroidissement de 60 degrés auroit-il produit; ce qui donne 78 : 1,109795 : : 60 : x = 0,85369 livre. Enfin divisant cette quantité par le nombre de livres de tôle employée, c'est-à-dire par 7,7070319 livres, on aura pour la quantité de glace que pourra faire fondre une livre de tôle en se refroidissant de 60 degrés à zéro, 0,110770 livre. Le même calcul s'applique à tous les corps solides.
A l'égard des fluides, tels que l'acide sulfurique, l'acide nitrique, &c. on les renferme dans un matras représenté planche VI, fig. 9. Il est bouché avec un bouchon de liège traversé par un thermomètre dont la boule plonge dans la liqueur. On place ce vaisseau dans un bain d'eau bouillante; & lorsque d'après le thermomètre on juge que la liqueur est élevée à un degré de chaleur convenable, on retire le matras & on le place dans le calorimètre. On fait le calcul comme ci-dessus, en ayant 402 soin cependant de déduire de la quantité d'eau obtenue, celle que le vase de verre auroit seul produite, & qu'il est en conséquence nécessaire d'avoir déterminé par une expérience préalable. Je ne donne point ici le tableau des résultats que nous avons obtenus, parce qu'il n'est pas encore assez complet, & que différentes circonstances ont suspendu la suite de ce travail. Nous ne le perdons cependant pas de vue, & il n'y a point d'hiver que nous ne nous en soyons plus ou moins occupés.

403
CHAPITRE IV.
Des opérations purement mécaniques qui ont pour objet de diviser les corps.
§. PREMIER.
De la Trituration, de la Porphirisation, & de la Pulvérisation.
La trituration, la porphirisation & la pulvérisation ne sont, à proprement parler, que des opérations mécaniques préliminaires, dont l'objet est de diviser, de séparer les molécules des corps, & de les réduire en particules très-fines. Mais quelque loin qu'on puisse porter ces opérations, elles ne peuvent jamais résoudre un corps en ses molécules primitives & élémentaires: elles ne rompent pas même, à proprement parler, son aggrégation; en sorte que chaque molécule après la trituration & la porphirisation, forme encore un tout semblable à la masse originaire qu'on avoit eu pour objet de diviser, à la différence des opérations vraiment chimiques, telles, par exemple, que la dissolution qui détruit l'aggrégation du corps, & écarte les 404 unes des autres les molécules constitutives & intégrantes qui le composent.
Toutes les fois qu'il est question de diviser des corps fragiles & cassans, on se sert pour cette opération de mortiers & de pilons, figures 1, 2, 3, 4 & 5, planche I. Ces mortiers sont ou de fonte de cuivre & de fer comme celui représenté, figure 1; ou de marbre & de granit, comme celui représenté, figure 2; ou de bois de gayac, comme celui représenté, figure 3; ou de verre, comme celui représenté, figure 4; ou d'agathe, comme celui représenté, figure 5: enfin on en fait aussi de porcelaine, comme celui représenté, figure 6. Les pilons dont on se sert pour triturer les corps sont aussi de différentes matières. Ils sont de fer ou de cuivre forgé, comme dans la figure première, de bois, comme dans les figures 2 & 3; enfin de verre, de porcelaine ou d'agathe, suivant la nature des objets qu'on veut triturer. Il est nécessaire d'avoir dans un laboratoire, un assortiment de ces instrumens de différente grandeur. Les mortiers de porcelaine, & sur-tout ceux de verre, ne peuvent pas être employés à la trituration proprement dite, & ils seroient bientôt en pièces si on frappoit dedans, sans précaution, à coups redoublés. C'est en tournant le pilon dans le mortier, en froissant avec adresse 405 & dextérité les molécules entre le pilon & les parois du mortier qu'on parvient à opérer la division.
La forme des mortiers n'est point indifférente; le fond en doit être arrondi, & l'inclinaison des parois latérales doit être telle que les matières en poudre retombent d'elles-mêmes quand on relève le pilon: un mortier trop plat seroit donc défectueux, la matière ne retomberoit & ne se retourneroit pas. Des parois trop inclinées présenteroient un autre inconvénient, elles rameneroient une trop grande quantité de la matière à pulvériser sous le pilon, elle ne seroit plus alors froissée & serrée entre deux corps durs, & la trop grande épaisseur interposée nuiroit à la pulvérisation.
Par une suite du même principe, il ne faut pas mettre dans le mortier une trop grande quantité de matière; il faut sur-tout, autant qu'on le peut, se débarrasser de tems en tems des molécules qui sont déjà pulvérisées, & c'est ce qu'on opère par le tamisage, autre opération dont il va être bientôt question. Sans cette précaution on employeroit une force inutile, & on perdroit du tems à diviser davantage ce qui l'étoit suffisamment, tandis qu'on n'acheveroit pas de pulvériser ce qui ne l'est pas assez. En effet, la portion de matière divisée nuit à la 406 trituration de celle qui ne l'est pas; elle s'interpose entre le pilon & le mortier, & amortit l'effet du coup.
La porphirisation a reçu sa dénomination du nom de la matière sur laquelle elle s'opère. Le plus communément on a une table plate de porphire ou d'une autre pierre du même degré de dureté ABCD, planche I, fig. 7, sur laquelle on étend la matière qu'on se propose de diviser; on la froisse ensuite & on la broye en promenant sur le porphire une molette M, d'une pierre du même degré de dureté. La partie de la molette qui porte sur le porphire, ne doit pas être parfaitement plane: sa surface doit être une portion de sphère d'un très-grand rayon; autrement quand on promeneroit la molette sur le porphire, la matière se rangeroit tout autour du cercle qu'elle auroit décrit, sans qu'aucune portion s'engageât entre deux, & il n'y auroit pas de porphirisation. On est par la même raison obligé de faire retailler de tems en tems les molettes, qui tendent à devenir planes, à mesure qu'on s'en sert. L'effet de la molette étant d'écarter continuellement la matière & de la porter vers les extrêmités de la table de porphire, on est obligé de la ramener souvent & de l'accumuler au centre: on se sert à cet 407 effet d'un couteau de fer, de corne ou d'ivoire, dont la lame doit être très-mince.
Dans les travaux en grand on préfère, pour opérer le broyement, l'usage de grandes meules de pierres dures qui tournent l'une sur l'autre, ou bien d'une meule verticale qui roule sur une meule horisontale. Dans tous ces cas, on est souvent obligé d'humecter légèrement la matière, dans la crainte qu'elle ne s'élève en poussière.
Ces trois manières de réduire les corps en poudre, ne conviennent pas à toutes les matières: il en est qu'on ne peut parvenir à diviser, ni au pilon, ni au porphire, ni à la meule; telles sont les matières très-fibreuses, comme le bois; telles sont celles qui ont une sorte de ténacité & d'élasticité, comme la corne des animaux, la gomme élastique, &c. tels sont enfin les métaux ductiles & malléables, qui s'applatissent sous le pilon au lieu de s'y réduire en poudre.
On se sert pour les bois de grosses limes connues sous le nom de rapes à bois, pl. I, fig. 8. On se sert pour la corne de limes un peu plus fines; enfin on emploie pour les métaux des limes encore plus fines, telles sont celles représentées figures 9 & 10.
Il est quelques substances métalliques qui ne 408 sont ni assez cassantes pour être mises en poudre par trituration, ni assez dures pour pouvoir être limées commodément. Le zinc est dans ce cas; sa demi-malléabilité empêche qu'on ne puisse le pulvériser au mortier: si on le lime il empâte la lime, il en remplit les interstices, & bientôt elle n'a presque plus d'action. Il y a une manière simple pour réduire le zinc en poudre, c'est de le piler chaud dans un mortier de fonte de fer également chaud; il s'y triture alors aisément. On peut encore le rendre cassant, en le fondant avec un peu de mercure. Les artificiers qui employent le zinc pour faire des feux bleus, ont recours à l'un de ces deux moyens. Quand on n'a pas pour objet de mettre les métaux dans un très-grand état de division, on peut les réduire en grenailles en les coulant dans de l'eau.
Enfin il y a un dernier moyen de diviser, qu'on emploie pour les matières à la fois pulpeuses & fibreuses, telles que les fruits, les pommes de terre, les racines, &c. On les promène sur une rape, planche I, fig. 11, en donnant un certain degré de pression, & on parvient ainsi à les réduire en pulpe. Tout le monde connoît la rape, & il seroit superflu d'en donner une description plus étendue.
409
On conçoit que le choix des matières avec lesquelles on opère la trituration, n'est point indifférent: on doit bannir le cuivre de tout ce qui a rapport aux alimens, à la pharmacie, &c. Les mortiers de marbre ou ceux de matières métalliques ne peuvent être employés pour triturer les matières acides; c'est ce qui fait que les mortiers de bois très-dur, tel que le gayac & ceux de verre de porcelaine & de granit, sont d'une grande commodité dans un laboratoire.
§. II.
Du Tamisage & du Lavage.
De quelque moyen mécanique qu'on se serve pour diviser les corps, on ne peut parvenir à donner le même degré de finesse à toutes leurs parties. La poudre qu'on obtient de la plus longue & de la plus exacte trituration, est toujours un assemblage & un mêlange de molécules de différentes grosseurs. On parvient à se débarrasser des plus grossières, & à n'avoir qu'une poudre beaucoup plus homogène, en employant des tamis, figures 12, 13, 14 & 15, planche I, dont la grandeur de la maille soit proportionnée à la grosseur des molécules qu'on se propose d'obtenir: tout ce qui est supérieur en grosseur aux dimensions de la maille, reste 410 sur le tamis, & on le repasse au pilon.
On voit deux de ces tamis représentés figures 12 & 13. L'un, fig. 12, est de crin ou de soie; l'autre, fig. 13, est de peau dans laquelle on a fait des trous ronds avec un emporte-pièce: ce dernier est en usage dans l'art de fabriquer la poudre à canon & la poudre de chasse. Lorsqu'on est obligé de tamiser des matières très-légères, très-précieuses & qui se dispersent aisément; ou bien lorsque répandues dans l'air elles peuvent être nuisibles à ceux qui les respirent, on se sert de tamis composés de trois pièces, fig. 14 & 15; savoir d'un tamis proprement dit ABCD, fig. 15, d'un couvercle EF, & d'un fond GH: on voit ces trois parties assemblées, fig. 14.
Il est un autre moyen plus exact que le tamisage, d'obtenir des poudres de grosseur uniforme, c'est le lavage; mais il n'est praticable qu'à l'égard des matières qui ne sont point susceptibles d'être attaquées & altérées par l'eau. On délaye & on agite dans l'eau ou dans quelqu'autre liqueur les matières broyées qu'on veut obtenir en poudres de grosseur homogène; on laisse reposer un moment la liqueur, puis on la décante encore trouble; les parties les plus grossières restent au fond du vase. On décante une seconde fois, & on a un second dépôt 411 moins grossier que le premier. On décante une troisième fois pour obtenir un troisième dépôt, qui est au second pour la finesse ce que le second est au premier. On continue cette manœuvre jusqu'à ce que l'eau soit éclaircie; & la poudre grossière & inégale qu'on avoit originairement, se trouve séparée en une suite de dépôts qui, chacun en particulier, sont d'un degré de finesse à peu près homogène.
Le même moyen, le lavage, ne s'emploie pas seulement pour séparer les unes des autres les molécules de matières homogènes, & qui ne différent que par leur degré plus ou moins grand de division; il fournit une ressource non moins utile pour séparer des matières du même degré de finesse, mais dont la pesanteur spécifique est différente: c'est principalement dans le travail des mines qu'on fait usage de ce moyen.
On se sert pour le lavage dans les laboratoires, de vaisseaux de différentes formes, de terrines de grès, de bocaux de verre, &c. quelquefois pour décanter la liqueur sans troubler le dépôt qui s'est formé, on emploie le siphon. Cet instrument consiste en un tube de verre ABC, planche II, fig. 11, recourbé en B, & dont la branche BC doit être plus longue de quelques pouces que celle AB. Pour 412 n'être point obligé de le tenir à la main, ce qui pourroit être fatiguant dans quelques expériences, on le passe dans un trou pratiqué au milieu d'une petite planche DE. L'extrémité A du siphon doit être plongée dans la liqueur du bocal FG, à la profondeur jusqu'à laquelle on se propose de vuider le vase.
D'après les principes hydrostatiques sur lesquels est fondé l'effet du siphon, la liqueur ne peut y couler qu'autant qu'on a chassé l'air contenu dans son intérieur: c'est ce qui se pratique au moyen d'un petit tube de verre HI, soudé hermétiquement à la branche BC. Lors donc qu'on veut procurer par le moyen du siphon l'écoulement de la liqueur du vase FG dans celui LM, on commence par boucher avec le bout du doigt l'extrémité C de la branche BC du siphon; puis on suce avec la bouche, jusqu'à ce qu'on ait retiré tout l'air du tube & qu'il ait été remplacé par de la liqueur: alors on ôte le doigt, la liqueur coule & continue à passer du vase FG dans celui LM.
§. III.
De la Filtration.
On vient de voir que le tamisage étoit une opération par laquelle on séparoit les unes des 413 autres des molécules de différentes grosseurs; que les plus fines passoient à travers le tamis, tandis que les plus grossières restoient dessus.
Le filtre n'est autre chose qu'un tamis très-fin & très-serré, à travers lequel les parties solides, quelque divisées qu'elles soient, ne peuvent passer, mais qui est cependant perméable pour les fluides; le filtre est donc, à proprement parler, l'espèce de tamis qu'on employe pour séparer des molécules solides qui sont très-fines, d'un fluide dont les molécules sont encore plus fines.
On se sert à cet effet, principalement en pharmacie, d'étoffes épaisses & d'un tissu très serré: celles de laine à poils sont les plus propres à remplir cet objet. On leur donne ordinairement la forme d'un cône, planche II, fig. 2: cette espèce de filtre porte le nom de chausse qui est relatif à sa figure. La forme conique a l'avantage de réunir toute la liqueur qui coule, en un seul point A, & on peut alors la recevoir dans un vase d'une ouverture très-petite; ce qui ne pourroit pas avoir lieu, si la liqueur couloit de plusieurs points. Dans les grands laboratoires de pharmacie, on a un chassis de bois représenté planche II, fig. 1, dans le milieu duquel on attache la chausse.
La filtration à la chausse ne peut être applicable 414 qu'à quelques opérations de pharmacie; mais comme dans la plupart des opérations chimiques un même filtre ne peut servir qu'à une même nature d'expériences, comme il faudroit avoir un nombre de chausses considérables & les laver avec un grand soin à chaque opération, on y a substitué une étoffe très-commune, à très-bon marché, qui est à la vérité très-mince, mais qui, attendu qu'elle est feutrée, compense par le serré de son tissu ce qui pourroit lui manquer en épaisseur: cette étoffe est du papier non collé. Il n'est aucun corps solide, quelque divisé qu'il soit, qui passe à travers les pores des filtres de papier; les fluides au contraire les traversent avec beaucoup de facilité.
Le seul embarras que présente le papier employé comme filtre, consiste dans la facilité avec laquelle il se perce & se déchire, sur-tout quand il est mouillé. On remédie à cet inconvénient, en le soutenant par le moyen de diverses espèces de doublures. Si on a des quantités considérables de matières à filtrer, on se sert d'un chassis de bois ABCD, planc. II, fig. 3, auquel sont adaptées des pointes de fer ou crochets: on pose ce chassis sur deux petits traiteaux, comme on le voit fig. 4. On place sur le quarré une toile grossière, qu'on 415 tend médiocrement & qu'on accroche aux pointes ou crochets de fer. On étend ensuite une ou deux feuilles de papier sur la toile, & on verse dessus le mêlange de matière liquide & de matière solide dont on veut opérer la séparation. Le fluide coule dans la terrine ou autre vase quelconque F, qu'on a mis sous le filtre. Les toiles qui ont servi à cet usage, se lavent, ou bien on les renouvelle, si on a lieu de craindre que les molécules dont elles peuvent rester imprégnées, ne soient nuisibles dans des opérations subséquentes.
Dans toutes les opérations ordinaires & lorsqu'on n'a qu'une médiocre quantité de liqueur à filtrer, on se sert d'entonnoirs de verre, planche II, fig. 5, pour contenir & soutenir le papier; on le plie alors de manière à former un cône de même figure que l'entonnoir. Mais alors on tombe dans un autre inconvénient; le papier, lorsqu'il est mouillé, s'applique tellement sur les parois du verre, que la liqueur ne peut couler & qu'il ne s'opère de filtration que par la pointe du cône: alors l'opération devient très-longue; les matières hétérogènes d'ailleurs que contient la liqueur étant communément plus lourdes que l'eau, elles se rassemblent à la pointe du cône de papier, elles l'obstruent, & la filtration ou s'arrête, ou devient 416 excessivement lente. On a imaginé différens procédés pour remédier à ces inconvéniens, qui sont plus graves qu'on ne le croiroit d'abord, parce qu'ils se répètent tous les jours dans le cours des opérations chimiques. Un premier moyen a été de multiplier les plis du papier, comme on le voit fig. 6, afin que la liqueur, en suivant les sillons que forment les plis, pût arriver à la pointe du cône: d'autres ont joint à ce premier moyen l'usage de fragmens de paille, qu'on place & qu'on arrange dans l'entonnoir avant d'y placer le papier. Enfin, le dernier moyen employé & qui me paroît réunir le plus d'avantages, consiste à prendre de petites bandes de verre, telles qu'on en trouve chez tous les vitriers, & qui sont connues sous le nom de rognures de verre. On les courbe par le bout à la lampe, de manière à former un crochet qui s'ajuste dans le bord supérieur de l'entonnoir; on en dispose six à huit de cette manière, avant de placer le papier. Ces bandes de verre le maintiennent à une distance suffisante des parois de l'entonnoir, pour que la filtration s'opère. La liqueur coule le long des bandes de verre, & se rassemble à la pointe du cône.
On voit quelques-unes de ces bandes représentées fig. 8: on voit aussi fig. 7 un entonnoir 417 de verre garni de bandes de verre & d'un papier à filtrer.
Lorsqu'on a un grand nombre de filtrations à faire marcher à la fois, il est très-commode d'avoir une planche AB, planche II, fig. 9, soutenue par des montans de bois AC, BD, & percée de trous pour y placer les entonnoirs.
Il y a des matières très-épaisses & très-visqueuses qui ne peuvent passer à travers le papier, & qui ne peuvent être filtrées qu'après avoir subi quelques préparations. La plus ordinaire consiste à battre un blanc d'œuf, à le diviser dans ces liqueurs, & à les faire chauffer jusqu'à l'ébullition. Le blanc d'œuf se coagule, il se réduit en écume, qui vient monter à la surface & qui entraîne avec elle la plus grande partie des matières visqueuses qui s'opposoient à la filtration. On est obligé de prendre ce parti pour obtenir du petit-lait clair, autrement il seroit très-difficile de le faire passer par le filtre. On remplit le même objet à l'égard des liqueurs spiritueuses, avec un peu de colle de poisson délayée dans de l'eau: cette colle se coagule par l'action de l'alkool, sans qu'on soit obligé de faire chauffer.
On conçoit qu'une des conditions indispensables de la filtration est que le filtre ne puisse pas être attaqué & corrodé par la liqueur qui 418 doit y passer; aussi ne peut-on pas filtrer les acides concentrés à travers le papier. Il est vrai qu'on est rarement obligé d'avoir recours à ce moyen, parce que la plupart des acides s'obtiennent par voie de distillation, & que les produits de la distillation sont presque toujours clairs. Si cependant dans quelques cas très-rares, on est forcé de filtrer des acides concentrés, on se sert alors de verre pilé, ou, ce qui est mieux encore, de morceaux de quartz ou de cristal de roche grossièrement concassés & en partie réduits en poudre. On place quelques-uns des plus gros morceaux dans le fond de l'entonnoir, pour le boucher en partie; on met par dessus des morceaux moins gros, qui sont maintenus par les premiers; enfin les portions les plus divisées doivent occuper le dessus: on remplit ensuite l'entonnoir avec de l'acide.
Dans les usages de la société, on filtre l'eau des rivières pour l'obtenir limpide & séparée des substances hétérogènes qui la salissent: on se sert à cet effet de sable de rivière. Le sable réunit plusieurs avantages qui le rendent propre à cet usage: premièrement, il est en fragmens arrondis, ou au moins dont les angles sont usés; & les intervalles que présentent des molécules de cette figure, favorisent le passage de l'eau. Secondement, ces molécules sont de différentes 419 grosseurs, & les plus fines se rangent naturellement entre les plus grosses; elles empêchent donc qu'il ne se rencontre des vuides trop grands qui laisseroient passer des matières hétérogènes. Troisièmement enfin, le sable ayant été roulé & lavé par l'eau des rivières pendant une longue révolution de tems, on est sûr qu'il est dépouillé de toute substance soluble dans l'eau, & que par conséquent il ne peut absolument rien communiquer à l'eau qui filtre au travers.
Dans tous les cas, comme dans celui-ci, où le même filtre doit servir long-tems, il s'engorgeroit & la liqueur cesseroit d'y passer si on ne le nétoyoit pas. Cette opération est simple à l'égard des filtres de sable, il ne s'agit que de le laver dans plusieurs eaux successives & jusqu'à ce qu'elle sorte claire.
§. IV.
De la Décantation.
La décantation est une opération qui peut suppléer à la filtration & qui, comme elle, a pour objet de séparer d'avec un liquide les molécules concrètes qu'il contient. On laisse à cet effet reposer la liqueur dans des vases ordinairement coniques & qui ont la forme de verres à boire, comme celui représenté ABCDE, 420 planche II, fig. 10. On fait dans les verreries des vases de cette figure, qui sont de différentes grandeurs; lorsqu'ils excèdent deux ou trois pintes de capacité, on supprime le pied CDE, & on y supplée par un pied de bois dans lequel on les mastique. La matière étrangère se dépose au fond de ces vases par un repos plus ou moins long, & on obtient la liqueur claire en la versant doucement par inclinaison. On voit que cette opération suppose que le corps suspendu dans le liquide est spécifiquement plus lourd que lui, & susceptible de se rassembler au fond: mais quelquefois la pesanteur spécifique du dépôt approche tellement de celle de la liqueur, & l'on est si près de l'équilibre, que le moindre mouvement suffit pour le remêler; alors au lieu de transvaser la liqueur & de la séparer par décantation, on se sert du siphon représenté fig. II, & dont j'ai déjà donné la description.
Dans toutes les expériences où l'on veut déterminer avec une précision rigoureuse le poids de la matière précipitée, la décantation est préférable à la filtration, pourvu qu'on ait soin de laver à grande eau & à plusieurs reprises le précipité. On peut bien, il est vrai, déterminer le poids du précipité qu'on a séparé par filtration, en pesant le filtre avant & après l'opération; 421 l'augmentation de poids que le filtre a acquise, donne le poids du précipité qui y est resté attaché: mais quand les quantités sont peu considérables, la dessication plus ou moins grande du filtre, les différentes proportions d'humidité qu'il peut retenir, sont une source d'erreurs qu'il est important d'éviter.

422
CHAPITRE V.
Des moyens que la Chimie emploie pour écarter les unes des autres les molécules des corps sans les décomposer, & réciproquement pour les réunir.
J'ai déjà fait observer qu'il existoit deux manières de diviser les corps: la première qu'on nomme division méchanique, consiste à séparer une masse solide en un grand nombre d'autres masses beaucoup plus petites. On emploie pour remplir cet objet la force des hommes, celle des animaux, la pesanteur de l'eau appliquée aux machines hydrauliques, la force expansive de l'eau réduite en vapeurs, comme dans les machines à feu, l'impulsion du vent, &c. Mais toutes ces forces employées à diviser les corps, sont beaucoup plus bornées qu'on ne le croit communément. Avec un pilon d'un certain poids, qui tombe d'une certaine hauteur, on ne peut jamais réduire en poudre une matière donnée au-delà d'un certain degré de finesse, & la même molécule qui paroît si fine relativement à nos organes est encore une montagne, si on peut se servir de cette expression, lorsqu'on la compare avec les molécules constitutives 423 & élémentaires du corps que l'on divise. C'est en cela que diffèrent les agens méchaniques des agens chimiques; ces derniers divisent un corps dans ses molécules primitives. Si, par exemple, c'est un sel neutre, ils portent la division de ses parties aussi loin qu'elle le peut être sans que la molécule cesse d'être une molécule de sel. Je vais donner dans ce chapitre des exemples de cette espèce de division. J'y joindrai quelques détails sur des opérations qui y sont relatives.
§. I.
De la Solution des Sels.
On a long-tems confondu en chimie la solution & la dissolution, & l'on désignoit par le même nom la division des parties d'un sel dans un fluide tel que l'eau, & la division d'un métal dans un acide. Quelques réflexions sur les effets de ces deux opérations feront sentir qu'il n'est pas possible de les confondre.
Dans la solution des sels, les molécules salines sont simplement écartées les unes des autres, mais ni le sel, ni l'eau n'éprouvent aucune décomposition, & on peut les retrouver l'un & l'autre en même quantité qu'avant l'opération. On peut dire la même chose de la dissolution des résines dans l'alkool & dans les dissolvans 424 spiritueux. Dans la dissolution des métaux, au contraire, il y a toujours ou décomposition de l'acide, ou décomposition de l'eau: le métal s'oxygène, il passe à l'état d'oxide; une substance gazeuse se dégage; en sorte, qu'à proprement parler, aucune des substances après la dissolution n'est dans le même état où elle étoit auparavant. C'est uniquement de la solution dont il sera question dans cet article.
Pour bien saisir ce qui se passe dans la solution des sels, il faut savoir qu'il se complique deux effets dans la plupart de ces opérations: solution par l'eau, & solution par le calorique; & comme cette distinction donne l'explication de la plupart des phénomènes relatifs à la solution, je vais insister pour la bien faire entendre.
Le nitrate de potasse, vulgairement appelé salpêtre, contient très-peu d'eau de cristallisation; une foule d'expériences le prouvent; peut-être même n'en contient-il pas: cependant il se liquéfie à un degré de chaleur qui surpasse à peine celui de l'eau bouillante. Ce n'est donc point à l'aide de son eau de cristallisation qu'il se liquéfie, mais parce qu'il est très-fusible de sa nature; & qu'il passe de l'état solide à l'état liquide, un peu au-dessus de la chaleur de l'eau bouillante. Tous les sels sont de même susceptibles d'être liquéfiés par le calorique; mais à 425 une température plus ou moins haute. Les uns, comme les acétites de potasse & de soude, se fondent & se liquéfient à une chaleur très-médiocre; les autres, au contraire, comme le sulfate de chaux, le sulfate de potasse, &c. exigent une des plus fortes chaleurs que nous puissions produire. Cette liquéfaction des sels par le calorique présente exactement les mêmes phénomènes que la liquéfaction de la glace. Premièrement elle s'opère de même à un degré de chaleur déterminé pour chaque sel, & ce degré est constant pendant tout le tems que dure la liquéfaction du sel. Secondement, il y a emploi de calorique au moment où le sel se fond, dégagement lorsqu'il se fige; tous phénomènes généraux, & qui ont lieu lors du passage d'un corps quelconque de l'état concret à l'état fluide & réciproquement.
Ces phénomènes de la solution par le calorique se compliquent toujours plus ou moins avec ceux de la solution par l'eau. On en sera convaincu si l'on considère qu'on ne peut verser de l'eau sur un sel pour le dissoudre, sans employer réellement un dissolvant mixte, l'eau & le calorique: or on peut distinguer plusieurs cas différens, suivant la nature & la manière d'être de chaque sel. Si par exemple un sel est très-peu soluble par l'eau, & qu'il le soit beaucoup 426 par le calorique, il est clair que ce sel sera très-peu soluble à l'eau froide, & qu'il le sera beaucoup, au contraire, à l'eau chaude; tel est le nitrate de potasse, & sur-tout le muriate oxigéné de potasse. Si un autre sel au contraire est à la fois peu soluble dans l'eau, & peu soluble dans le calorique, il sera peu soluble dans l'eau froide comme dans l'eau chaude, & la différence ne sera pas très-considérable; c'est ce qui arrive au sulfate de chaux.
On voit donc qu'il y a une relation nécessaire entre ces trois choses; solubilité d'un sel dans l'eau froide, solubilité du même sel dans l'eau bouillante, degré auquel ce même sel se liquéfie par le calorique seul & sans le secours de l'eau; que la solubilité d'un sel à chaud & à froid est d'autant plus grande qu'il est plus soluble par le calorique, ou, ce qui revient au même, qu'il est susceptible de se liquéfier à un degré plus inférieur de l'échelle du thermomètre.
Telle est en général la théorie de la solution des sels. Mais je n'ai pu me former encore que des apperçus généraux, parce que les faits particuliers manquent, & qu'il n'existe point assez d'expériences exactes. La marche à suivre pour completter cette partie de la chimie est simple; elle consiste à rechercher pour chaque sel ce 427 qui s'en dissout dans une quantité donnée d'eau à différens degrés du thermomètre: or comme on sait aujourd'hui avec beaucoup de précision, d'après les expériences que nous avons publiées M. de la Place & moi, ce qu'une livre d'eau contient de calorique à chaque degré du thermomètre, il sera toujours facile de déterminer par des expériences simples la proportion de calorique & d'eau qu'exige chaque sel pour être tenu en dissolution, ce qui s'en absorbe au moment où le sel se liquéfie, ce qui s'en dégage au moment où il cristallise.
On ne doit plus être étonné d'après cela de voir que les sels même qui sont dissolubles à froid se dissolvent beaucoup plus rapidement dans l'eau chaude que dans l'eau froide. Il y a toujours emploi de calorique dans la dissolution des sels; & quand il faut que le calorique soit fourni de proche en proche par les corps environnans, il en résulte un déplacement qui ne s'opère que lentement. L'opération au contraire se trouve tout d'un coup facilitée & accélérée quand le calorique nécessaire à la solution se trouve déja tout combiné avec l'eau.
Les sels, en général, en se dissolvant dans l'eau, en augmentent la pesanteur spécifique, mais cette règle n'est pas absolument sans exception.
428
Un jour à venir on connoîtra la quantité de radical, d'oxigène & de base qui constituent chaque sel neutre; on connoîtra la quantité d'eau & de calorique nécessaire pour le dissoudre, l'augmentation de pesanteur spécifique qu'il communique à l'eau, la figure des molécules élémentaires de ses cristaux; on expliquera les circonstances & les accidens de sa cristallisation, & c'est alors seulement que cette partie de la chimie sera complette. M. Séguin a formé le prospectus d'un grand travail en ce genre, qu'il est bien capable d'exécuter.
La solution des sels dans l'eau n'exige aucun appareil particulier. On se sert avec avantage dans les opérations en petit de phioles à médecine de différentes grandeurs, planche II, figures 16 & 17; de terrines de grès, même planche A, fig. 1 & 2; de matras à col allongé, figure 14; de casseroles ou bassines de cuivre & d'argent, figures 13 & 15.
§. II.
De la Lexiviation.
La lexiviation est une opération des arts & de la chimie, dont l'objet est de séparer des substances solubles dans l'eau d'avec d'autres substances qui sont insolubles. On a coutume de se servir pour cette opération dans les arts 429 & dans les usages de la vie d'un grand cuvier ABCD, planche II, figure 12, percé en D près de son fond d'un trou rond dans lequel on introduit une champlure de bois DE ou un robinet de métal. On met d'abord au fond du cuvier une petite couche de paille, & ensuite par-dessus la matière qu'on se propose de lessiver; on la recouvre d'une toile, & on verse de l'eau froide ou chaude, suivant que la substance est d'une solubilité plus ou moins grande. L'eau s'imbibe dans la matière, & pour qu'elle la pénètre mieux, on tient pendant quelque tems fermé le robinet DE. Lorsqu'on juge qu'elle a eu le tems de dissoudre toutes les parties salines, on la laisse couler par le robinet DE; mais comme il reste toujours à la matière insoluble une portion d'eau adhérente qui ne coule pas, comme cette eau est nécessairement aussi chargée de sel que celle qui a coulé, on perdroit une quantité considérable de parties salines, si on ne repassoit à plusieurs reprises de nouvelle eau à la suite de la première. Cette eau sert à étendre celle qui est restée; la substance saline se partage & se fractionne, & au troisième ou quatrième relavage, l'eau passe presque pure; on s'en assure par le moyen du pèse-liqueur dont il a été parlé, page 338.
430
Le petit lit de paille qu'on met au fond du vase sert à procurer des interstices pour l'écoulement de l'eau; on peut l'assimiler aux pailles ou aux tiges de verre dont on se sert pour filtrer dans l'entonnoir, & qui empêchent l'application trop immédiate du papier contre le verre. A l'égard du linge qu'on met par-dessus la matière qu'on se propose de lessiver, il n'est pas non plus inutile; il a pour objet d'empêcher que l'eau ne fasse un creux dans la matière à l'endroit où on la verse, & qu'elle ne s'ouvre des issues particulières qui empêcheroient que toute la masse ne fût lessivée.
On imite plus ou moins cette opération des arts dans les expériences chimiques; mais attendu qu'on se propose plus d'exactitude, & que lorsqu'il est question, par exemple, d'une analyse, il faut être sûr de ne laisser dans le résidu aucune partie saline ou soluble, on est obligé de prendre quelques précautions particulières. La première est d'employer plus d'eau que dans les lessives ordinaires, & d'y délayer les matières avant de tirer la liqueur à clair; autrement toute la masse ne seroit pas également lessivée, & il pourroit même arriver que quelques portions ne le fussent aucunement. Il faut aussi avoir soin de repasser de très-grandes quantités d'eau, & on ne doit en général regarder 431 l'opération comme terminée, que quand l'eau passe absolument dépouillée de sel, & que l'aréomètre indique, qu'elle n'augmente plus de pesanteur spécifique en traversant la matière contenue dans le cuvier.
Dans les expériences très en petit, on se contente communément de mettre dans des bocaux ou des matras de verre la matière qu'on se propose de lessiver; on verse dessus de l'eau bouillante, & on filtre au papier dans un entonnoir de verre. Voy. planche II, figure 7. On relave ensuite avec de l'eau bouillante. Quand on opère sur des quantités un peu plus grandes, on délaie les matières dans un chaudron d'eau bouillante, & on filtre avec le quarré de bois représenté, planche II, figures 3 & 4 qu'on garnit de toile & d'un papier à filtrer. Enfin dans les opérations très en grand, on emploie le baquet ou cuvier que j'ai décrit au commencement de cet article, & qui est représenté, figure 12.
§. III.
De l'Evaporation.
L'évaporation a pour objet de séparer l'une de l'autre deux matières, dont l'une au moins est liquide, & qui ont un degré de volatilité très-différent.
432
C'est ce qui arrive lorsqu'on veut obtenir dans l'état concret un sel qui a été dissous dans l'eau: on échauffe l'eau & on la combine avec le calorique qui la volatilise; les molécules de sel se rapprochent en même tems, & obéissant aux loix de l'attraction, elles se réunissent pour reparoître sous leur forme solide.
On a pensé que l'action de l'air influoit beaucoup sur la quantité de fluide qui s'évapore, & on est tombé à cet égard dans des erreurs qu'il est bon de faire connoître. Il est sans doute une évaporation lente qui se fait continuellement d'elle-même à l'air libre, & à la surface des fluides exposés à la simple action de l'atmosphère. Quoique cette première espèce d'évaporation puisse être jusqu'à un certain point considérée comme une dissolution par l'air, il n'en est pas moins vrai que le calorique y concourt, puisqu'elle est toujours accompagnée de refroidissement: on doit donc la regarder comme une dissolution mixte, faite en partie par l'air, & en partie par le calorique. Mais il est un autre genre d'évaporation, c'est celle qui a lieu à l'égard d'un fluide entretenu toujours bouillant; l'évaporation qui se fait alors par l'action de l'air n'est plus que d'un objet très-médiocre en comparaison de celle qui est occasionnée par l'action du calorique: ce n'est plus, à proprement parler, 433 l'évaporation qui a lieu, mais la vaporisation; or cette dernière opération ne s'accélère pas en raison des surfaces évaporantes, mais en raison des quantités de calorique qui se combinent avec le liquide. Un trop grand courant d'air froid nuit quelquefois dans ces occasions à la rapidité de l'évaporation, par la raison qu'il enlève du calorique à l'eau, & qu'il ralentit par conséquent sa conversion en vapeurs. Il n'y a donc nul inconvénient à couvrir jusqu'à un certain point le vase où l'on fait évaporer un liquide entretenu toujours bouillant, pourvû que le corps qui couvre soit de nature à dérober peu de calorique, qu'il soit, pour me servir d'une expression du docteur Francklin, mauvais conducteur de chaleur; les vapeurs s'échappent alors par l'ouverture qui leur est laissée, & il s'en évapore au moins autant & souvent plus que quand on laisse un accès libre à l'air extérieur.
Comme dans l'évaporation, le liquide que le calorique enlève est absolument perdu, comme on le sacrifie pour conserver la substance fixe avec laquelle il étoit combiné, on n'évapore jamais que des matières peu précieuses, telles par exemple que l'eau. Lorsqu'elles ont plus de valeur, on a recours à la distillation: autre opération dans laquelle on conserve à la 434 fois & le corps fixe & le corps volatil.
Les vaisseaux dont on se sert pour les évaporations, sont des bassines de cuivre ou d'argent, quelquefois de plomb, telles que celle représentée planche II, fig. 13, des casseroles également de cuivre ou d'argent, fig. 15.
Des capsules de verre, pl. III, fig. 3 & 4.
Des jattes de porcelaine.
Des terrines de grès A, planche II, fig. 1 & 2.
Mais les meilleures de toutes les capsules à évaporer, sont des fonds de cornue & des portions de matras de verre. Leur minceur qui est égale par-tout, les rend plus propres que tout autre vaisseau à se prêter, sans se casser, à une chaleur brusque & à des alternatives subites de chaud & de froid. On peut les faire soi-même dans les laboratoires, & elles reviennent beaucoup moins cher que les capsules qu'on achète chez les fayanciers. Cet art de couper le verre ne se trouve décrit nulle part, & je vais en donner une idée.
On se sert d'anneaux de fer AC, pl. III, fig. 5, que l'on soude à une tige de fer AB, garnie d'un manche de bois D. On fait rougir l'anneau de fer dans un fourneau, puis on pose dessus le matras G, fig. 6, qu'on se propose de couper: lorsqu'on juge que le verre a été suffisamment 435 échauffé par l'anneau de fer rouge, on jette quelques gouttes d'eau dessus, & le matras se casse ordinairement juste dans la ligne circulaire qui étoit en contact avec l'anneau de fer.
D'autres vaisseaux évaporatoires, d'un excellent usage, sont de petites fioles de verre, qu'on désigne dans le commerce sous le nom de fioles à médecine. Ces bouteilles qui sont de verre mince & commun, supportent le feu avec une merveilleuse facilité, & sont à très-bon marché. Il ne faut pas craindre que leur figure nuise à l'évaporation de la liqueur. J'ai déjà fait voir que toutes les fois qu'on évaporoit le liquide au degré de l'ébullition, la figure du vaisseau contribuoit ou nuisoit peu à la célérité de l'opération, sur-tout quand les parois supérieures du vaisseau étoient mauvais conducteurs de chaleur, comme le verre. On place une ou plusieurs de ces fioles sur une seconde grille de fer FG, planche III, fig. 2, qu'on pose sur la partie supérieure d'un fourneau, & sous laquelle on entretient un feu doux. On peut suivre de cette manière un grand nombre d'expériences à la fois.
Un autre appareil évaporatoire assez commode & assez expéditif consiste dans une cornue de verre qu'on met au bain de sable, comme 436 on le voit planche III, fig. 1, & qu'on recouvre avec un dôme de terre cuite: mais l'opération est toujours beaucoup plus lente, quand on se sert du bain de sable; elle n'est pas d'ailleurs exempte de dangers, parce que le sable s'échauffant inégalement, tandis que le verre ne peut pas se prêter à des degrés de dilatation locale, le vaisseau est souvent exposé à casser. Il arrive même quelquefois que le sable chaud fait exactement l'office des anneaux de fer représentés planche III, fig. 5 & 6, sur-tout lorsque le vase contient un fluide qui distille. Une goutte de fluide qui s'éclabousse & qui vient tomber sur les parois du vaisseau à l'endroit du contact de l'anneau de sable, le fait casser circulairement en deux parties terminées par une ligne bien tranchée.
Dans les cas où l'évaporation exige une grande intensité de feu, on se sert de creusets de terre; mais en général on entend le plus communément par le mot évaporation une opération qui se fait au degré de l'eau bouillante, ou très-peu au-dessus.
§. IV.
De la Cristallisation.
La cristallisation est une opération dans laquelle les parties intégrantes d'un corps séparées 437 les unes des autres par l'interposition d'un fluide, sont déterminées par la force d'attraction qu'elles exercent les unes sur les autres, à se rejoindre pour former des masses solides.
Lorsque les molécules d'un corps sont simplement écartées par le calorique, & qu'en vertu de cet écartement ce corps est porté à l'état de liquide, il ne faut, pour le ramener à l'état de solide, c'est-à-dire pour opérer sa cristallisation, que supprimer une partie du calorique logé entre ses molécules, autrement dit le refroidir. Si le refroidissement est lent & si en même tems il y a repos, les molécules prennent un arrangement régulier, & alors il y a cristallisation proprement dite: si au contraire le refroidissement est rapide, ou si en supposant un refroidissement lent on agite le liquide au moment où il va passer à l'état concret, il y a cristallisation confuse.
Les mêmes phénomènes ont lieu dans les solutions par l'eau; ou pour mieux dire, les solutions par l'eau sont toujours mixtes, comme je l'ai déjà fait voir dans le paragraphe premier de ce chapitre: elles s'opèrent en partie par l'action de l'eau, en partie par celle du calorique. Tant qu'il y a suffisamment d'eau & de calorique pour écarter les molécules du sel, au point qu'elles soient hors de leur sphère 438 d'attraction, le sel demeure dans l'état fluide. L'eau & le calorique viennent-ils à manquer, & l'attraction des molécules salines les unes par rapport aux autres devient-elle victorieuse, le sel reprend la forme concrète, & la figure des cristaux est d'autant plus régulière, que l'évaporation a été plus lente & faite dans un lieu plus tranquille.
Tous les phénomènes qui ont lieu dans la solution des sels se retrouvent également dans leur cristallisation, mais dans un sens inverse. Il y a dégagement de calorique au moment où le sel se réunit & reparoît sous sa forme concrète & solide, & il en résulte une nouvelle preuve que les sels sont tenus à la fois en dissolution par l'eau & par le calorique. C'est par cette raison qu'il ne suffit pas pour faire cristalliser les sels qui se liquéfient aisément par le calorique, de leur enlever l'eau qui les tenoit en dissolution; il faut encore leur enlever le calorique, & le sel ne cristallise qu'autant que ces deux conditions sont remplies. Le salpêtre, le muriate oxygéné de potasse, l'alun, le sulfate de soude, &c. en fournissent des exemples. Il n'en est pas de même des sels qui exigent peu de calorique pour être tenus en dissolution, & qui par cela même sont à peu près également solubles dans l'eau chaude & dans l'eau froide; il 439 suffit de leur enlever l'eau qui les tenoit en dissolution pour les faire cristalliser, & ils reparoissent sous forme concrète dans l'eau bouillante même, comme on l'observe relativement au sulfate de chaux, aux muriates de soude & de potasse, & à beaucoup d'autres.
C'est sur ces propriétés des sels & sur leur différence de solubilité à chaud & à froid, qu'est fondé le raffinage du salpêtre. Ce sel, tel qu'il est retiré par une première opération, & tel qu'il est livré par les salpêtriers, est composé de sels déliquescens qui ne sont pas susceptibles de cristalliser, tels que le nitrate & le muriate de chaux; de sels qui sont presqu'également solubles à chaud & à froid, tels que les muriates de potasse & de soude; enfin de salpêtre, qui est beaucoup plus soluble à chaud qu'à froid.
On commence par verser sur tous ces sels confondus ensemble une quantité d'eau suffisante pour tenir en dissolution les moins solubles de tous, & ce sont les muriates de soude & de potasse. Cette quantité d'eau tient facilement en dissolution tout le salpêtre, tant qu'elle est chaude; mais il n'en est plus de même lorsqu'elle se refroidit; la majeure partie du salpêtre cristallise, il n'en reste qu'environ un sixième tenu en dissolution, & qui se trouve 440 confondu avec le nitrate calcaire & avec les muriates.
Le salpêtre qu'on obtient ainsi est un peu imprégné de sels étrangers, parce qu'il a cristallisé dans une eau qui elle-même en étoit chargée; mais on l'en dépouille complètement par une nouvelle dissolution à chaud avec très-peu d'eau & par une nouvelle cristallisation.
A l'égard des eaux surnageantes à la cristallisation du salpêtre, & qui contiennent un mêlange de salpêtre & de différens sels, on les fait évaporer pour en tirer du salpêtre brut, qu'on purifie ensuite également par deux nouvelles dissolutions & cristallisations.
Les sels à base terreuse qui sont incristallisables, sont rejettés s'ils ne contiennent point de nitrates; si au contraire ils en contiennent, on les étend avec de l'eau, on précipite la terre par le moyen de la potasse, on laisse déposer, on décante, on fait évaporer & on met à cristalliser.
Ce qui s'observe dans le raffinage du salpêtre, peut servir de règle toutes les fois qu'il est question de séparer par voie de cristallisation plusieurs sels mêlés ensemble. Il faut alors étudier la nature de chacun, la proportion qui s'en dissout dans des quantités données d'eau, leur différence de solubilité à chaud & à froid. Si à 441 ces propriétés principales on joint celle qu'ont quelques sels de se dissoudre dans l'alkool ou dans un mêlange d'alkool & d'eau, on verra qu'on a des ressources très multipliées pour opérer la séparation des sels par voie de cristallisation. Mais il faut convenir en même tems qu'il est difficile de rendre cette séparation complète & absolue.
Les vaisseaux qu'on emploie pour la cristallisation des sels, sont des terrines de grès A, planc. II, figures 1 & 2, & de grandes capsules applaties, planche III, fig. 7.
Lorsqu'on abandonne une solution saline à une évaporation lente, à l'air libre & à la chaleur de l'atmosphère, on doit employer des vases un peu élevés, tels que celui représenté pl. III, fig. 3, afin qu'il y ait une épaisseur un peu considérable de liqueur; on obtient par ce moyen des cristaux beaucoup plus gros & aussi réguliers qu'on puisse l'espérer.
Non-seulement tous les sels cristallisent sous différentes formes, mais encore la cristallisation de chaque sel varie suivant les circonstances de la cristallisation. Il ne faut pas en conclure que la figure des molécules salines ait rien d'indéterminé dans chaque espèce: rien n'est plus constant au contraire que la figure des molécules primitives des corps, sur-tout à l'égard 442 des sels. Mais les cristaux qui se forment sous nos yeux, sont des aggrégations de molécules, & ces molécules, quoique toutes parfaitement égales en figure & en grosseur, peuvent prendre des arrangemens différens, qui donnent lieu à une grande variété de figures toutes régulières, & qui paroissent quelquefois n'avoir aucun rapport, ni entr'elles, ni avec la figure du cristal originaire. Cet objet a été savamment traité par M. l'Abbé Haüy, dans plusieurs Mémoires présentés à l'Académie, & dans un Ouvrage sur la structure des cristaux. Il ne reste plus même qu'à étendre à la classe des sels ce qu'il a fait plus particulièrement pour quelques pierres cristallisées.
§. V.
De la Distillation simple.
La distillation a deux objets bien déterminés: je distinguerai en conséquence deux espèces de distillation, la distillation simple & la distillation composée. C'est uniquement de la première dont je m'occuperai dans cet article.
Lorsqu'on soumet à la distillation deux corps dont l'un est plus volatil, c'est-à-dire, a plus d'affinité que l'autre avec le calorique, le but qu'on se propose est de les séparer: le plus 443 volatil prend la forme de gaz, & on le condense ensuite par refroidissement dans des appareils propres à remplir cet objet. La distillation n'est alors, comme l'évaporation, qu'une opération en quelque façon mécanique qui sépare l'une de l'autre deux substances, sans les décomposer & sans en altérer la nature. Dans l'évaporation c'étoit le produit fixe qu'on cherchoit à conserver, sans s'embarrasser de conserver le produit volatil; dans la distillation au contraire on s'attache le plus communément à recueillir le produit volatil, à moins qu'on ne se propose de les conserver tous deux. Ainsi la distillation simple bien analysée ne doit être considérée que comme une évaporation en vaisseaux clos.
Le plus simple de tous les appareils distillatoires est une bouteille A, planc. III, fig. 8, dont on courbe, dans la verrerie même, le col BC en BD. Cette bouteille ou fiole porte alors le nom de cornue; on la place ou dans un fourneau de réverbère, comme on le voit planche XIII, fig. 2, ou au bain de sable sous une couverture de terre cuite, comme on le voit planche III, fig. 1. Pour recueillir & pour condenser les produits, on adapte à la cornue un récipient E, planche III, fig. 9, qu'on lute avec elle: quelquefois, sur-tout dans les opérations 444 de pharmacie, on se sert d'une cucurbite de verre ou de grès A, planche III, fig. 12, surmontée de son chapiteau B, ou bien d'un alambic de verre auquel tient un chapiteau d'une seule pièce, figure 13. On ménage à ce dernier une tubulure, c'est-à-dire une ouverture T, qu'on bouche avec un bouchon de cristal usé à l'émeril. On voit que le chapiteau B de l'alambic a une rigole rr, destinée à recevoir la liqueur qui se condense, & à la conduire au bec rS par lequel elle s'écoule.
Mais, comme dans presque toutes les distillations il y a une expansion de vapeurs qui pourroit faire éclater les vaisseaux, on est obligé de ménager au ballon ou récipient E, fig. 9, un petit trou T, par lequel on donne issue aux vapeurs. D'où l'on voit qu'on perd dans cette manière de distiller tous les produits qui sont dans un état constamment aériforme, & ceux même qui, ne perdant pas facilement cet état, n'ont pas le tems d'être condensés dans l'intérieur du ballon. Cet appareil ne peut donc être employé que dans les opérations courantes des laboratoires & dans la pharmacie, mais il est insuffisant pour toutes les opérations de recherches. Je détaillerai à l'article de la distillation composée, les moyens qu'on a imaginés pour recueillir sans perte la totalité des produits.
445
Les vaisseaux de verre étant très-fragiles & ne résistant pas toujours aux alternatives brusques du chaud & du froid, on a imaginé de faire des appareils distillatoires en métal. Ces instrumens sont nécessaires pour distiller de l'eau, des liqueurs spiritueuses, pour obtenir les huiles essentielles des végétaux, &c. On ne peut se dispenser dans un laboratoire bien monté d'avoir un ou deux alambics de cette espèce & de différente grandeur.
Cet appareil distillatoire consiste dans une cucurbite de cuivre rouge étamé A, pl. III, fig. 15 & 16, dans laquelle s'ajuste, lorsqu'on le juge à propos, un bain-marie d'étain D, figure 17, & sur lequel on place le chapiteau F. Ce chapiteau peut également s'ajuster sur la cucurbite de cuivre, sans bain-marie ou avec le bain-marie, suivant la nature des opérations. Tout l'intérieur du chapiteau doit être en étain.
Il est nécessaire, sur-tout pour la distillation des liqueurs spiritueuses, que le chapiteau F de l'alambic soit garni d'un réfrigérent SS, fig. 16, dans lequel on entretient toujours de l'eau fraîche. On la laisse écouler par le moyen du robinet R, quand on s'apperçoit qu'elle devient trop chaude, & on la renouvelle avec de la fraîche. Il est aisé de concevoir quel est l'usage de cette eau; l'objet de la distillation est de 446 convertir en gaz la matière qu'on veut distiller & qui est contenue dans la cucurbite, & cette conversion se fait à l'aide du calorique fourni par le feu du fourneau: mais il n'y auroit pas de distillation, si ce même gaz ne se condensoit pas dans le chapiteau, s'il n'y perdoit pas la forme de gaz & ne redevenoit pas liquide. Il est donc nécessaire que la substance que l'on distille dépose dans le chapiteau tout le calorique qui s'y étoit combiné dans la cucurbite, & par conséquent que les parois du chapiteau soient toujours entretenues à une température plus basse que celle qui peut maintenir la substance à distiller dans l'état de gaz. L'eau du réfrigérent est destinée à remplir cet office. On sait que l'eau se convertit en gaz à 80 degrés du thermomètre françois, l'esprit-de-vin ou alkool à 67, l'éther à 32; on conçoit donc que ces substances ne distilleroient pas, ou plutôt qu'elles s'échapperoient en vapeurs aériformes, si la chaleur du réfrigérent n'étoit pas entretenue au-dessous de ces degrés respectifs.
Dans la distillation des liqueurs spiritueuses & en général des liqueurs très-expansives, le réfrigérent ne suffit pas pour condenser toutes les vapeurs qui s'élèvent de la cucurbite: alors au lieu de recevoir directement la liqueur du bec TU de l'alambic dans un récipient, on interpose 447 entre deux un serpentin. On donne ce nom à un instrument représenté fig. 18. Il consiste en un tuyau tourné en spirale, & qui fait un grand nombre de révolutions dans un seau de cuivre étamé BCDE. On entretient toujours de l'eau dans ce seau, & on la renouvelle quand elle s'échauffe. Cet instrument est en usage dans tous les atteliers de fabrication d'eau-de-vie; on n'y emploie pas même de chapiteau proprement dit ni de réfrigérent, & toute la condensation s'opère dans le serpentin. Celui représenté dans la figure 18, a un tuyau double dont l'un est spécialement destiné à la distillation des matières odorantes.
Quelquefois, même dans la distillation simple, on est obligé d'ajouter une allonge entre la cornue & le récipient, comme on le voit fig. 11. Cette disposition peut avoir deux objets; ou de séparer l'un de l'autre des produits de différens degrés de volatilité, ou d'éloigner le récipient du fourneau, afin que la matière qui doit y être contenue éprouve moins de chaleur. Mais ces appareils & plusieurs autres plus compliqués qui ont été imaginés par les anciens, sont bien éloignés de répondre aux vues de la Chimie moderne: on en jugera par les détails dans lesquels j'entrerai à l'article de la distillation composée.
448
§. VI.
De la Sublimation.
On donne le nom de sublimation à la distillation des matières qui se condensent dans un état concret: ainsi on dit la sublimation du soufre, la sublimation du sel ammoniac ou muriate ammoniacal, &c. Ces opérations n'exigent pas d'appareils particuliers; cependant on a coutume d'employer pour la sublimation du soufre, ce qu'on nomme des aludels. Ce sont des vaisseaux de terre ou de fayance qui s'ajustent les uns avec les autres, & qui se placent sur une cucurbite qui contient le soufre.
Un des meilleurs appareils sublimatoires pour les matières qui ne sont point très-volatiles, est une fiole à médecine qu'on enfonce aux deux tiers dans un bain de sable; mais alors on perd une partie du produit. Toutes les fois qu'on veut les conserver tous, il faut se rapprocher des appareils pneumato-chimiques, dont je vais donner la description dans le Chapitre suivant.

449
CHAPITRE VI.
Des Distillations pneumato-chimiques, des Dissolutions métalliques, & de quelques autres opérations qui exigent des Appareils très-compliqués.
§. PREMIER.
Des Distillations composées,
& des Distillations pneumato-chimiques.
Je n'ai présenté dans le §. 5 du Chapitre précédent, la distillation, que comme une opération simple, dont l'objet est de séparer l'une de l'autre deux substances de volatilité différente: mais le plus souvent la distillation fait plus; elle opère une véritable décomposition du corps qui y est soumis: elle sort alors de la classe des opérations simples, & elle rentre dans l'ordre de celles qu'on peut regarder comme des plus compliquées de la chimie. Il est sans doute de l'essence de toute distillation, que la substance que l'on distille soit réduite à l'état de gaz dans la cucurbite par sa combinaison avec le calorique; mais dans la distillation 450 simple ce même calorique se dépose dans le réfrigérent ou dans le serpentin, & la même substance reprend son état de liquidité. Il n'en est pas ainsi dans la distillation composée; il y a dans cette opération décomposition absolue de la substance soumise à la distillation: une portion telle que le charbon demeure fixe dans la cornue, tout le reste se réduit en gaz d'un grand nombre d'espèces. Les uns sont susceptibles de se condenser par le refroidissement, & de reparoître sous forme concrète & liquide; les autres demeurent constamment dans l'état aériforme; ceux-ci sont absorbables par l'eau, ceux-là le sont par les alkalis; enfin quelques-uns ne sont absorbables par aucune substance. Un appareil distillatoire ordinaire, & tel que ceux que j'ai décrits dans le chapitre précédent, ne suffiroit pas pour retenir & pour séparer des produits aussi variés: on est donc obligé d'avoir recours à des moyens beaucoup plus compliqués.
Je pourrois placer ici un historique des tentatives qui ont été successivement faites pour retenir les produits aériformes qui se dégagent des distillations; ce seroit une occasion de citer Hales, Rouelle, Woulfe & plusieurs autres chimistes célèbres; mais comme je me suis fait une loi d'être aussi concis qu'il seroit 451 possible, j'ai pensé qu'il valoit mieux décrire tout d'un coup l'appareil le plus parfait, plutôt que de fatiguer le lecteur par le détail de tentatives infructueuses faites dans un tems où l'on n'avoit encore que des idées très-imparfaites sur la nature des gaz en général. L'appareil dont je vais donner la description est destiné à la plus compliquée de toutes les distillations: on pourra le simplifier ensuite suivant la nature des opérations.
A, planche IV, figure 1, représente une cornue de verre tubulée en H, dont le col B s'ajuste avec un ballon GC à deux pointes. A la tubulure supérieure D de ce ballon s'ajuste un tube de verre DEfg qui vient plonger par son extrêmité g dans la liqueur contenue dans la bouteille L. A la suite de la bouteille L qui est tubulée en xxx sont trois autres bouteilles L', L'', L''', qui ont de même trois tubulures ou gouleaux x', x', x'; x'', x'', x''; x''', x''', x'''. Chaque bouteille est liée par un tube de verre xyz', x'y'z'', x''y''z'''; enfin à la dernière tubulure de la bouteille L''' est adapté un tube x'''RM qui aboutit sous une cloche de verre, laquelle est placée sur la tablette de l'appareil pneumato-chimique. Communément on met dans la première bouteille un poids bien connu d'eau distillée, & dans les trois autres de la potasse 452 caustique étendue d'eau: la tarre de ces bouteilles & le poids de la liqueur alkaline qu'elles contiennent doivent être déterminés avec un très-grand soin. Tout étant ainsi disposé, on lute toutes les jointures, savoir celle B de la cornue au ballon, & celle D de la tubulure supérieure du ballon avec du lut gras recouvert de toile imbibée de chaux & de blanc d'œuf, & toutes les autres avec un lut de térébenthine cuite & de cire fondues ensemble.
On voit d'après ces dispositions que lorsqu'on a mis le feu sous la cornue A, & que la substance qu'elle contient a commencé à se décomposer, les produits les moins volatils doivent se condenser & se sublimer dans le col même de la cornue, & que c'est principalement-là que doivent se rassembler les substances concrètes: que les matières plus volatiles telles que les huiles légères, l'ammoniaque & beaucoup d'autres substances, doivent se condenser dans le matras GC; que les gaz, au contraire, qui ne peuvent être condensés par le froid, doivent bouillonner à travers les liqueurs contenues dans les bouteilles LL'L''L'''; que tout ce qui est absorbable par l'eau doit rester dans la bouteille L; que tout ce qui est susceptible d'être absorbé par l'alkali doit rester dans les bouteilles L'L''L''', enfin que les gaz qui ne sont 453 absorbables ni par l'eau, ni par les alkalis, doivent s'échapper par le tube RM, à la sortie duquel ils peuvent être reçus dans des cloches de verre. Enfin ce qu'on appeloit autrefois le caput mortuum, le charbon & la terre comme absolument fixes, doivent rester dans la cornue.
On a toujours dans cette manière d'opérer une preuve matérielle de l'exactitude du résultat; car le poids des matières en total doit être le même avant & après l'opération: si donc on a opéré par exemple sur 8 onces de gomme arabique ou d'amidon, le poids du résidu charbonneux qui restera dans la cornue A après l'opération, plus celui des produits rassemblés dans son col & dans le matras GC, plus celui du gaz rassemblé dans la cloche M, plus enfin l'augmentation de poids acquise par les bouteilles L, L', L'', L'''; tous ces poids, dis-je, réunis doivent former un total de 8 onces. S'il y a plus ou moins, il y a erreur, & il faut recommencer l'expérience jusqu'à ce qu'on ait un résultat dont on soit satisfait, & qui diffère à peine de 6 ou 8 grains par livre de matière mise en expérience.
J'ai rencontré long-tems dans ce genre d'expériences des difficultés presqu'insurmontables, & qui m'auroient obligé d'y renoncer, si je ne fusse parvenu enfin à les lever par un moyen 454 très-simple, & dont M. Hassenfratz m'a fourni l'idée. Le moindre ralentissement dans le degré de feu du fourneau, & beaucoup d'autres circonstances inséparables de ce genre d'expériences occasionnent souvent des réabsorptions de gaz: l'eau de la cuve rentre rapidement dans la bouteille L''' par le tube x'''RM: la même chose arrive d'une bouteille à l'autre, & souvent la liqueur remonte jusques dans le ballon C. On prévient ces accidens en employant des bouteilles à trois tubulures, & en adaptant à l'une d'elles un tube capillaire St, s't', s''t'', s'''t''', dont le bout doit plonger dans la liqueur des bouteilles. S'il y a absorption soit dans la cornue, soit dans quelques-unes des bouteilles, il rentre par ces tubes de l'air extérieur qui remplace le vuide qui s'est formé, & on en est quitte pour avoir un petit mêlange d'air commun dans les produits; mais au moins l'expérience n'est pas entièrement manquée. Ces tubes peuvent bien admettre de l'air extérieur, mais ils ne peuvent en laisser échapper, parce qu'ils sont toujours bouchés dans leur partie inférieure tt't''t''' par le fluide des bouteilles.
On conçoit que pendant le cours de l'expérience, la liqueur des bouteilles doit remonter dans chacun de ces tubes à une hauteur relative à la pression qu'éprouve l'air ou le 455 gaz contenu dans la bouteille; or cette pression est déterminée par la hauteur & par le poids de la colonne de liquide contenu dans toutes les bouteilles subséquentes. En supposant donc qu'il y ait trois pouces de liqueur dans chaque bouteille, que la hauteur de l'eau de la cuve soit également de trois pouces au-dessus de l'orifice du tuyau RM, enfin que la pesanteur spécifique des liqueurs contenues dans les bouteilles ne differe pas sensiblement de celle de l'eau; l'air de la bouteille L sera comprimé par un poids égal à celui d'une colonne d'eau de 12 pouces. L'eau s'élevera donc de 12 pouces dans le tube St, d'où il résulte qu'il faut donner à ce tube plus de 12 pouces de longueur au-dessus du niveau du liquide ab. Le tube s't' doit par la même raison avoir plus de 9 pouces, le tube s"t" plus de six, & le tube s'''t''' plus de trois. On doit au surplus donner à ces tubes plus que moins de longueur à cause des oscillations qui ont souvent lieu. On est obligé dans quelques cas d'introduire un semblable tube entre la cornue & le ballon; mais comme ce tube ne plonge point dans l'eau, comme il n'est point bouché par un liquide, au moins jusqu'à ce qu'il en ait passé par le progrès de la distillation, il faut en boucher l'ouverture supérieure avec un peu de lut, & 456 ne l'ouvrir qu'au besoin, ou lorsqu'il y a assez de liquide dans le matras C pour fermer l'extrêmité du tube.
L'appareil dont je viens de donner la description, ne peut pas être employé dans des expériences exactes, toutes les fois que les matières qu'on se propose de traiter ont une action trop rapide l'une sur l'autre, ou lorsque l'une des deux ne doit être introduite que successivement & par petites parties, comme il arrive dans les mêlanges qui font une violente effervescence. On se sert alors d'une cornue tubulée A, planche VII, fig. 1. On y introduit l'une des deux substances, & de préférence celle qui est concrète, puis on adapte & on lute à la tubulure un tube recourbé BCDA terminé dans sa partie supérieure B en entonnoir, & par son extrêmité A en un tube capillaire: c'est par l'entonnoir B de ce tube qu'on verse la liqueur. Il faut que la hauteur BC soit assez grande pour que la liqueur qu'on doit introduire puisse faire équilibre avec la résistance occasionnée par celle contenue dans les bouteilles LL'L''L''', planche IV, figure 1.
Ceux qui n'ont pas l'habitude de se servir de l'appareil distillatoire que je viens de decrire, ne manqueront pas de s'effrayer de la grande quantité d'ouvertures qu'on est obligé 457 de luter, & du tems qu'exigent les préliminaires de semblables expériences; & en effet si on fait entrer en ligne de compte les pesées qu'il est nécessaire de faire avant l'expérience & de répéter après, les préparatifs sont beaucoup plus longs que l'expérience elle-même. Mais aussi on est bien dédommagé de ses peines quand l'expérience réussit, & on acquiert en une seule fois plus de connoissances sur la nature de la substance animale ou végétale qu'on a soumise à la distillation, que par plusieurs semaines du travail le plus assidu.
A défaut de bouteilles triplement tubulées, on se sert de bouteilles à deux gouleaux: il est même possible de mettre les trois tubes dans la même ouverture, & de se servir de bouteilles ordinaires à gouleaux renversés pourvu que l'ouverture soit suffisamment grande. Il faut avoir soin d'ajuster sur les bouteilles des bouchons qu'on use avec une lime très-douce, & qu'on fait bouillir dans un mêlange d'huile, de cire & de térébenthine. On perce à travers ces bouchons avec une lime nommée queue de rat, voyez planche I, fig. 16, autant de trous qu'il est nécessaire pour le passage des tubes: on voit un de ces bouchons représenté, pl. IV, figure 8.
458
§. II.
Des Dissolutions métalliques.
J'ai déja fait sentir lorsque j'ai parlé de la solution des sels dans l'eau, combien il existoit de différence entre cette opération & la dissolution métallique. On a vu que la solution des sels n'exigeoit aucun appareil particulier, & que tout vase y étoit propre. Il n'en est pas de même de la dissolution des métaux; pour ne rien perdre dans cette dernière, & pour obtenir des résultats vraiment concluans, il faut employer des appareils très-compliqués, & dont l'invention appartient absolument aux chimistes de notre âge.
Les métaux en général se dissolvent avec effervescence dans les acides; or l'effet auquel on a donné le nom d'effervescence n'est autre chose qu'un mouvement excité dans la liqueur dissolvante par le dégagement d'un grand nombre de bulles d'air ou de fluide aériforme qui partent de la surface du métal, & qui crèvent en sortant de la liqueur dissolvante.
M. Cavendish & M. Priestley sont les premiers qui aient imaginé des appareils simples pour recueillir ces fluides élastiques. Celui de M. Priestley consiste en une bouteille A, pl. VII, figure 2, 459 bouchée en B avec un bouchon de liège troué dans son milieu, & qui laisse passer un tube de verre recourbé en BC, qui s'engage sous des cloches remplies d'eau, & renversées dans un bassin plein d'eau: on commence par introduire le métal dans la bouteille A, on verse l'acide par-dessus, puis on bouche avec le bouchon garni de son tube BC.
Mais cet appareil n'est pas sans inconvénient, du moins pour des expériences très-exactes. Premièrement lorsque l'acide est très-concentré, & que le métal est très-divisé, l'effervescence commence souvent avant qu'on ait eu le tems de boucher la bouteille; il y a perte de gaz, & on ne peut plus déterminer les quantités avec exactitude. Secondement dans toutes les opérations où l'on est obligé de faire chauffer, il y a une partie de l'acide qui se distille & qui se mêle avec l'eau de la cuve; en sorte qu'on se trompe dans le calcul des quantités d'acide décomposées. Troisièmement enfin l'eau de la cuve absorbe tous les gaz susceptibles de se combiner avec l'eau, & il est impossible de les recueillir sans perte.
Pour remédier à ces inconvéniens, j'avois d'abord imaginé d'adapter à une bouteille à deux gouleaux A, planche VII, figure 3, un entonnoir de verre BC qu'on y lute de manière 460 à ne laisser aucune issue à l'air. Dans cet entonnoir entre une tige de cristal DE usée en D à l'émeri avec l'entonnoir, de manière à le fermer comme le bouchon d'un flacon.
Lorsqu'on veut opérer, on commence par introduire dans la bouteille A la matière à dissoudre: on lute l'entonnoir, on le bouche avec la tige DE, puis on y verse de l'acide qu'on fait passer dans la bouteille en aussi petite quantité que l'on veut, en soulevant doucement la tige: on répète successivement cette opération jusqu'à ce qu'on soit arrivé au point de saturation.
On a employé depuis un autre moyen qui remplit le même objet, & qui dans certains cas est préférable: j'en ai déjà donné une idée dans le paragraphe précédent. Il consiste à adapter à l'une des tubulures de la bouteille A, pl. VII, fig. 4, un tube recourbé DEFG terminé en D par une couverture capillaire, & en G par un entonnoir soudé au tube; on le lute soigneusement & solidement dans la tubulure C. Lorsqu'on verse une petite goutte de liqueur dans le tube par l'entonnoir G, elle tombe dans la partie F; si on en ajoute davantage, elle parvient à dépasser la courbure E & à s'introduire dans la bouteille A: l'écoulement dure tant qu'on fournit de nouvelle liqueur par l'entonnoir G. On conçoit qu'elle ne peut 461 jamais être chassée en dehors du tube EFG, & qu'il ne peut jamais sortir d'air ou de gaz de la bouteille; parce que le poids de la liqueur l'en empêche & fait l'effet d'un véritable bouchon.
Pour remédier au second inconvénient, à celui de la distillation de l'acide, qui s'opère sur-tout dans les dissolutions qui sont accompagnées de chaleur, on adapte à la cornue A, planc. VII, fig. 1, un petit matras tubulé M qui reçoit la liqueur qui se condense.
Enfin pour séparer les gaz absorbables par l'eau, tel que le gaz acide carbonique, on ajoute une bouteille L à deux gouleaux dans laquelle on met de l'alkali pur étendu d'eau: l'alkali absorbe tout le gaz acide carbonique, & il ne passe plus, communément, sous la cloche par le tube NO, qu'une ou deux espèces de gaz tout au plus: on a vu dans le premier chapitre de cette troisième partie comment on parvenoit à les séparer. Si une bouteille d'alkali ne suffit pas, on en ajoute jusqu'à trois & quatre.
§. III.
Des Appareils relatifs
aux fermentations vineuse & putride.
La fermentation vineuse & la fermentation 462 putride exigent des appareils particuliers, & destinés uniquement à ce genre d'expériences. Je vais décrire celui que j'ai cru devoir définitivement adopter, après y avoir fait successivement un grand nombre de corrections.
On prend un grand matras A, planche X, d'environ 12 pintes de capacité: on y adapte une virole de cuivre ab solidement mastiquée, & dans laquelle se visse un tuyau coudé cd garni d'un robinet e. A ce tuyau s'adapte une espèce de récipient de verre à trois pointes B, au-dessous duquel est placée une bouteille C avec laquelle il communique. A la suite du récipient B est un tube de verre ghi, mastiqué en g & en i avec des viroles de cuivre: il est destiné à recevoir un sel concret très-déliquescent, tel que du nitrate ou du muriate de chaux, de l'acétite de potasse, &c.
Enfin ce tube est suivi de deux bouteilles D, E, remplies jusqu'en xy d'alkali dissous dans l'eau, & bien dépouillé d'acide carbonique.
Toutes les parties de cet appareil sont réunies les unes avec les autres par le moyen de vis & d'écrous qui se serrent; les points de contact sont garnis de cuir gras qui empêche tout passage de l'air: enfin chaque pièce est garnie de deux robinets, de manière qu'on 463 peut la fermer par ses deux extrêmités, & peser ainsi chacune séparément à toutes les époques de l'expérience qu'on le juge à propos.
C'est dans le ballon A qu'on met la matière fermentescible, du sucre par exemple, & de la levure de bière étendue d'une suffisante quantité d'eau & dont le poids est bien déterminé. Quelquefois lorsque la fermentation est trop rapide, il se forme une quantité considérable d'écume qui non-seulement remplit le col du ballon, mais qui passe dans le récipient B & coule dans la bouteille C. C'est pour recueillir cette mousse & empêcher qu'elle ne passe dans le tube déliquescent, qu'on a donné une capacité considérable au récipient B & à la bouteille C.
Il ne se dégage dans la fermentation du sucre, c'est-à-dire dans la fermentation vineuse, que de l'acide carbonique qui emporte avec lui un peu d'eau qu'il tient en dissolution. Il en dépose une grande partie en passant par le tube ghi qui contient un sel déliquescent en poudre grossière, & on en connoît la quantité par l'augmentation de poids acquise par le sel. Ce même acide carbonique bouillonne ensuite à travers la liqueur alkaline de la bouteille D, dans laquelle il est conduit par le tube klm. La petite portion qui n'a point été absorbée par 464 l'alkali contenu dans cette première bouteille, n'échappe point à la seconde E, & ordinairement il ne passe absolument rien sous la cloche F, si ce n'est l'air commun qui étoit contenu au commencement de l'expérience dans le vuide des vaisseaux.
Le même appareil peut servir pour les fermentations putrides; mais alors il passe une quantité considérable de gaz hydrogène par le tube qrstu, lequel est reçu dans la cloche F; & comme le dégagement est rapide, sur-tout en été, il faut la changer fréquemment. Ces fermentations exigent en conséquence une surveillance continuelle, tandis que la fermentation vineuse n'en exige aucune.
On voit qu'au moyen de cet appareil on peut connoître avec une grande précision le poids des matériaux mis à fermenter, & celui de tous les produits liquides ou aériformes qui s'en sont dégagés. On peut voir les détails dans lesquels je suis entré sur le résultat de la fermentation vineuse, dans le Chapitre XIII de la première partie de cet Ouvrage, page 139.
465
§. IV.
Appareil particulier pour la décomposition de l'eau.
J'ai déjà exposé, dans la première Partie de cet Ouvrage, Chapitre VIII, page 87, les expériences relatives à la décomposition de l'eau; j'éviterai donc des répétitions inutiles, & je me bornerai à des observations très-sommaires. Les matières qui ont la propriété de décomposer l'eau, sont principalement le fer & le charbon; mais il faut pour cela qu'ils soient portés à une chaleur rouge: sans cette condition l'eau se réduit simplement en vapeurs, & elle se condense ensuite par le refroidissement, sans avoir éprouvé la moindre altération: à une chaleur rouge au contraire, le fer & le charbon enlèvent l'oxygène à l'hydrogène; dans le premier cas il se forme de l'oxide noir de fer, & l'hydrogène se dégage libre & pur sous la forme de gaz; dans le second il se forme du gaz acide carbonique qui se dégage mêlé avec le gaz hydrogène, & ce dernier est communément carbonisé.
On se sert avec avantage, pour décomposer l'eau par le fer, d'un canon de fusil dont on ôte la culasse. On trouve aisément de ces sortes 466 de canons chez les marchands de féraille. On doit choisir les plus longs & les plus forts: lorsqu'ils sont trop courts & qu'on craint que les luts ne s'échauffent trop, on y fait souder en soudure forte un bout de tuyau de cuivre. On place ce tuyau de fer dans un fourneau allongé CDEF, planche VII, fig. 11, en lui donnant une inclinaison de quelques degrés de E en F: cette inclinaison doit être un peu plus grande qu'elle n'est présentée dans la fig. 11. On adapte à la partie supérieure E de ce tuyau, une cornue de verre qui contient de l'eau & qui est placée sur un fourneau VVXX. On le lute par son extrêmité inférieure F avec un serpentin SS', qui s'adapte lui-même avec un flacon tubulé H, où se rassemble l'eau qui a échappé à la décomposition. Enfin le gaz qui se dégage est porté à la cuve où il est reçu sous des cloches par le tube KK adapté à la tubulure K du flacon H. Au lieu de la cornue A, on peut employer un entonnoir fermé d'un robinet par le bas, & par lequel on laisse couler l'eau goutte à goutte. Si-tôt que cette eau est parvenue à la partie où le tube est échauffé, elle se vaporise, & l'expérience a lieu de la même manière que si elle étoit fournie en vapeurs par le moyen de la cornue A.
Dans l'expérience que nous avons faite, 467 M. Meusnier & moi, en présence des Commissaires de l'Académie, nous n'avions rien négligé pour obtenir la plus grande précision possible dans les résultats; nous avions même porté le scrupule jusqu'à faire le vuide dans les vaisseaux avant de commencer l'expérience, afin que le gaz hydrogène que nous obtiendrions fût exempt de mêlange de gaz azote. Nous rendrons compte à l'Académie, dans un très-grand détail, des résultats que nous avons obtenus.
Dans un grand nombre de recherches on est obligé de substituer au canon de fusil des tubes de verre, de porcelaine ou de cuivre. Mais les premiers ont l'inconvénient d'être faciles à fondre: pour peu que l'expérience ne soit pas bien ménagée, le tube s'applatit & se déforme. Les tubes de porcelaine sont la plupart percés d'une infinité de petits trous imperceptibles par lesquels le gaz s'échappe, surtout s'il est comprimé par une colonne d'eau. C'est ce qui m'a déterminé à me procurer un tube de cuivre rouge, que M. de la Briche a bien voulu faire couler plein & faire forer sous ses yeux à Strasbourg. Ce tube est très-commode pour opérer la décomposition de l'alkool: on sait en effet qu'exposé à une chaleur rouge, il se résout en carbone, en gaz acide 468 carbonique & en gaz hydrogène. Ce même tube peut également servir à la décomposition de l'eau par le carbone, & à un grand nombre d'expériences.
§. V.
De la préparation & de l'emploi des Luts.
Si dans un tems où l'on perdoit une grande partie des produits de la distillation, où l'on ne tenoit aucun compte de tout ce qui se séparoit sous forme de gaz, en un mot où l'on ne faisoit aucune expérience exacte & rigoureuse, on sentoit déjà la nécessité de bien luter les jointures des appareils distillatoires; combien cette opération manuelle & mécanique n'est-elle pas devenue plus importante, depuis qu'on ne se permet plus de rien perdre dans les distillations & dans les dissolutions, depuis qu'on exige qu'un grand nombre de vaisseaux réunis ensemble se comportent comme s'ils n'étoient que d'une seule pièce, & comme s'ils étoient hermétiquement fermés; enfin depuis qu'on n'est plus satisfait des expériences, qu'autant que la somme du poids des produits obtenus est égale à celui des matériaux mis en expérience.
La première condition qu'on exige de tout 469 lut destiné à fermer les jointures des vaisseaux, est d'être aussi imperméable que le verre lui-même, de manière qu'aucune matière, si subtile qu'elle soit, à l'exception du calorique, ne puisse le pénétrer. Une livre de cire fondue avec une once & demie ou deux onces de térébenthine, remplissent très-bien ce premier objet; il en résulte un lut facile à manier, qui s'attache fortement au verre & qui ne se laisse pas facilement pénétrer: on peut lui donner plus de consistance & le rendre plus ou moins dur, plus ou moins sec, plus ou moins souple, en y ajoutant différentes résines. Cette classe de luts a l'avantage de pouvoir se ramollir par la chaleur, ce qui les rend commodes pour fermer promptement les jointures des vaisseaux: mais, quelque parfaits qu'ils soient pour contenir les gaz & les vapeurs, il s'en faut bien qu'ils puissent être d'un usage général. Dans presque toutes les opérations chimiques, les luts sont exposés à une chaleur considérable & souvent supérieure au degré de l'eau bouillante: or à ce degré les résines se ramollissent, elles deviennent presque liquides, & les vapeurs expansives contenues dans les vaisseaux se font bientôt jour & bouillonnent à travers.
On a donc été obligé d'avoir recours à des 470 matières plus propres à résister à la chaleur, & voici le lut auquel les Chimistes se sont arrêtés après beaucoup de tentatives; non pas qu'il n'ait quelques inconvéniens, comme je le dirai bientôt, mais parce qu'à tout prendre c'est encore celui qui réunit le plus d'avantages. Je vais donner quelques détails sur sa préparation & sur-tout sur son emploi: une longue expérience en ce genre m'a mis en état d'applanir aux autres un grand nombre de difficultés.
L'espèce de lut dont je parle dans ce moment, est connue des Chimistes sous le nom de lut gras. Pour le préparer on prend de l'argile non cuite, pure & très-sèche; on la réduit en poudre fine, & on la passe au tamis de soie. On la met ensuite dans un mortier de fonte, & on la bat pendant plusieurs heures à coups redoublés avec un lourd pilon de fer, en l'arrosant peu à peu avec de l'huile de lin cuite, c'est-à-dire, avec de l'huile de lin qu'on a oxygénée & rendue siccative par l'addition d'un peu de litharge. Ce lut est encore meilleur & plus tenace, il s'attache mieux au verre quand, au lieu d'huile grasse ordinaire, on emploie du vernis gras au succin. Ce vernis n'est autre chose qu'une dissolution de succin ou ambre jaune dans de l'huile de lin; mais cette dissolution n'a lieu qu'autant que le succin a été préalablement 471 fondu seul: il perd dans cette opération préalable un peu d'acide succinique & un peu d'huile. Le lut fait avec le vernis gras est, comme je l'ai dit, un peu préférable à celui fait avec de l'huile de lin seul; mais il est beaucoup plus cher, & l'excédent de qualité qu'on acquiert n'est pas en proportion de l'excédent du prix: aussi est-il rarement employé.
Le lut gras résiste très-bien à un degré de chaleur même assez violent: il est imperméable aux acides & aux liqueurs spiritueuses; il prend bien sur les métaux, sur le grès, sur la porcelaine & sur le verre, mais pourvu qu'ils ayent été préalablement bien séchés. Si par malheur dans le cours d'une opération la liqueur en distillation s'est fait jour & qu'il ait pénétré quelque peu d'humidité, soit entre le verre & le lut, soit entre différentes couches même du lut, il est d'une extrême difficulté de reboucher les ouvertures qui se sont formées; & c'est un des principaux inconvéniens, peut-être le seul, que présente l'usage du lut gras.
La chaleur ramollit ce lut, & même au point de le faire couler; il a besoin en conséquence d'être contenu. Le meilleur moyen est de le recouvrir avec des bandes de vessie, qu'on mouille & qu'on tortille tout autour. On fait 472 ensuite une ligature avec de gros fil au dessus & au-dessous du lut, puis on passe par-dessus le lut même & par conséquent par-dessus la vessie qui le recouvre, un grand nombre de tours de fil: un lut arrangé avec ces précautions, est à l'abri de tout accident.
Très-souvent la figure des jointures des vaisseaux ne permet pas d'y faire une ligature, & c'est ce qui arrive au col des bouteilles à trois gouleaux: il faut d'ailleurs beaucoup d'adresse pour serrer suffisamment le fil sans ébranler l'appareil, & dans les expériences où les luts sont très-multipliés, on en dérangeroit souvent plusieurs pour en arranger un seul. Alors on substitue à la vessie & à la ligature des bandes de toile imbibées de blanc d'œuf dans lequel on a délayé de la chaux. On applique sur le lut gras les bandes de toile encore humides; en peu de tems elles se sèchent & acquièrent une assez grande dureté. On peut appliquer ces mêmes bandes sur les luts de cire & de résine. De la colle forte délayée dans de l'eau, peut suppléer au blanc d'œuf.
La première attention qu'on doit avoir avant d'appliquer un lut quelconque sur les jointures des vaisseaux, est de les asseoir & de les assujétir solidement, de manière qu'ils ne puissent se prêter à aucun mouvement. Si c'est le col 473 d'une cornue qu'on veut luter à celui d'un récipient, il faut qu'il y entre à peu près juste; s'il y a un peu de jeu, il faut assujétir les deux vaisseaux en introduisant entre leurs cols de petits morceaux fort courts d'alumettes ou de bouchon. Si la disproportion des deux cols est trop grande, on choisit un bouchon qui entre juste dans le col du matras ou récipient; on fait au milieu de ce bouchon un trou rond de la grosseur nécessaire pour recevoir le col de la cornue.
La même précaution est nécessaire à l'égard des tubes recourbés, qui doivent être lutés à des gouleaux de bouteille, comme dans la planche IV, fig. 1. On commence par choisir un bouchon qui entre juste dans le gouleau; puis on le perce d'un trou avec une lime d'une espèce nommée queue de rat. Voyez une de ces limes représentée planc. I, fig. 16. Quand un même gouleau est destiné à recevoir deux tubes, ce qui arrive très-souvent, sur-tout à défaut de bouteilles à deux & à trois gouleaux, on perce le bouchon de deux & de trois trous, pour qu'il puisse recevoir deux ou trois tubes. On voit un de ces bouchons représenté pl. IV, fig. 8.
Ce n'est que lorsque l'appareil est ainsi solidement assujetti & de manière à ce qu'aucune 474 partie n'en puisse jouer, qu'on doit commencer à luter. On ramollit d'abord à cet effet le lut, en le pêtrissant; quelquefois même, sur-tout en hiver, on est obligé de le faire légèrement chauffer: on le roule ensuite entre les doigts, pour le réduire en petits cylindres qu'on applique sur les vases qu'on veut luter, en ayant soin de les appuyer & de les applatir sur le verre, afin qu'ils y contractent de l'adhérence. A un premier petit cylindre on en ajoute un second, qu'on applatit également, mais de manière que son bord empiète sur le précédent, & ainsi de suite. Quelque simple que soit cette opération, il n'est pas donné à tout le monde de la bien faire, & il n'est pas rare de voir les personnes peu au fait, recommencer un grand nombre de fois des luts sans succès, tandis que d'autres y réussissent avec certitude & dès la première fois. Le lut fait, on le recouvre, comme je l'ai dit, avec de la vessie bien ficelée & bien serrée, ou avec des bandes de toile imbibées de blanc d'œuf & de chaux. Je répéterai encore qu'il faut bien prendre garde, en faisant un lut & sur-tout en le ficelant, d'ébranler tous les autres; autrement on détruiroit son propre ouvrage, & on ne parviendroit jamais à clôre les vaisseaux.
On ne doit jamais commencer une expérience, 475 sans avoir essayé préalablement les luts. Il suffit pour cela, ou de chauffer très-légèrement la cornue A, planc. IV, fig. 1, ou de souffler de l'air par quelques-uns des tubes ss's''s'''; le changement de pression qui en résulte, doit changer le niveau de la liqueur dans tous les tubes; mais si l'appareil perd air de quelque part, la liqueur se remet bientôt à son niveau; elle reste au contraire constamment, soit au-dessus, soit au-dessous, si l'appareil est bien fermé.
On ne doit pas oublier que c'est de la manière de luter, de la patience, de l'exactitude qu'on y apporte, que dépendent tous les succès de la Chimie moderne: il n'est donc point d'opération qui demande plus de soins & d'attention.
Ce seroit un grand service à rendre aux Chimistes & sur-tout aux Chimistes pneumatiques, que de les mettre en état de se passer de luts, ou du moins d'en diminuer considérablement le nombre. J'avois d'abord pensé à faire construire des appareils dont toutes les parties fussent bouchées à frottement, comme les flacons bouchés en cristal; mais l'exécution m'a présenté d'assez grandes difficultés. Il m'a paru préférable de suppléer aux luts par le moyen de colonnes de mercure, de quelques lignes 476 de hauteur. Je viens de faire exécuter dans cette vue un appareil dont je vais donner la description, & dont l'usage me paroît pouvoir être utile & commode dans un grand nombre de circonstances.
Il consiste dans une bouteille A, planche XII, fig. 12, à double gouleau; l'un intérieur bc, communique avec le dedans de la bouteille; l'autre extérieur de, qui laisse un intervalle entre lui & le précédent, & qui forme tout autour une profonde rigole db, ce, destinée à recevoir du mercure. C'est dans cette rigole qu'entre & s'ajuste le couvercle de verre B. Il a par le bas des échancrures pour le passage des tubes de verre destinés au dégagement des gaz. Ces tubes, au lieu de plonger directement dans la bouteille A, comme dans les appareils ordinaires, se contournent auparavant, comme on le voit fig. 13, pour s'enfoncer dans la rigole, & pour passer par-dessous les échancrures du couvercle B: ils remontent ensuite pour entrer dans la bouteille, en passant par-dessus les bords du gouleau intérieur.
Il est aisé de voir que, lorsque les tubes ont été mis en place, que le couvercle B a été solidement assujetti, & que la rigole db, ce a été remplie de mercure, la bouteille se trouve 477 fermée & ne communique plus à l'extérieur que par les tubes.
Un appareil de cette espèce sera très-commode dans un grand nombre d'expériences; mais on ne pourra le mettre en usage que dans la distillation des matières qui n'ont point d'action sur le mercure.
M. Séguin, dont les secours actifs & intelligens m'ont été si souvent utiles, a même déjà commandé dans les verreries des cornues jointes hermétiquement à des récipiens; en sorte qu'il seroit possible de parvenir à n'avoir plus aucun lut. On voit, planche XII, fig. 14, un appareil monté d'après les principes que je viens d'exposer.

478
CHAPITRE VII.
Des Opérations relatives à la combustion proprement dite & à la détonation.
La combustion n'est autre chose, d'après ce qui a été exposé dans la première Partie de cet Ouvrage, que la décomposition du gaz oxygène opérée par un corps combustible. L'oxygène qui forme la base de ce gaz est absorbé, le calorique & la lumière deviennent libres & se dégagent. Toute combustion entraîne donc avec elle l'idée d'oxygénation, tandis qu'au contraire l'oxygénation n'entraîne pas essentiellement l'idée de combustion, puisque la combustion proprement dite ne peut avoir lieu sans un dégagement de lumière & de calorique. Il faut, pour que la combustion s'opère, que la base du gaz oxygène ait plus d'affinité avec le corps combustible, qu'elle n'en a avec le calorique: or cette attraction élective, pour me servir de l'expression de Bergman, n'a lieu qu'à un certain degré de température, qui même est différent pour chaque substance combustible; de-là la nécessité de donner le premier mouvement à la combustion par l'approche d'un corps chaud. Cette nécessité d'échauffer le corps 479 qu'on se propose de brûler, tient à des considérations qui n'ont encore fixé l'attention d'aucun Physicien, & auxquels je demande la permission de m'arrêter quelques instans; on verra qu'elles ne s'éloignent pas de mon sujet.
L'état actuel où nous voyons la nature est un état d'équilibre auquel elle n'a pu arriver qu'après que toutes les combustions spontanées possibles au degré de chaleur dans lequel nous vivons, toutes les oxygénations possibles ont eu lieu. Il ne peut donc y avoir de nouvelles combustions ou oxygénations, qu'autant qu'on sort de cet état d'équilibre & qu'on transporte les substances combustibles dans une température plus élevée. Eclaircissons par un exemple ce que cet énoncé peut présenter d'abstrait. Supposons que la température habituelle de la terre changeât d'une très-petite quantité, & qu'elle devînt seulement égale à celle de l'eau bouillante: il est évident que le phosphore étant combustible beaucoup au-dessous de ce degré, cette substance n'existeroit plus dans la nature dans son état de pureté & de simplicité, elle se présenteroit toujours dans l'état d'acide, c'est-à-dire oxygénée, & son radical seroit au nombre des substances inconnues. Il en seroit successivement de même de tous les corps combustibles, si la température de la terre devenoit 480 de plus en plus élevée; & on arriveroit enfin à un point où toutes les combustions possibles seroient épuisées, où il ne pourroit plus exister de corps combustibles, où tous seroient oxygénés & par conséquent incombustibles.
Revenons donc à dire qu'il ne peut y avoir pour nous de corps combustibles, que ceux qui sont incombustibles au degré de température dans lequel nous vivons; ou ce qui veut dire la même chose en d'autres termes, qu'il est de l'essence de tout corps combustible de ne pouvoir jouir de la propriété combustible, qu'autant qu'on l'échauffe & qu'on le transporte au degré de chaleur où s'opère sa combustion. Ce degré une fois atteint la combustion commence, & le calorique qui se dégage par l'effet de la décomposition du gaz oxygène, entretient le degré de température nécessaire pour la continuer. Lorsqu'il en est autrement, c'est-à-dire, lorsque le calorique fourni par la décomposition du gaz oxygène n'est pas suffisant pour que le degré de chaleur nécessaire à la combustion se continue, elle cesse: c'est ce qu'on exprime lorsqu'on dit que le corps brûle mal, qu'il est difficilement combustible.
Quoique la combustion ait quelque chose de commun avec la distillation, sur-tout avec la distillation composée, elle en diffère cependant 481 en un point essentiel. Il y a bien dans la distillation séparation d'une partie des principes du corps que l'on y soumet, & combinaison de ces mêmes principes dans un autre ordre, déterminé par les affinités qui ont lieu à la température à laquelle s'est opérée la distillation; mais il y a plus dans la combustion, il y a addition d'un nouveau principe, l'oxygène, & dissipation d'un autre principe, le calorique.
C'est cette nécessité d'employer l'oxygène dans l'état de gaz & d'en déterminer rigoureusement les quantités, qui rend si embarrassantes les expériences relatives à la combustion. Une autre difficulté inséparable de ces opérations, tient à ce que les produits qu'elles fournissent se dégagent presque toujours dans l'état de gaz: si donc il est difficile de retenir & de rassembler les produits de la distillation, il l'est bien davantage de recueillir ceux de la combustion; aussi aucun des anciens Chimistes n'en a-t-il eu la prétention, & ce genre d'expérience appartient-il absolument à la Chimie moderne.
Après avoir rappelé d'une manière générale le but qu'on doit se proposer dans les différentes expériences relatives à la combustion, je passe à la description des différens appareils que j'ai imaginés dans cette vue. Je n'adopterai dans les articles qui composeront ce Chapitre, aucune 482 division relative à la nature des combustibles; je les classerai relativement à la nature des appareils qui conviennent à leur combustion.
§. I.
De la Combustion du Phosphore & du Charbon.
J'ai déjà décrit, page 57 de cet Ouvrage, les appareils que j'ai employés pour la combustion du charbon & du phosphore. Cependant, comme j'avois alors plutôt en vue de donner une idée du résultat de ces combustions, que d'enseigner le détail des procédés nécessaires pour les obtenir, je ne me suis peut-être pas assez étendu sur la manipulation relative à ce genre d'expériences.
On commence, pour opérer la combustion du phosphore ou du charbon, par remplir de gaz oxygène dans l'appareil pneumato-chimique à l'eau, pl. V, fig. 1, une cloche de six pintes au moins de capacité. Lorsqu'elle est pleine à rase & que le gaz commence à dégorger par-dessous, on transporte cette cloche A sur l'appareil au mercure, planche IV, fig. 3, à l'aide d'un vaisseau de verre ou de fayance très-plat, qu'on passe par-dessous. Cette opération faite, on sèche bien avec du papier gris la surface du 483 mercure, tant dans l'intérieur qu'à l'extérieur de la cloche. Cette opération demande quelques précautions: si on n'avoit pas l'attention de plonger le papier gris pendant quelque tems entièrement sous le mercure avant de l'introduire sous la cloche, on y feroit passer de l'air commun qui s'attache avec beaucoup de ténacité au papier.
On a d'un autre côté une petite capsule D, de fer ou de porcelaine plate & évasée, sur laquelle on place le corps qu'on veut brûler, après en avoir très-exactement déterminé le poids à la balance d'essai; on recouvre ensuite cette capsule d'une autre un peu plus grande P, qui fait à son égard l'office de la cloche du plongeur, & on fait passer le tout à travers le mercure: après quoi on retire à travers le mercure la capsule P qui ne servoit en quelque façon que de couvercle. On peut éviter l'embarras & la difficulté de faire passer les matières à travers le mercure, en soulevant un des côtés de la cloche pendant un instant presqu'indivisible, & en introduisant ainsi, par le passage qu'on s'est ménagé, la capsule avec le corps combustible. Il se mêle dans cette seconde manière d'opérer un peu d'air commun avec le gaz oxygène; mais ce mêlange qui est peu considérable, ne nuit ni au succès, ni à l'exactitude de l'expérience.
484
Lorsque la capsule D, planche IV, fig. 3, est introduite sous la cloche, on suce une partie du gaz oxygène qu'elle contient pour élever le mercure jusqu'en EF. Sans cette précaution, dès que le corps combustible seroit allumé, la chaleur dilateroit l'air; elle en feroit passer une portion par-dessous la cloche, & on ne pourroit plus faire aucun calcul exact sur les quantités. On se sert, pour sucer l'air, d'un siphon GHI, qu'on passe par-dessous la cloche; & pour qu'il ne s'emplisse pas de mercure, on tortille à son extrêmité I un petit morceau de papier.
Il y a un art pour élever ainsi en suçant une colonne de mercure à une hauteur de plusieurs pouces au-dessous de son niveau: si on se contentoit d'aspirer l'air avec le poumon, on n'atteindroit qu'à une très-médiocre élévation, par exemple, d'un pouce ou d'un pouce & demi tout au plus; encore n'y parviendroit-on qu'avec de grands efforts; tandis que par l'action des muscles de la bouche on peut élever sans se fatiguer, ou au moins sans risquer de s'incommoder, le mercure jusqu'à six à sept pouces. Un moyen plus commode encore est de se servir d'une petite pompe que l'on adapte au siphon GHI: on élève alors le mercure à telle hauteur qu'on le juge à propos, pourvu qu'elle n'excède pas 28 pouces.
485
Si le corps combustible est fort inflammable, comme le phosphore, on l'allume avec un fer recourbé MN, planche IV, fig. 16, qu'on fait rougir au feu, & qu'on passe brusquement sous la cloche: dès qu'il est en contact avec le phosphore, ce dernier s'allume. Pour les corps moins combustibles, tels que le fer, quelques autres métaux, le charbon, &c. on se sert d'un petit fragment d'amadoue sur lequel on place un atôme de phosphore: on allume également ce dernier avec un fer rouge recourbé; l'inflammation se communique à l'amadoue, puis au corps combustible.
Dans le premier instant de la combustion, l'air se dilate & le mercure descend; mais lorsqu'il n'y a point de fluide élastique formé, comme dans la combustion du fer & du phosphore, l'absorption devient bientôt sensible, & le mercure remonte très-haut dans la cloche. Il faut en conséquence avoir attention de ne point brûler une trop grande quantité du corps combustible dans une quantité donnée d'air; autrement la capsule, vers la fin de la combustion, s'approcheroit trop du dôme de la cloche, & la grande chaleur pourroit en occasionner la fracture.
J'ai indiqué, Chapitre II, §. V & VI, les opérations relatives à la mesure du volume des gaz, 486 les corrections qu'il faut faire à ce volume, relativement à la hauteur du baromètre & au degré du thermomètre; je n'ajouterai rien de plus à cet égard, l'exemple sur-tout que j'ai cité, page 381, étant précisément tiré de la combustion du phosphore.
Le procédé que je viens de décrire peut être employé avec succès pour la combustion de toutes les substances concrètes, & même pour celle des huiles fixes. On brûle ces dernières dans des lampes, & on les allume avec assez de facilité sous la cloche, par le moyen du phosphore, de l'amadoue & d'un fer chaud; mais ce moyen n'est pas sans dangers pour les substances qui sont susceptibles de se vaporiser à un degré de chaleur médiocre, telles que l'éther, l'esprit-de-vin, les huiles essentielles. Ces substances volatiles se dissolvent en assez grande quantité dans le gaz oxygène; quand on allume, il se fait une détonation subite qui enlève la cloche à une grande hauteur & qui la brise en éclats. J'ai éprouvé deux de ces détonations, dont des membres de l'Académie ont pensé, ainsi que moi, être les victimes. Cette manière d'opérer a d'ailleurs un grand inconvénient: elle suffit bien pour déterminer avec quelque exactitude la quantité de gaz oxygène absorbé, & celle d'acide carbonique qui s'est formé; mais 487 ces produits ne sont pas les seuls qui résultent de la combustion: il se forme de l'eau toutes les fois qu'on opère sur des matières végétales ou animales, parce qu'elles contiennent toutes de l'hydrogène en excès; or l'appareil que je viens de décrire, ne permet ni de la rassembler, ni d'en déterminer la quantité. Enfin, même pour l'acide phosphorique, l'expérience est incomplète, puisqu'il n'est pas possible de démontrer dans cette manière d'opérer, que le poids de l'acide est égal à la somme du poids du phosphore & de celui du gaz oxygène absorbé. Je me suis donc trouvé obligé de varier, suivant les cas, les appareils relatifs à la combustion, & d'en employer plusieurs de différentes espèces, dont je vais donner successivement une idée: je commence par celui destiné à la combustion du phosphore.
On prend un grand ballon de verre blanc ou de cristal A, pl. IV, fig. 4, dont l'ouverture EF doit avoir deux pouces & demi à trois pouces de diamètre. Cette ouverture se recouvre avec une plaque de cuivre jaune ou laiton usée à l'émeri, & qui est percée de deux trous pour le passage des tuyaux xxx, yyy.
Avant de fermer le ballon avec sa plaque, on introduit dans son intérieur un support BC surmonté d'une capsule D de porcelaine, sur 488 laquelle on place le phosphore. On lute ensuite la plaque de cuivre au ballon en EF avec du lut gras qu'on recouvre avec des bandes de linge imbibées de blanc d'œuf & saupoudrées de chaux. On laisse sécher pendant plusieurs jours, puis on pèse le tout avec une bonne balance. Ces préparatifs achevés, on adapte une pompe pneumatique au tuyau xxx, & on fait le vuide dans le ballon; après quoi on introduit du gaz oxygène par le tuyau yyy, au moyen du gazomètre représenté planche VIII, figure 1, & dont j'ai donné la description, Chapitre II, §. II. On allume ensuite le phosphore avec un verre ardent, & on le laisse brûler jusqu'à ce que le nuage d'acide phosphorique concret qui se forme arrête la combustion. Alors on délute & on pèse le ballon. Le poids, déduction faite de la tarre, donne celui de l'acide phosphorique qu'il contient. Il est bon, pour plus d'exactitude, d'examiner l'air ou le gaz contenu dans le ballon après la combustion, parce qu'il peut être plus ou moins pesant que l'air ordinaire, & qu'il faut tenir compte dans les calculs relatifs à l'expérience, de cette différence de pesanteur.
Les mêmes motifs qui m'ont engagé à construire un appareil particulier pour la combustion du phosphore, m'ont déterminé de prendre 489 le même parti à l'égard du charbon. Cet appareil consiste en un petit fourneau conique fait en cuivre battu, représenté en perspective, plan. XII, figure 9, & vu intérieurement, figure 11. On y distingue le fourneau proprement dit ABC, où doit se faire la combustion du charbon, la grille de & le cendrier F. Au milieu du fourneau est un tuyau GH, par lequel on introduit le charbon & qui sert en même tems de cheminée pour évacuer l'air qui a servi à la combustion.
C'est par le tuyau lmn qui communique avec le gazomètre, qu'est amené l'air qui est destiné à entretenir la combustion; cet air se répand dans la capacité du cendrier F, & la pression qui lui est communiquée par le gazomètre, l'oblige à passer par la grille de, & à souffler les charbons qui sont posés immédiatement dessus.
Le gaz oxygène qui entre pour les 28/100 dans la composition de l'air de l'atmosphère, se convertit, comme l'on sait, en gaz acide carbonique dans la combustion du charbon. Le gaz azote au contraire ne change point d'état; il doit donc rester, après la combustion, un mêlange de gaz azote & de gaz acide carbonique. Pour donner issue à ce mêlange, on a adapté à la cheminée GH un tuyau op qui s'y visse 490 en G, de manière à ne laisser échapper aucune portion d'air. Le mêlange des deux gaz est conduit par ce tuyau à des bouteilles remplies de potasse en liqueur & bien dépouillée d'acide carbonique, à travers laquelle il bouillonne. Le gaz acide carbonique est absorbé par la potasse, & il ne reste que du gaz azote qu'on reçoit dans un second gazomètre pour en déterminer la quantité.
Une des difficultés que présente l'usage de cet appareil, est d'allumer le charbon & de commencer la combustion: voici le moyen d'y parvenir. Avant d'emplir de charbon le fourneau ABC, on en détermine le poids avec une bonne balance & de manière à être sûr de ne point commettre une erreur de plus d'un ou deux grains; on introduit ensuite dans la cheminée GH le tuyau RS, figure 10, dont le poids doit également avoir été bien déterminé. Ce tuyau est creux & ouvert par les deux bouts: son extrémité S doit descendre jusqu'au fond du fourneau; elle doit porter sur la grille de & l'occuper toute entière. Ce n'est qu'après que le tuyau RS a été ainsi placé, qu'on introduit le charbon dans le fourneau. On le pèse alors de nouveau, pour connoître la quantité de charbon qui y a été introduite. Ces opérations préliminaires achevées, on met en place le 491 fourneau, on visse le tuyau lmn, figure 9, avec celui qui communique avec le gazomètre; on visse le tuyau op avec celui qui conduit aux bouteilles remplies de potasse: enfin au moment où l'on veut commencer la combustion, on ouvre le robinet du gazomètre, & on jette un petit charbon allumé par l'extrémité R du tuyau RS; ce charbon tombe sur la grille où le courant d'air le maintient allumé. Alors on retire promptement le tuyau RS; on visse à la cheminée le tuyau op destiné à évacuer l'air, & on continue la combustion. Pour être assuré qu'elle est vraiment commencée & que l'opération a réussi, on a ménagé un tuyau qrs garni à son extrémité s d'un verre mastiqué, à travers lequel on peut voir si le charbon est allumé. J'oubliois d'observer que ce fourneau & ses dépendances sont plongés dans une espèce de baquet allongé TVXY, fig. 11, qui est rempli d'eau & même de glace, afin de diminuer autant que l'on veut la chaleur de la combustion. Cette chaleur au surplus n'est jamais très-vive, parce qu'il ne peut y avoir de combustion qu'en proportion de l'air qui est fourni par le gazomètre, & qu'il n'y a d'ailleurs de charbon qui brûle que celui qui porte immédiatement sur la grille. A mesure qu'une molécule de charbon est consommée, il en retombe une autre en 492 vertu de l'inclinaison des parois du fourneau; elle se présente au courant d'air qui traverse la grille de, & elle brûle comme la première.
Quant à l'air qui a servi à la combustion, il traverse la masse de charbon qui n'a pas encore brûlé, & la pression exercée par le gazomètre l'oblige de s'échapper par le tuyau op, & de traverser les bouteilles remplies d'alkali.
On voit que dans cette expérience on a toutes les données nécessaires pour obtenir une analyse complette de l'air atmosphérique & du charbon. En effet, on connoît le poids du charbon; on a par le moyen du gazomètre la mesure de la quantité d'air employée à la combustion; on peut déterminer la qualité & la quantité de celui qui reste après la combustion; on a le poids de la cendre qui s'est rassemblée dans le cendrier: enfin l'augmentation de poids des bouteilles qui contiennent la potasse en liqueur, donne la quantité d'acide carbonique qui s'est formé. On peut également connoître avec beaucoup de précision, par cette opération, la proportion de carbone & d'oxygène dont cet acide est composé.
Je rendrai compte dans les Mémoires de l'Académie, de la suite d'expériences que j'ai entreprises avec cet appareil sur tous les charbons végétaux & animaux. Il n'est pas difficile 493 de voir qu'avec très-peu de changemens on peut en faire une machine propre à observer les principaux phénomènes de la respiration.
§. II.
De la Combustion des Huiles.
Le charbon, au moins quand il est pur, étant une substance simple, l'appareil destiné à le brûler ne pouvoit pas être très-compliqué. Tout se réduisoit à lui fournir le gaz oxygène nécessaire à sa combustion, & à séparer ensuite d'avec le gaz azote le gaz acide carbonique qui s'étoit formé. Les huiles sont plus composées que le charbon, puisqu'elles résultent de la combinaison au moins de deux principes, le carbone & l'hydrogène; il reste en conséquence, après qu'on les a brûlées dans l'air commun, de l'eau, du gaz acide carbonique & du gaz azote. L'appareil qu'on emploie pour ce genre d'expériences, doit avoir pour objet de séparer & de recueillir ces trois espèces de produit.
Je me sers, pour brûler les huiles, d'un grand bocal A représenté planche XII, fig 4, & de son couvercle, figure 5. Ce bocal est garni d'une virole de fer BCDE, qui s'applique exactement sur le bocal en DE, & qui y est solidement mastiquée. Cette virole prend un 494 plus grand diamètre en BC, & laisse entr'elle & les parois du bocal un intervalle ou rigole xxxx, qu'on remplit de mercure: le couvercle représenté fig. 5, a de son côté en fg une virole de fer qui s'ajuste dans la rigole xxxx du bocal, & qui plonge dans le mercure; Le bocal A peut par ce moyen se fermer en un instant hermétiquement & sans lut; & comme la rigole peut contenir une hauteur de mercure de deux pouces, on voit qu'on peut faire éprouver à l'air contenu dans le bocal une pression de plus de deux pieds d'eau, sans risquer qu'elle surmonte la résistance du mercure.
Le couvercle, fig. 5, est percé de quatre trous destinés au passage d'un égal nombre de tuyaux. L'ouverture T est d'abord garnie d'une boëte à cuir à travers laquelle doit passer la tige représentée fig. 3. Cette tige est destinée à remonter ou à descendre la mêche de la lampe, comme je l'expliquerai ci-après; les trois autres trous h, i, k, sont destinés, savoir, le premier au passage du tuyau qui doit amener l'huile, le second au passage du tuyau qui doit amener l'air à la lampe pour entretenir la combustion, le troisième au passage du tuyau qui doit donner issue à ce même air lorsqu'il a servi à la combustion.
La lampe destinée à brûler l'huile dans le 495 bocal, est représentée séparément, fig. 2 de la même planche; on y voit le réservoir à huile a avec une espèce d'entonnoir par lequel on le remplit; le siphon bcdefgh, qui fournit l'huile à la lampe; le tuyau 7, 8, 9, 10, qui amène l'air du gazomètre à la même lampe.
Le tuyau bc est taraudé extérieurement dans sa partie inférieure b, & se visse dans un écrou contenu dans le couvercle du réservoir A; par ce moyen, en tournant le réservoir, on peut le faire monter ou descendre & amener l'huile à la lampe, au niveau où on le juge à propos.
Quand on veut remplir le siphon & établir la communication entre l'huile du réservoir a & celle de la lampe 11, on ferme d'abord le robinet c, on ouvre celui e, & on verse de l'huile par l'ouverture f, qui est au haut du siphon. Dès qu'on voit paroître l'huile dans la lampe 11 à un niveau convenable, c'est-à-dire à trois ou quatre lignes des bords, on ferme le robinet k; on continue à verser de l'huile par l'ouverture e, pour remplir la branche bcd. Quand elle est remplie, on ferme le robinet f, & alors les deux branches du siphon étant pleines d'huile sans interruption, la communication du réservoir à la lampe est établie.
La figure 1, même planche XII, représente 496 la coupe de la lampe grossie pour rendre les détails plus frappans & plus sensibles. On y voit le tuyau ik, qui apporte l'huile; aaaa, la capacité qu'occupe la mêche; 9 & 10, le tuyau qui apporte l'air à la lampe: cet air se répand dans la capacité dddddd, puis il se distribue par le canal cccc & par celui bbbb, en-dedans & en-dehors de la mêche, à la manière des lampes d'Argand, Quinquet & Lange.
Pour faire mieux connoître l'ensemble de cet appareil, & pour que sa description même rende plus facile l'intelligence de tous les autres de même genre, je l'ai représenté tout entier en perspective, planche XI. On y voit le gazomètre P qui fournit l'air; l'ajutage 1 & 2 par lequel il sort, & qui est garni d'un robinet 1; 2 & 3, un tuyau qui communique de ce premier gazomètre à un second, que l'on emplit pendant que le premier se vuide, afin que l'émission de l'air se fasse sans interruption pendant tout le tems que doit durer l'opération; 4 & 5, un tube de verre garni d'un sel déliquescent en morceaux médiocrement gros, afin que l'air, en se distribuant dans les interstices, y dépose une grande partie de l'eau qu'il tenoit en dissolution. Comme on connoît le poids du tube & celui du sel déliquescent qu'il contient, 497 il est toujours facile de connoître la quantité d'eau qu'il a absorbée.
Du tube 4 & 5 que je nommerai tube déliquescent, l'air est conduit à la lampe 11 par le tube 5, 6, 7, 8, 9, 10. Là il se divise; une partie vient alimenter la flamme par-dehors, l'autre par-dedans, à la manière des lampes d'Argand, Quinquet & Lange. Cet air, dont une partie a ainsi servi à la combustion de l'huile, forme avec elle en l'oxygénant du gaz acide carbonique & de l'eau. Une partie de cette eau se condense sur les parois du bocal A, une autre partie est tenue en dissolution dans l'air par la chaleur de la combustion: mais cet air qui est poussé par la pression qu'il reçoit du gazomètre, est obligé de passer par le tuyau 12, 13, 14 & 15, d'où il est conduit dans la bouteille 16 & dans le serpentin 17 & 18, où l'eau achève de se condenser à mesure que l'air se refroidit. Enfin si quelque peu d'eau restoit encore en dissolution dans l'air, elle seroit absorbée par le sel déliquescent contenu dans le tube 19 & 20.
Toutes les précautions qu'on vient d'indiquer n'ont d'autre objet que de recueillir l'eau qui s'est formée, & d'en déterminer la quantité: il reste ensuite à évaluer l'acide carbonique & le gaz azote. On y parvient au moyen des bouteilles 498 22 & 25, qui sont à moitié remplies de potasse en liqueur & dépouillée d'acide carbonique par la chaux. L'air qui a servi à la combustion, y est conduit par les tuyaux 20, 21, 23 & 24, & il y dépose le gaz acide carbonique qu'il contient. On n'a représenté dans cette figure, pour la simplifier, que deux bouteilles remplies de potasse en liqueur; mais il en faut beaucoup davantage, & je ne crois pas qu'on puisse en employer moins de neuf. Il est bon de mettre dans la dernière de l'eau de chaux, qui est le réactif le plus sûr & le plus sensible pour reconnoître l'acide carbonique: si elle ne se trouble pas, on peut être assuré qu'il ne reste pas de gaz acide carbonique dans l'air, du moins en quantité sensible.
Il ne faut pas croire que l'air qui a servi à la combustion, lorsqu'il a traversé les neuf bouteilles, ne contienne plus que du gaz azote; il est encore mêlé d'une assez grande quantité de gaz oxigène qui a échappé à la combustion. On fait passer ce mêlange à travers un sel déliquescent contenu dans le tube de verre 28 & 29, afin de le dépouiller des portions d'eau qu'il auroit pu dissoudre en traversant les bouteilles de potasse & d'eau de chaux. Enfin on conduit le résidu d'air à un gazomètre par le tuyau 29 & 30: on en détermine la 499 quantité; on en prend des échantillons qu'on essaye par le sulfure de potasse, afin de savoir la proportion de gaz oxygène & de gaz azote qu'il contient.
On sait que dans la combustion des huiles, la mêche se charbonne au bout d'un certain tems, & qu'elle s'obstrue. Il y a d'ailleurs une longueur déterminée de mêche qu'il faut atteindre, mais qu'il ne faut pas outre-passer, sans quoi il monte par les tuyaux capillaires de la mêche plus d'huile que le courant d'air n'en peut consommer, & la lampe fume. Il étoit donc nécessaire qu'on pût allonger ou raccourcir la mêche de dehors & sans ouvrir l'appareil: c'est à quoi on est parvenu, au moyen de la tige 31, 32, 33 & 34, qui passe à travers une boëte à cuir & qui répond au porte-mêche. On a donné à cette tige un mouvement très-doux au moyen d'un pignon qui engraine dans une crémaillère. On voit cette tige & ses accessoires représentés séparément, pl. XII, fig. 3.
Il m'a semblé encore qu'en enveloppant la flamme de la lampe avec un petit bocal de verre ouvert par les deux bouts, la combustion en alloit mieux. Ce bocal est en place dans la planche XI.
Je n'entrerai pas dans de plus grands détails 500 sur la construction de cet appareil, qui est susceptible d'être changé & modifié de différentes manières. Je me contenterai d'ajouter que, lorsqu'on veut opérer, on commence par peser la lampe avec son réservoir & l'huile qu'elle contient; qu'on la met en place; qu'on l'allume; qu'après avoir donné de l'air en ouvrant le robinet du gazomètre, on place le bocal A; qu'on l'assujétit au moyen d'une petite planche BC, sur laquelle il repose, & de deux tiges de fer qui la traversent & qui se vissent au couvercle. Il y a de cette manière un peu d'huile brûlée pendant qu'on ajuste le bocal au couvercle & l'on en perd le produit; il y a également une petite portion d'air qui s'échappe du gazomètre & qu'on ne peut recueillir; mais ces quantités sont peu considérables dans des expériences en grand; elles sont d'ailleurs susceptibles d'être évaluées.
Je rendrai compte dans les Mémoires de l'Académie, des difficultés particulières attachées à ce genre d'expériences, & des moyens de les lever. Ces difficultés sont telles, qu'il ne m'a pas encore été possible d'obtenir des résultats rigoureusement exacts pour les quantités. J'ai bien la preuve que les huiles fixes se résolvent entièrement en eau & en gaz acide carbonique, qu'elles sont composées d'hydrogène & de carbone; 501 mais je n'ai rien d'absolument certain sur les proportions.
§. III.
De la Combustion de l'Esprit-de-vin ou Alkool.
La combustion de l'alkool peut à la rigueur se faire dans l'appareil qui a été décrit ci-dessus pour la combustion du charbon & pour celle du phosphore. On place sous une cloche A, planche IV, fig. 3, une lampe remplie d'alkool; on attache à la mêche un atôme de phosphore, & on allume avec un fer recourbé qu'on passe par-dessous la cloche: mais cette manière d'opérer est susceptible de beaucoup d'inconvéniens. Il seroit d'abord imprudent d'employer du gaz oxygène, par la crainte de la détonation: on n'est pas même entièrement exempt de ce risque, lorsque l'on emploie de l'air atmosphérique, & j'en ai fait, en présence de quelques membres de l'Académie, une épreuve qui a pensé leur devenir funeste ainsi qu'à moi. Au lieu de préparer l'expérience comme j'étois dans l'habitude de le faire, au moment même où je devois opérer, je l'avois disposée dès la veille. L'air atmosphérique contenu dans la cloche, avoit eu en conséquence le tems de dissoudre de l'alkool: la vaporisation de l'alkool 502 avoit même été favorisée par la hauteur de la colonne de mercure que j'avois élevée en EF, planche IV, fig. 3. En conséquence, au moment où je voulus allumer le petit morceau de phosphore & la lampe avec le fer rouge, il se fit une détonation violente qui enleva la cloche & qui la brisa en mille pièces contre le plancher du laboratoire. Il résulte de l'impossibilité où l'on est d'opérer dans du gaz oxygène, qu'on ne peut brûler par ce moyen que de très-petites quantités d'alkool, de 10 à 12 grains par exemple, & les erreurs qu'on peut commettre sur d'aussi petites quantités, ne permettent de prendre aucune confiance dans les résultats. J'ai essayé dans les expériences dont j'ai rendu compte à l'Académie (Voy. Mém. Acad. année 1784, pag. 593) de prolonger la durée de la combustion, en allumant la lampe d'alkool dans l'air ordinaire, & en refournissant ensuite du gaz oxygène sous la cloche à mesure qu'il s'en étoit consommé; mais le gaz acide carbonique qui se forme met obstacle à la combustion, d'autant plus que l'alkool est peu combustible & qu'il brûle difficilement dans de l'air moins bon que l'air commun; on ne peut donc encore brûler de cette manière que de très-petites quantités d'alkool.
Peut-être cette combustion réussiroit-elle 503 dans l'appareil représenté planche XI; mais je n'ai pas osé l'y tenter. Le bocal A où se fait la combustion, a environ 1400 pouces cubiques de capacité; & s'il se faisoit une détonation dans un aussi grand vaisseau, elle auroit des suites terribles dont il seroit difficile de se garantir. Je ne renonce pas cependant à la tenter.
C'est par une suite de ces difficultés que je me suis borné jusqu'ici à des expériences très en petit sur l'alkool, ou bien à des combustions faites, dans des vaisseaux ouverts, comme dans l'appareil représenté pl. IX, fig. 5, dont je donnerai la description dans le §. 5 de ce Chapitre.
Je reprendrai dans d'autres tems la suite de ce travail, si du moins je puis parvenir à lever les obstacles qu'il m'a présentés jusqu'ici.
§. IV.
De la Combustion de l'Ether.
La combustion de l'éther en vaisseaux clos, ne comporte pas précisément les mêmes difficultés que celle de l'alkool; mais elle en présente d'un autre genre qui ne sont pas moins difficiles à vaincre, & qui m'arrêtent encore dans ce moment.
J'avois cru pouvoir profiter, pour opérer 504 cette combustion, de la propriété qu'a l'éther de se dissoudre dans l'air de l'atmosphère, & de le rendre inflammable sans détonation. J'ai fait construire, d'après cette idée, un réservoir à éther abcd, pl. XII, fig. 8, auquel l'air du gazomètre est amené par un tuyau 1, 2, 3, 4. Cet air se répand d'abord dans un double fond pratiqué à la partie supérieure ac du réservoir. Là il se distribue par sept tuyaux descendans ef, gh, ik, &c. & la pression qu'il reçoit de la part du gazomètre, l'oblige de bouillonner à travers l'éther contenu, dans le vase abcd.
On peut, à mesure que l'éther est ainsi dissous & emporté par l'air, en rendre au réservoir abcd, au moyen d'un réservoir supplémentaire E, porté par un tuyau de cuivre op, de 15 à 18 pouces de haut, & qui se ferme au moyen d'un robinet. J'ai été obligé de donner une assez grande hauteur à ce tuyau, afin que l'éther qui est contenu dans le flacon E puisse vaincre la résistance occasionnée par la pression exercée par le gazomètre.
L'air ainsi chargé de vapeurs d'éther est repris par le tuyau 5, 6, 7, 8, 9, & conduit dans le bocal A où il s'échappe par un ajutoir très-fin à l'extrêmité duquel on l'allume. Ce même air, après avoir servi à la combustion, passe par la bouteille 16, planche XI, par le serpentin 505 17 & 18, & par le tube déliquescent où il dépose l'eau dont il s'étoit chargé; le gaz acide carbonique est ensuite absorbé par l'alkali contenu dans les bouteilles 22 & 25.
Je supposois, lorsque j'ai fait construire cet appareil, que la combinaison d'air atmosphérique & d'éther qui s'opère dans le réservoir abcd, planc. XII, figure 8, étoit dans la juste proportion qui convient à la combustion, & c'est en quoi j'étois dans l'erreur: il y a un excès d'éther très-considérable, & il faut en conséquence une nouvelle combinaison d'air atmosphérique pour opérer la combustion totale. Il en résulte qu'une lampe construite de cette manière brûle dans l'air ordinaire qui fournit la quantité d'oxygène manquante pour la combustion; mais qu'elle ne peut brûler dans des vaisseaux où l'air ne se renouvelle pas. Aussi la lampe s'éteignoit-elle peu de tems après qu'elle étoit enfermée dans le bocal A, planche XII, figure 8. Pour remédier à cet inconvénient, j'ai essayé d'amener à cette lampe de l'air atmosphérique par un tuyau latéral 9, 10, 11, 12, 13, 14 & 15; & je l'ai distribué circulairement autour de la mêche: mais quelque léger que fût le courant d'air, la flamme étoit si mobile, elle tenoit si peu à la mêche, qu'il suffisoit pour la souffler; en sorte que je 506 n'ai point encore pu réussir à la combustion de l'éther. Je ne désespère cependant pas d'y parvenir, au moyen de quelques changemens que je fais faire à cet appareil.
§. V.
De la Combustion du Gaz hydrogène, & de la Formation de l'Eau.
La formation de l'eau a cela de particulier, que les deux substances qui y concourent, l'oxygène & l'hydrogène, sont l'une & l'autre dans l'état aériforme avant la combustion, & que l'une & l'autre se transforment par le résultat de cette opération, en une substance liquide qui est l'eau.
Cette combustion seroit donc fort simple & n'exigeroit pas des appareils fort compliqués, s'il étoit possible de se procurer des gaz oxygène & hydrogène parfaitement purs & qui fussent combustibles sans reste. On pourroit alors opérer dans de très-petits vaisseaux; & en y refournissant continuellement les deux gaz dans la proportion convenable, on continueroit indéfiniment la combustion. Mais jusqu'ici les Chimistes n'ont encore employé que du gaz oxygène mélangé de gaz azote. Il en a résulté qu'ils n'ont pu entretenir que pendant un tems limité & très-court la combustion du gaz hydrogène 507 dans des vaisseaux clos: & en effet, le résidu de gaz azote augmentant continuellement, la flamme s'affoiblit & elle finit par s'éteindre. Cet inconvénient est d'autant plus grand, que le gaz oxygène qu'on emploie est moins pur: il faut alors, ou cesser la combustion & se résoudre à n'opérer que sur de petites quantités, ou refaire le vuide pour se débarrasser du gaz azote: mais dans ce dernier cas on vaporise une portion de l'eau qui s'est formée, & il en résulte une erreur d'autant plus dangereuse, qu'on n'a pas de moyen sûr de l'apprécier.
Ces réflexions me font désirer de pouvoir répéter un jour les principales expériences de la Chimie pneumatique avec du gaz oxygène absolument exempt de mêlange de gaz azote, & le sel muriatique oxygéné de potasse en fournit les moyens. Le gaz oxygène qu'on en retire ne paroît contenir de l'azote qu'accidentellement; en sorte qu'avec des précautions on pourra l'obtenir parfaitement pur. En attendant que j'aye pu reprendre cette suite d'expériences, voici l'appareil que nous avons employé, M. Meusnier & moi, pour la combustion du gaz hydrogène. Il n'y aura rien à y changer, lorsqu'on aura pu se procurer des gaz purs, si ce n'est qu'on pourra diminuer la capacité du vase où se fait la combustion.
508
J'ai pris un matras ou ballon à large ouverture A, pl. IV, fig. 5, & j'y ai adapté une platine BC, à laquelle étoit soudée une douille creuse de cuivre gFD, fermée par le haut & à laquelle venoient aboutir trois tuyaux. Le premier dDd' se terminoit en d' par une ouverture très-petite & à peine capable de laisser passer une aiguille fine; il communiquoit avec le gazomètre représenté pl. VIII, fig. 1, lequel étoit rempli de gaz hydrogène. Le tuyau opposé gg communiquoit avec un autre gazomètre tout semblable, qui étoit rempli de gaz oxygène: un troisième tuyau Hh s'adaptoit à une machine pneumatique, pour qu'on pût faire le vuide dans le ballon A. Enfin la platine BC étoit en outre percée d'un trou garni d'un tube de verre à travers lequel passoit un fil de métal gL, à l'extrémité duquel étoit adaptée une petite boule L de cuivre, afin qu'on pût tirer une étincelle électrique de L en d', & allumer ainsi le gaz hydrogène amené par le tuyau dDd'.
Pour que les deux gaz arrivassent aussi secs qu'il étoit possible, on avoit rempli deux tubes MM, NN, d'un pouce & demi de diamètre environ, & d'un pied de longueur, avec de la potasse concrète bien dépouillée d'acide carbonique & concassée en morceaux assez gros pour que les gaz pussent passer librement 509 entre les interstices. J'ai éprouvé depuis que du nitrate ou du muriate de chaux bien secs & en poudre grossière, étoient préférables à la potasse, & qu'ils enlevoient plus d'eau à une quantité donnée d'air.
Pour opérer avec cet appareil, on commence par faire le vuide dans le ballon A, au moyen de la pompe pneumatique adaptée au tuyau FHh; après quoi on y introduit du gaz oxygène, en tournant le robinet r du tube gg. Le degré du limbe du gazomètre observé avant & après l'introduction du gaz, indique la quantité qui en est entrée dans le ballon. On ouvre ensuite le robinet s du tube dDd', afin de faire arriver le gaz hydrogène; & aussitôt, soit avec une machine électrique, soit avec une bouteille de Leyde, on fait passer une étincelle de la boule L à l'extrémité d' du tube par lequel se fait l'écoulement du gaz hydrogène, & il s'allume aussitôt. Il faut, pour que la combustion ne soit ni trop lente ni trop rapide, que le gaz hydrogène arrive avec une pression d'un pouce & demi à deux pouces d'eau, & que le gaz oxygène n'arrive au contraire qu'avec trois lignes au plus de pression.
La combustion ainsi commencée, elle se continue; mais en s'affoiblissant à mesure que la quantité de gaz azote qui reste de la combustion 510 des deux gaz augmente. Il arrive enfin un moment où la portion de gaz azote devient telle, que la combustion ne peut plus avoir lieu, & alors la flamme s'éteint. Il faut faire en sorte de prévenir cette extinction spontanée; parce qu'au moyen de ce qu'il y a pression plus forte dans le réservoir de gaz hydrogène que dans celui de gaz oxygène, il se feroit un mêlange des deux dans le ballon, & que ce mêlange passeroit ensuite dans le réservoir de gaz oxygène. Il faut donc arrêter la combustion en fermant le robinet du tuyau dDd', dès qu'on s'apperçoit que la flamme s'affoiblit à un certain point, & avoir une grande attention pour ne point se laisser surprendre.
A une première combustion ainsi faite on peut en faire succéder une seconde, une troisième, &c. On refait alors le vuide comme la première fois; on remplit le ballon de gaz oxygène, on ouvre le robinet du tuyau par lequel s'introduit le gaz hydrogène, & on allume par l'étincelle électrique.
Pendant toutes ces opérations, l'eau qui se forme, se condense sur les parois du ballon & ruisselle de toutes parts: elle se rassemble au fond, & il est aisé d'en déterminer le poids quand on connoît celui du ballon. Nous rendrons compte un jour, M. Meusnier & moi, 511 des détails de l'expérience que nous avons faite avec cet appareil, dans les mois de janvier & de février 1785, en présence d'une grande partie des membres de l'Académie. Nous avons tellement multiplié les précautions, que nous avons lieu de la croire exacte. D'après le résultat que nous avons obtenu, 100 parties d'eau en poids sont composées de 85 d'oxygène & de 15 d'hydrogène.
Il est encore un autre appareil pour la combustion, avec lequel on ne peut pas faire des expériences aussi exactes qu'avec les précédens, mais qui présente un résultat très-frappant & très-propre à être présenté dans un cours de Physique & de Chimie. Il consiste dans un serpentin EF, planche IX, figure 5, renfermé dans un seau de métal ABCD. A la partie supérieure E du tuyau de ce serpentin, on adapte une cheminée GH composée d'un double tuyau; savoir, de la continuation du serpentin & d'un tuyau de fer-blanc qui l'environne. Ces deux tuyaux laissent entr'eux un intervalle d'un pouce environ, qu'on remplit avec du sable.
A l'extrémité inférieure du tuyau intérieur K, s'adapte un tube de verre, & au-dessous une lampe à esprit-de-vin LM, à la Quinquet.
Les choses ainsi préparées, & la quantité d'alkool contenue dans la lampe ayant été bien 512 déterminée, on allume. L'eau qui se forme pendant la combustion de l'alkool, s'élève par le tube KE; elle se condense dans le serpentin contenu dans le seau ABCD, & va ressortir en état d'eau par l'extrémité F du tube où elle est reçue dans une bouteille P.
La double enveloppe GH est destinée à empêcher que le tube ne se refroidisse dans sa partie montante, & que l'eau ne s'y condense. Elle redescendroit le long du tube, sans qu'on pût en déterminer la quantité; il pourroit d'ailleurs en retomber sur la mêche des gouttes, qui ne manqueroient pas de l'éteindre. L'objet de cet appareil est donc d'entretenir toujours chaude toute la partie GH que j'appelle la cheminée, & toujours froide au contraire la partie qui forme le serpentin proprement dit; en sorte que l'eau soit toujours dans l'état de vapeurs dans la partie montante, & qu'elle se condense sitôt qu'elle est engagée dans la partie descendante. Cet appareil a été imaginé par M. Meusnier: j'en ai donné la description dans les Mémoires de l'Académie, année 1784, page 593 & 594. On peut, en opérant avec précaution, c'est-à-dire en entretenant l'eau qui environne le serpentin, toujours froide, retirer près de 17 onces d'eau de la combustion de 16 onces d'esprit-de-vin ou alkool.
513
§. VI.
De l'Oxidation des Métaux.
On désigne principalement par le nom de calcination ou oxidation, une opération dans laquelle les métaux exposés à un certain degré de chaleur se convertissent en oxides, en absorbant l'oxygène de l'air. Cette combinaison se fait en raison de ce que l'oxygène a plus d'affinité, du moins à un certain degré de température, avec les métaux, qu'il n'en a avec le calorique. En conséquence le calorique devient libre & se dégage: mais comme l'opération, lorsqu'elle se fait dans l'air commun, est successive & lente, le dégagement du calorique est peu sensible. Il n'en est pas de même, lorsque la calcination s'opère dans le gaz oxygène; elle se fait alors d'une manière beaucoup plus rapide, elle est souvent accompagnée de chaleur & de lumière; en sorte qu'on ne peut douter que les substances métalliques ne soient de véritables corps combustibles.
Les métaux n'ont pas tous le même degré d'affinité pour l'oxygène. L'or & l'argent, par exemple, & même le platine ne peuvent l'enlever au calorique, à quelque degré de chaleur que ce soit. Quant aux autres métaux, ils s'en 514 chargent d'une quantité plus ou moins grande, &, en général, ils en absorbent jusqu'à ce que ce principe soit en équilibre entre la force du calorique qui le retient, & celle du métal qui l'attire. Cet équilibre est une loi générale de la nature dans toutes les combinaisons.
Dans les opérations de docimasie & dans toutes celles relatives aux arts, on accélère l'oxidation du métal en donnant un libre accès à l'air extérieur. Quelquefois même on y joint l'action d'un soufflet dont le courant est dirigé sur la surface du métal. L'opération est encore plus rapide, si on souffle du gaz oxygène; ce qui est très-facile à l'aide du gazomètre dont j'ai donné la description. (Voyez page 346.) Alors le métal brûle avec flamme, & l'oxidation est terminée en quelques instans: mais on ne peut employer ce dernier moyen que pour des expériences très en petit, à cause de la cherté du gaz oxygène.
Dans l'essai des mines & en général dans toutes les opérations courantes des laboratoires, on est dans l'usage de calciner ou oxider les métaux sur un plat ou soucoupe de terre cuite, pl. IV, fig. 6, qu'on place sur un bon fourneau: on nomme ces plats ou soucoupes têts à rôtir. De tems en tems on remue la matière qu'on veut calciner, afin de renouveller les surfaces.
515
Toutes les fois qu'on opère sur une substance métallique qui n'est pas volatile, & qu'il ne se dissipe rien pendant l'opération, il y a augmentation de poids du métal. Mais des expériences faites ainsi en plein air, n'auroient jamais conduit à reconnoître la cause de l'augmentation du poids des métaux pendant leur oxidation. Ce n'est que du moment où l'on a commencé à opérer dans des vaisseaux fermés & dans des quantités déterminées d'air, qu'on a été véritablement sur la voie de la découverte des causes de ce phénomène. Un premier moyen qu'on doit à M. Priestley, consiste à exposer le métal qu'on se propose de calciner, sur une capsule N de porcelaine, planc. IV, fig. 11, placée sur un support un peu élevé IK; à le recouvrir avec une cloche de cristal A plongée dans un bassin plein d'eau BCDE, & à élever l'eau jusqu'en GH, en suçant l'air de la cloche avec un siphon qu'on passe par-dessous: on fait ensuite tomber sur le métal le foyer d'un verre ardent. En quelques minutes l'oxidation s'opère; une partie de l'oxygène contenu dans l'air se combine avec le métal; il y a une diminution proportionnée dans le volume de l'air, & ce qui reste n'est plus que du gaz azote, encore mêlé cependant d'une petite quantité de gaz oxygène. J'ai exposé le détail des expériences 516 que j'ai faites avec cet appareil dans mes opuscules physiques & chimiques, imprimées en 1773, pages 283, 284, 285 & 286. On peut substituer le mercure à l'eau, & l'expérience n'en est que plus concluante.
Un autre procédé dont j'ai exposé le résultat dans les Mémoires de l'Académie, année 1774, page 351, & dont la première idée appartient à Boyle, consiste à introduire le métal sur lequel on veut opérer dans une cornue A, pl. III, fig. 20, dont on tire à la lampe l'extrémité du col, & qu'on ferme hermétiquement en C. On oxide ensuite le métal, en tenant la cornue sur un feu de charbon, & en la chauffant avec précaution. Le poids du vaisseau & des matières qu'il contient, ne change pas tant qu'on n'a pas rompu l'extrémité C du bec de la cornue; mais sitôt qu'on procure à l'air extérieur une issue pour rentrer, il le fait avec sifflement.
Cette opération ne seroit pas sans quelque danger, si on scelloit hermétiquement la cornue sans avoir fait sortir auparavant une portion de l'air qu'elle contenoit; la dilatation occasionnée par la chaleur pourroit faire éclater le vaisseau, avec risque pour ceux qui le tiendroient ou qui seroient dans le voisinage. Pour prévenir ce danger, on doit faire chauffer la cornue avant de la sceller à la lampe & en faire sortir une 517 portion d'air qu'on reçoit sous une cloche dans l'appareil pneumato-chimique, afin de pouvoir en déterminer la quantité.
Je n'ai point multiplié, autant que je l'aurois desiré, ces oxidations, & je n'ai obtenu de résultats satisfaisans qu'avec l'étain: le plomb ne m'a pas bien réussi. Il seroit à souhaiter que quelqu'un voulût bien reprendre ce travail & tenter l'oxidation dans différens gaz; il seroit, je crois, bien dédommagé des peines attachées à ce genre d'expériences.
Tous les oxides de mercure étant susceptibles de se revivifier sans addition, & de restituer dans son état de pureté l'oxygène qu'ils ont absorbé, aucun métal n'étoit plus propre à devenir le sujet d'expériences très-concluantes sur la calcination & l'oxidation des métaux. J'avois d'abord tenté, pour opérer l'oxidation du mercure dans les vaisseaux fermés, de remplir une cornue de gaz oxygène, d'y introduire une petite portion de mercure & d'adapter à son col une vessie à moitié remplie de gaz oxygène, comme on le voit représenté planche IV, fig. 12. Je faisois ensuite chauffer le mercure de la cornue; & en continuant très-long-tems l'opération, j'étois parvenu à en oxider une petite portion, & à former de l'oxide rouge qui nageoit à la surface: mais la quantité de 518 mercure que je suis parvenu à oxider de cette manière, étoit si petite, que la moindre erreur commise dans la détermination des quantités de gaz oxygène avant & après l'oxidation, auroit jetté la plus grande incertitude sur mes résultats. J'étois toujours inquiet d'ailleurs, & non sans de justes raisons, qu'il ne se fût échappé de l'air à travers des pores de la vessie, d'autant plus qu'elle se racornit pendant l'opération par la chaleur du fourneau dans lequel on opère, à moins qu'on ne la recouvre de linges entretenus toujours humides.
On opère d'une manière plus sûre avec l'appareil représenté planc. IV, figure 2. (Voyez Mém. Acad. année 1775, page 580.) Il consiste en une cornue A, au bec de laquelle on soude à la lampe d'émailleur un tuyau de verre recourbé BCDE, de 10 à 12 lignes de diamètre, qui s'engage sous une cloche FG contenue & retournée dans un bassin plein d'eau ou de mercure. Cette cornue est soutenue sur les barres d'un fourneau MMNN: on peut aussi se servir d'un bain de sable. On parvient avec cet appareil à oxider en plusieurs jours un peu de mercure dans l'air ordinaire, & à obtenir un peu d'oxide rouge qui nage à la surface: on peut même le rassembler, le revivifier & comparer les quantités de gaz obtenu avec l'absorption 519 qui a eu lieu pendant la calcination; (voyez page 35 les détails que j'ai donnés sur cette expérience) mais ce genre d'opérations ne pouvant se faire que très en petit, il reste toujours de l'incertitude sur les quantités.
La combustion du fer dans le gaz oxygène étant une véritable oxidation, je dois en faire mention ici. L'appareil qu'emploie M. Ingen-Housz pour cette opération, est représenté pl. IV, fig. 17. J'en ai déjà donné la description, page 41, & je ne puis qu'y renvoyer.
On peut aussi brûler & oxider du fer sous des cloches de verre remplies de gaz oxygène, de la même manière qu'on brûle du phosphore ou du charbon. On se sert également pour cette opération de l'appareil représenté planche IV, fig. 3, & dont j'ai donné la description, p. 61. Il faut dans cette expérience, comme dans la combustion, attacher à l'une des extrémités du fil de fer, ou des copeaux de fer qu'on se propose de brûler, un petit morceau d'amadoue & un atôme de phosphore: le fer chaud qu'on passe sous la cloche allume le phosphore; celui-ci allume l'amadoue, & l'inflammation se communique au fer. M. Ingen-Housz nous a appris qu'on pouvoit brûler ou oxider de la même manière tous les métaux, à l'exception de l'or, de l'argent & du mercure. Il ne s'agit que de 520 se procurer ces métaux en fils très-fins ou en feuilles minces coupées par bandes; on les tortille avec du fil de fer, & ce dernier métal communique aux autres la propriété de s'enflammer & de s'oxider.
Nous venons de voir comment on parvenoit à oxider de très-petites quantités de mercure dans les vaisseaux fermés & dans des volumes d'air limités: ce n'est de même qu'avec beaucoup de peine qu'on parvient à oxider ce métal, même à l'air libre. On se sert ordinairement dans les laboratoires pour cette opération d'un matras A, planche IV, fig. 10, à cul très-plat, qui a un col BC très-allongé & terminé par une très-petite ouverture: ce vaisseau porte le nom d'enfer de Boyle. On y introduit assez de mercure pour couvrir son fond, & on le place sur un bain de sable qu'on entretient à un degré de chaleur fort approchant du mercure bouillant. En continuant ainsi pendant plusieurs mois, avec cinq ou six de ces matras, & en renouvellant de tems en tems le mercure, on parvient à obtenir quelques onces de cet oxide.
Cet appareil a un grand inconvénient, c'est que l'air ne s'y renouvelle pas assez; mais, d'un autre côté, si on donnoit à l'air extérieur une circulation trop libre, il emporteroit avec lui 521 du mercure en dissolution, & au bout de quelques jours on n'en retrouveroit plus dans le vaisseau. Comme de toutes les expériences que l'on peut faire sur l'oxidation des métaux, celles sur le mercure sont les plus concluantes, il seroit à souhaiter qu'on pût imaginer un appareil simple au moyen duquel on pût démontrer cette oxidation & les résultats qu'on en obtient dans les cours publics. On y parviendroit, ce me semble, par des moyens analogues à ceux que j'ai décrits pour la combustion des huiles ou du charbon; mais je n'ai pu reprendre encore ce genre d'expériences.
L'oxide de mercure se revivifie, comme je l'ai dit, sans addition; il suffit de le faire chauffer à un degré de chaleur légèrement rouge. L'oxygène à ce degré a plus d'affinité avec le calorique qu'avec le mercure, & il se forme du gaz oxygène; mais ce gaz est toujours mêlé d'un peu de gaz azote, ce qui indique que le mercure en absorbe une petite portion pendant son oxidation. Il contient aussi presque toujours un peu de gaz acide carbonique; ce qu'on doit sans doute attribuer aux ordures qui s'y mêlent, qui se charbonnent & qui convertissent ensuite une portion de gaz oxygène en gaz acide carbonique.
Si les Chimistes étoient réduits à tirer de 522 l'oxide de mercure fait par voie de calcination, tout le gaz oxygène qu'ils emploient dans leurs expériences, le prix excessif de cette préparation rendroit absolument impraticables les expériences un peu en grand. Mais on peut également oxygéner le mercure par l'acide nitrique, & on obtient un oxide rouge plus pur que celui même qui a été fait par voie de calcination. On le trouve tout préparé dans le commerce & à un prix modéré: il faut choisir de préférence celui qui est en morceaux solides & formé de lames douces au toucher & qui tiennent ensemble. Celui qui est en poudre est quelquefois mêlangé d'oxide rouge de plomb: il ne paroît pas que celui en morceaux solides soit susceptible de la même altération. J'ai quelquefois essayé de préparer moi-même cet oxide par l'acide nitrique: la dissolution du métal faite, j'évaporois jusqu'à siccité, & je calcinois le sel, ou dans des cornues, ou dans des capsules faites avec des fragmens de matras coupés par la méthode que j'ai indiquée; mais jamais je n'ai pu parvenir à l'avoir aussi beau que celui du commerce. On le tire, je crois, de Hollande.
Pour obtenir le gaz oxygène de l'oxide de mercure, j'ai coutume de me servir d'une cornue de porcelaine à laquelle j'adapte un long 523 tube de verre qui s'engage sous des cloches dans l'appareil pneumato-chimique à l'eau. Je place au bout du tube un vase plongé dans l'eau, dans lequel se rassemble le mercure à mesure qu'il se revivifie. Le gaz oxygène ne commence à passer que quand la cornue devient rouge. C'est un principe général que M. Berthollet a bien établi, qu'une chaleur obscure ne suffit pas pour former du gaz oxygène; il faut de la lumière: ce qui semble prouver que la lumière est un de ses principes constituans. On doit dans la revivification de l'oxide rouge de mercure rejeter les premières portions de gaz qu'on obtient, parce qu'elles sont mêlées d'air commun en raison de celui contenu dans le vuide des vaisseaux: mais avec cette précaution même, on ne parvient pas à obtenir du gaz oxygène parfaitement pur; il contient communément un dixième de gaz azote, & presque toujours une très-petite portion de gaz acide carbonique. On se débarrasse de ce dernier, au moyen d'une liqueur alkaline caustique à travers laquelle on fait passer le gaz qu'on a obtenu. A l'égard du gaz azote, on ne connoît aucun moyen de l'en séparer; mais on peut en connoître la quantité, en laissant le gaz oxygène pendant une quinzaine de jours en contact avec du sulfure de soude ou de potasse. 524 Le gaz oxygène est absorbé; il forme de l'acide sulfurique avec le soufre, & il ne reste que le gaz azote seul.
Il y a beaucoup d'autres moyens de se procurer du gaz oxygène: on peut le tirer de l'oxide noir de manganèse ou du nitrate de potasse par une chaleur rouge, & l'appareil qu'on emploie est à peu près le même que celui que j'ai décrit pour l'oxide rouge de mercure. Il faut seulement un degré de chaleur plus fort & au moins égal à celui qui est susceptible de ramollir le verre: on ne peut en conséquence employer que des cornues de grès ou de porcelaine. Mais le meilleur de tous, c'est-à-dire le plus pur, est celui qu'on dégage du muriate oxygéné de potasse par la simple chaleur. Cette opération peut se faire dans une cornue de verre, & le gaz qu'on obtient est absolument pur, pourvû toutefois que l'on rejette les premières portions qui sont mêlées d'air des vaisseaux.
§. VII.
De la Détonation.
J'ai fait voir, Chapitre IX, page 103 & suiv. que l'oxygène, en se combinant dans les différens corps, ne se dépouilloit pas toujours de tout le calorique qui le constituoit dans l'état 525 de gaz; qu'il entroit, par exemple, avec presque tout son calorique dans la combinaison qui forme l'acide nitrique & dans celle qui forme l'acide muriatique oxygéné; en sorte que l'oxygène dans le nitre & sur-tout dans le muriate oxygéné, étoit jusqu'à un certain point dans l'état de gaz oxygène condensé & réduit au plus petit volume qu'il puisse occuper.
Le calorique dans ces combinaisons exerce un effort continuel sur l'oxygène, pour le ramener à l'état de gaz: l'oxigène en conséquence y tient peu; la moindre force suffit pour lui rendre la liberté, & il reparoît souvent dans un instant presque indivisible dans l'état de gaz. C'est ce passage brusque de l'état concret à l'état aériforme qu'on a nommé détonation, parce qu'en effet il est ordinairement accompagné de bruit & de fracas. Le plus communément ces détonations s'opèrent par la combinaison du charbon, soit avec le nitre, soit avec le muriate oxygéné. Quelquefois pour faciliter encore l'inflammation, on y ajoute du soufre; & c'est ce mêlange fait dans de justes proportions & avec des manipulations convenables, qui constitue la poudre à canon.
L'oxygène par la détonation avec le charbon change de nature, & il se convertit en acide carbonique. Ce n'est donc pas du gaz oxygène 526 qui se dégage, mais du gaz acide carbonique, du moins quand le mêlange a été fait dans de justes proportions. Il se dégage en outre du gaz azote dans la détonation du nitre, parce que l'azote est un des principes constituans de l'acide nitrique.
Mais l'expansion subite & instantanée de ces gaz ne suffit pas pour expliquer tous les phénomènes relatifs à la détonation. Si cette cause y influoit seule, la poudre seroit d'autant plus forte que la quantité de gaz dégagé dans un tems donné seroit plus considérable; ce qui ne s'accorde pas toujours avec l'expérience. J'ai eu occasion d'éprouver des espèces de poudre à tirer qui produisoient un effet presque double de la poudre ordinaire, quoiqu'elles donnassent un sixième de gaz de moins par la détonation. Il y a apparence que la quantité de calorique qui se dégage au moment de la détonation, contribue beaucoup à en augmenter l'effet, & on peut en concevoir plusieurs raisons. Premièrement, quoique le calorique pénètre assez librement à travers les pores de tous les corps, il ne peut cependant y passer que successivement & en un tems donné: lors donc que la quantité qui se dégage à la fois est trop considérable, & qu'elle est beaucoup plus grande que celle qui peut se débiter, s'il est 527 permis de se servir de cette expression, par les pores des corps, il doit agir à la manière des fluides élastiques ordinaires & renverser tout ce qui s'oppose à son passage. Une partie de cet effet doit avoir lieu, lorsqu'on allume de la poudre dans un canon: quoique le métal qui le compose soit perméable pour le calorique, la quantité qui s'en dégage à la fois est tellement grande, qu'elle ne trouve pas une issue assez prompte à travers les pores du métal; elle fait donc un effort en tous sens, & c'est cet effort qui est employé à chasser le boulet.
Secondement, le calorique produit nécessairement un second effet qui dépend également de la force répulsive que ses molécules paroissent exercer les unes sur les autres: il dilate les gaz qui se dégagent au moment de l'inflammation de la poudre, & cette dilatation est d'autant plus grande que la température est plus élevée.
Troisièmement, il est possible qu'il y ait décomposition de l'eau dans l'inflammation de la poudre, & qu'elle fournisse de l'oxygène au charbon pour former de l'acide carbonique. Si les choses se passent ainsi, il doit se dégager rapidement, au moment de la détonation de la poudre, une grande quantité de gaz hydrogène qui se débande & qui contribue à augmenter la force de l'explosion. On sentira combien 528 cette circonstance doit contribuer à augmenter l'effet de la poudre, si l'on considère que le gaz hydrogène ne pèse qu'un grain deux tiers par pinte; qu'il n'en faut par conséquent qu'une très-petite quantité en poids pour occuper un très-grand espace, & qu'il doit exercer une force expansive prodigieuse, quand il passe de l'état liquide à l'état aériforme.
Quatrièmement enfin une portion d'eau non décomposée doit se réduire en vapeurs dans l'inflammation de la poudre, & l'on sait que dans l'état de gaz elle occupe un volume 17 à 18 cent fois plus grand que lorsqu'elle est dans l'état liquide.
J'ai déjà fait une assez grande suite d'expériences sur la nature des fluides élastiques qui se dégagent de la détonation du nitre avec le charbon & avec le soufre; j'en ai fait aussi quelques-unes avec le muriate oxygéné de potasse. C'est un moyen qui conduit à des connoissances assez précises sur les parties constituantes de ces sels, & j'ai déjà donné, Tome XI du recueil des Mémoires présentés à l'Académie par des savans étrangers, page 625, quelques résultats principaux de mes expériences & des conséquences auxquelles elles m'ont conduit relativement à l'analyse de l'acide nitrique. Maintenant que je me suis procuré des appareils 529 plus commodes, je me prépare à répéter les mêmes expériences un peu plus en grand, & j'obtiendrai plus de précision dans les résultats: en attendant, je vais rendre compte des procédés que j'ai adoptés & employés jusqu'à présent. Je recommande avec bien de l'instance à ceux qui voudront répéter quelques-unes de ces expériences, d'y apporter une extrême prudence; de se méfier de tout mêlange où il entre du salpêtre, du charbon & du soufre, & plus encore de ceux dans lesquels il entre du sel muriatique oxygéné de potasse combiné & mêlangé avec ces deux matières.
Je me suis prémuni de canons de pistolets de six pouces de longueur environ & de cinq à six lignes de diamètre. J'en ai bouché la lumière avec une pointe de clou frappée à force, cassée dans le trou même, & sur laquelle j'ai fait couler un peu de soudure blanche de ferblantier, afin qu'il ne restât aucune issue à l'air par cette ouverture. On charge ces canons avec une pâte médiocrement humectée, faite avec des quantités bien connues de salpêtre & de charbon réduits en poudre impalpable, ou de tout autre mêlange susceptible de détoner. A chaque portion de matière qu'on introduit dans le canon, on doit bourer avec un bâton qui soit du même calibre, à peu près comme on 530 charge les fusées. La matière ne doit pas emplir le pistolet tout-à-fait jusqu'à sa bouche; il est bon qu'il reste quatre ou cinq lignes de vuide à l'extrémité: alors on ajoute un bout de 2 pouces de long environ de mêche nommée étoupille. La seule difficulté de ce genre d'expériences, sur-tout si l'on ajoute du soufre au mêlange, est de saisir le point d'humectation convenable: si la matière est trop humide, elle n'est point susceptible de s'allumer, si elle est trop sèche, la détonation est trop vive & peut devenir dangereuse.
Quand on n'a pas pour objet de faire une expérience rigoureusement exacte, on allume la mêche, & quand elle est près de communiquer l'inflammation à la matière, on plonge le pistolet sous une grande cloche d'eau dans l'appareil pneumato-chimique. La détonation commencée, elle se continue sous l'eau, & le gaz se dégage avec plus ou moins de rapidité, suivant que la matière est plus ou moins sèche. Il faut, tant que la détonation dure, tenir le bout du pistolet incliné, afin que l'eau ne rentre pas dans l'intérieur. J'ai quelquefois recueilli ainsi le gaz produit par la détonation d'une once & demie ou de deux onces de nitre.
Il n'est pas possible, dans cette manière d'opérer, de connoître la quantité de gaz acide 531 carbonique qui se dégage, parce qu'une partie est absorbée par l'eau à mesure qu'il la traverse; mais l'acide carbonique une fois absorbé, il reste le gaz azote; & si on a la précaution de l'agiter pendant quelques minutes dans de la potasse caustique en liqueur, on l'obtient pur, & il est aisé d'en déterminer le volume & le poids. Il est même possible d'arriver par cette méthode à une connoissance assez précise de la quantité de gaz acide carbonique, en répétant l'expérience un grand nombre de fois & en faisant varier les doses du charbon, jusqu'à ce qu'on soit arrivé à la juste proportion qui fait détoner la totalité du nitre. Alors, d'après le poids du charbon employé, on détermine celui d'oxygène qui a été nécessaire pour le saturer, & on en conclut la quantité d'oxygène contenu dans une quantité donnée de nitre.
Il est au surplus un autre moyen que j'ai pratiqué & qui conduit à des résultats plus sûrs; c'est de recevoir dans des cloches remplies de mercure le gaz qui se dégage. Le bain de mercure que j'ai maintenant, est assez grand pour qu'on puisse y placer des cloches de douze à quinze pintes de capacité. De pareilles cloches, comme l'on sent, ne sont pas très-maniables quand elles sont remplies de mercure; aussi faut-il employer pour les remplir 532 des moyens particuliers que je vais indiquer. On place la cloche sur le bain de mercure; on passe par-dessous un siphon de verre dont on a adapté l'extrémité extérieure à une petite pompe pneumatique: on fait jouer le piston, & on élève le mercure jusqu'au haut de la cloche. Lorsqu'elle est ainsi remplie, on y fait passer le gaz de la détonation de la même manière que dans une cloche qui seroit remplie d'eau. Mais, je le répète, ce genre d'expériences exige les plus grandes précautions. J'ai vu quelquefois, quand le dégagement du gaz étoit trop rapide, des cloches pleines de mercure pesant plus de 150 livres, s'enlever par la force de l'explosion: le mercure jaillissoit au loin, & la cloche étoit brisée en un grand nombre d'éclats.
Lorsque l'expérience a réussi & que le gaz est rassemblé sous la cloche, on en détermine le volume comme je l'ai indiqué pages 361 & 362. On y introduit ensuite un peu d'eau, puis de la potasse dissoute dans l'eau & dépouillée d'acide carbonique, & on parvient à en faire une analyse rigoureuse, comme je l'ai enseigné pages 365 & suivantes.
Il me tarde d'avoir mis la dernière main aux expériences que j'ai commencées sur les détonations, parce qu'elles ont un rapport 533 immédiat avec les objets dont je suis chargé, & qu'elles jetteront, à ce que j'espère, quelques lumières sur les opérations relatives à la fabrication de la poudre.

534
CHAPITRE VIII.
Des Instrumens nécessaires pour opérer sur les corps à de très-hautes températures.
§. PREMIER.
De la Fusion.
Lorsqu'on écarte les unes des autres, par le moyen de l'eau, les molécules d'un sel, cette opération, comme nous l'avons vu plus haut, se nomme solution. Ni le dissolvant, ni le corps tenu en dissolution ne sont décomposés dans cette opération; aussi dès l'instant que la cause qui tenoit les molécules écartées cesse, elles se réunissent, & la substance saline reparoît telle qu'elle étoit ayant la solution.
On opère aussi de véritables solutions par le feu, c'est-à-dire, en introduisant & en accumulant entre les molécules d'un corps une grande quantité de calorique. Cette solution des corps par le feu se nomme fusion.
Les fusions en général se font dans des vases que l'on nomme creusets, & l'une des premières conditions est qu'ils soient moins fusibles que 535 la substance qu'ils doivent contenir. Les Chimistes de tous les âges ont en conséquence attaché une grande importance à se procurer des creusets de matières très-réfractaires, c'est-à-dire, qui eussent la propriété de résister à un très-grand degré de feu. Les meilleurs sont ceux qui sont faits avec de l'argile très-pure ou de la terre à porcelaine. On doit éviter d'employer pour cet usage les argiles mêlangées de silice ou de terre calcaire, parce qu'elles sont trop fusibles. Toutes celles qu'on tire aux environs de Paris sont dans ce cas; aussi les creusets qu'on fabrique dans cette ville fondent-ils à une chaleur assez médiocre, & ne peuvent-ils servir que dans un très-petit nombre d'opérations chimiques. Ceux qui viennent de Hesse sont assez bons, mais on doit préférer ceux de terre de Limoges qui paroissent être absolument infusibles. Il existe en France un grand nombre d'argiles propres à faire des creusets; telle est celle, par exemple, dont on se sert pour les creusets de la glacerie de Saint-Gobin.
On donne aux creusets différentes formes, suivant les opérations auxquelles on se propose de les employer. On a représenté celles qui sont le plus usitées dans les fig. 7, 8, 9 & 10 de la planche VII. Ceux représentés figure 9, qui 536 sont presque fermés par en haut, se nomment tutes.
Quoique la fusion puisse souvent avoir lieu sans que le corps qui y est soumis change de nature & se décompose, cette opération est cependant aussi un des moyens de décomposition & de recomposition que la Chimie emploie. C'est par la fusion qu'on extrait tous les métaux de leurs mines, qu'on les revivifie, qu'on les moule, qu'on les allie les uns aux autres; c'est par elle que l'on combine l'alkali & le sable pour former du verre, que se fabriquent les pierres colorées, les émaux, &c.
Les anciens Chimistes employoient beaucoup plus fréquemment l'action d'un feu violent, que nous ne le faisons aujourd'hui. Depuis qu'on a introduit plus de rigueur dans la manière de faire des expériences, on préfère la voie humide à la voie sèche, & on n'a recours à la fusion que lorsqu'on a épuisé tous les autres moyens d'analyse.
Pour appliquer aux corps l'action du feu, on se sert de fourneaux, & il me reste à décrire ceux qu'on emploie pour les différentes opérations de la Chimie.
537
§. II.
Des Fourneaux.
Les fourneaux sont les instrumens dont on fait le plus d'usage en Chimie: c'est de leur bonne ou de leur mauvaise construction que dépend le sort d'un grand nombre d'opérations; en sorte qu'il est d'une extrême importance de bien monter un laboratoire en ce genre. Un fourneau est une espèce de tour cylindrique creuse ABCD, quelquefois un peu évasée par le haut, planche XIII, fig. 1. Elle doit avoir au moins deux ouvertures latérales, une supérieure F qui est la porte du foyer, une inférieure G qui est la porte du cendrier.
Dans l'intervalle de ces deux portes le fourneau est partagé en deux par une grille placée horisontalement, qui forme une espèce de diaphragme & qui est destinée à soutenir le charbon. On a indiqué la place de cette grille par la ligne HI. La capacité qui est au-dessus de la grille, c'est-à-dire au-dessus de la ligne HI, se nomme foyer, parce qu'en effet c'est dans cette partie que l'on entretient le feu; la capacité qui est au-dessous porte le nom de cendrier, par la raison que c'est dans cette partie que se rassemblent les cendres à mesure qu'elles se forment.
538
Le fourneau représenté planche XIII, fig. 1, est le moins compliqué de tous ceux dont on se sert en Chimie, & il peut être employé cependant à un grand nombre d'usages. On peut y placer des creusets, y fondre du plomb, de l'étain, du bismuth, & en général toutes les matières qui n'exigent pas pour être fondues, un degré de feu très-considérable. On peut y faire des calcinations métalliques, placer dessus des bassines, des vaisseaux évaporatoires, des capsules de fer pour former des bains de sable, comme on le voit représenté pl. III, fig. 1 & 2. C'est pour le rendre applicable à ces différentes opérations, qu'on a ménagé dans le haut des échancrures mmmm; autrement la bassine qu'on auroit posée sur le fourneau auroit intercepté tout passage à l'air, & le charbon se seroit éteint. Si ce fourneau ne produit qu'un degré de chaleur médiocre, c'est que la quantité de charbon qu'il peut consommer est limitée par la quantité d'air qui peut passer par l'ouverture G du cendrier. On augmenteroit beaucoup son effet, en aggrandissant cette ouverture; mais le grand courant d'air qui conviendroit dans quelques expériences, auroit de l'inconvénient dans beaucoup d'autres, & c'est ce qui oblige de garnir un laboratoire de fourneaux de différentes formes & construits sous différens 539 points de vue. Il en faut sur-tout plusieurs semblables à celui que je viens de décrire, & de différentes grandeurs.
Une autre espèce de fourneau, peut-être encore plus nécessaire, est le fourneau de réverbère représenté planche XIII, figure 2. Il est composé, comme le fourneau simple, d'un cendrier HIKL dans sa partie inférieure, d'un foyer KLMN, d'un laboratoire MNOP, d'un dôme RSRS; enfin le dôme est surmonté d'un tuyau TTVV, auquel on peut en ajouter plusieurs autres, suivant le genre des expériences.
C'est dans la partie MNOP nommée le laboratoire, que se place la cornue A qu'on a indiquée par une ligne ponctuée; elle y est soutenue sur deux barres de fer qui traversent le fourneau. Son col sort par une échancrure latérale faite partie dans la pièce qui forme le laboratoire, partie dans celle qui forme le dôme. A cette cornue s'adapte un récipient B.
Dans la plupart des fourneaux de réverbère qui se trouvent tout faits chez les potiers de terre à Paris, les ouvertures tant inférieures que supérieures sont beaucoup trop petites; elles ne donnent point passage à un volume d'air assez considérable; & comme la quantité de charbon consommée, ou, ce qui revient au même, comme la quantité de calorique dégagée 540 est à peu près proportionnelle à la quantité d'air qui passe par le fourneau, il en résulte que ces fourneaux ne produisent pas tout l'effet qu'on pourroit desirer dans un grand nombre d'opérations. Pour admettre d'abord par le bas un volume d'air suffisant, il faut, au lieu d'une ouverture G au cendrier, en avoir deux GG: on en condamne une lorsqu'on le juge à propos, & alors on n'obtient plus qu'un degré de feu modéré; on les ouvre au contraire l'une & l'autre, quand on veut donner le plus grand coup de feu que le fourneau puisse produire.
L'ouverture supérieure SS du dôme, ainsi que celle des tuyaux VVXX, doit être aussi beaucoup plus grande qu'on n'a coutume de la faire.
Il est important de ne point employer des cornues trop grosses relativement à la grandeur du fourneau. Il faut qu'il y ait toujours un espace suffisant pour le passage de l'air entre les parois du fourneau & celles du vaisseau qui y est contenu. La cornue A dans la figure 2 est un peu trop petite pour ce fourneau, & je trouve plus facile d'en avertir que de faire rectifier la figure.
Le dôme a pour objet d'obliger la flamme & la chaleur à environner de toutes parts la cornue & de la réverbérer; c'est de-là qu'est 541 venu le nom de fourneau de réverbère. Sans cette réverbération de la chaleur, la cornue ne seroit échauffée que par son fond; les vapeurs qui s'en élèveroient se condenseroient dans la partie supérieure, elles se recohoberoient continuellement sans passer dans le récipient: mais au moyen du dôme, la cornue se trouve échauffée de toutes parts; les vapeurs ne peuvent donc se condenser que dans le col & dans le récipient, & elles sont forcées de sortir de la cornue.
Quelquefois, pour empêcher que le fond de la cornue ne soit échauffé ou refroidi trop brusquement, & pour éviter que ces alternatives de chaud & de froid n'en occasionnent la fracture, on place sur les barres une petite capsule de terre cuite dans laquelle on met un peu de sable, & on pose sur ce sable le fond de la cornue.
Dans beaucoup d'opérations on enduit les cornues de différens luts. Quelques-uns de ces luts n'ont pour objet que de les défendre des alternatives de chaud & de froid; quelquefois ils ont pour objet de contenir le verre, ou plutôt de former une double cornue qui supplée à celle de verre dans les opérations où le degré de feu est assez fort pour le ramollir.
Le premier de ces luts se fait avec de la 542 terre à four à laquelle on joint un peu de bourre ou poil de vache: on fait une pâte de ces matières, & on l'étend sur les cornues de verre ou de grès. Si au lieu de terre à four qui est déjà mêlangée, on n'avoit que de l'argile ou de la glaise pure, il faudroit y ajouter du sable. A l'égard de la bourre, elle est utile pour mieux lier ensemble la terre: elle brûle à la première impression du feu; mais les interstices qu'elle laisse empêchent que l'eau qui est contenue dans la terre, en se vaporisant, ne rompe la continuité du lut & qu'il ne tombe en poussière.
Le second lut est composé d'argile & de fragmens de poteries de grès grossièrement pilés. On en fait une pâte assez ferme, qu'on étend sur les cornues. Ce lut se dessèche & se durcit par le feu, & forme lui-même une véritable cornue supplémentaire, qui contient les matières quand la cornue de verre vient à se ramollir. Mais ce lut n'est d'aucune utilité dans les expériences où on a pour objet de recueillir les gaz, parce qu'il est toujours poreux & que les fluides aériformes passent au travers.
Dans un grand nombre d'opérations, & en général toutes les fois qu'on n'a pas besoin de donner aux corps qu'on traite un degré de chaleur très-violent, le fourneau de réverbère 543 peut servir de fourneau de fusion. On supprime alors le laboratoire MNOP, & on établit à la place le dôme RSRS, comme on le voit représenté planche XIII, fig. 3.
Un fourneau de fusion très-commode est celui représenté figure 4. Il est composé d'un foyer ABCD, d'un cendrier sans porte & d'un dôme ABGH. Il est troué en E pour recevoir le bout d'un soufflet qu'on y lute solidement. Il doit être proportionnellement moins haut qu'il n'est représenté dans la figure. Ce fourneau ne procure pas un degré de feu très-violent; mais il suffit pour toutes les opérations courantes. Il a de plus l'avantage d'être transporté commodément, & de pouvoir être placé dans tel lieu du laboratoire qu'on le juge à propos. Mais ces fourneaux particuliers ne dispensent pas d'avoir dans un laboratoire une forge garnie d'un bon soufflet, & ce qui est encore plus important, un bon fourneau de fusion. Je vais donner la description de celui dont je me sers, & détailler les principes d'après lesquels je l'ai construit.
L'air ne circule dans un fourneau que parce qu'il s'échauffe en passant à travers les charbons: alors il se dilate; devenu plus léger que l'air environnant, il est forcé de monter par la pression des colonnes latérales, & il est 544 remplacé par de nouvel air qui arrive de toutes parts, principalement par-dessous. Cette circulation de l'air a lieu lorsque l'on brûle du charbon même dans un simple réchaut: mais il est aisé de concevoir que la masse d'air qui passe par un fourneau ainsi ouvert de toutes parts, ne peut pas être, toutes choses d'ailleurs égales, aussi grande que celle qui est contrainte de passer par un fourneau formé en tour creuse, comme le sont en général les fourneaux chimiques, & que par conséquent la combustion ne peut pas y être aussi rapide.
Soit supposé, par exemple, un fourneau ABCDEF, planche XIII, figure 5, ouvert par le haut & rempli de charbons ardens; la force avec laquelle l'air sera obligé de passer à travers les charbons, sera mesurée par la différence de pesanteur spécifique de deux colonnes AC, l'une d'air froid pris en-dehors du fourneau, l'autre d'air chaud pris en-dedans. Ce n'est pas qu'il n'y ait encore de l'air échauffé au-dessus de l'ouverture AB du fourneau, & il est certain que son excès de légèreté doit entrer aussi pour quelque chose dans le calcul; mais comme cet air chaud est continuellement refroidi & emporté par l'air extérieur, cette portion ne peut pas faire beaucoup d'effet.
Mais si à ce même fourneau on ajoute un 545 grand tuyau creux de même diamètre que lui GHAB, qui défende l'air qui a été échauffé par les charbons ardens, d'être refroidi, dispersé & emporté par l'air environnant, la différence de pesanteur spécifique en vertu de laquelle s'opérera la circulation de l'air, ne sera plus celle de deux colonnes AC, l'une extérieure, l'autre intérieure; ce sera celle de deux colonnes égales à GC. Or, à chaleur égale, si la colonne GC = 3AC, la circulation de l'air se fera en raison d'une force triple. Il est vrai que je suppose ici que l'air contenu dans la capacité GHCD est autant échauffé que l'étoit l'air contenu dans la capacité ABCD, ce qui n'est pas rigoureusement vrai; car la chaleur doit décroître de AB à GH: mais comme il est évident que l'air de la capacité GHAB est beaucoup plus chaud que l'air extérieur, il en résulte toujours que l'addition de la tour creuse GHAB augmente la rapidité du courant d'air, qu'il en passe plus à travers les charbons, & que par conséquent il y aura plus de combustion.
Conclurons-nous de ces principes qu'il faille augmenter indéfiniment la longueur du tuyau GHAB? Non sans doute; car puisque la chaleur de l'air diminue de AB en GH, ne fût-ce que par le refroidissement causé à cet air 546 par le contact des parois du tuyau, il en résulte que la pesanteur spécifique de l'air qui le traverse diminue graduellement, & que si le tuyau étoit prolongé à un certain point, on arriveroit à un terme où la pesanteur spécifique de l'air seroit égale en-dedans & en-dehors du tuyau; & il est évident qu'alors cet air froid qui ne tendroit plus à monter, seroit une masse à déplacer qui apporteroit une résistance à l'ascension de l'air inférieur. Bien plus, comme cet air est nécessairement mêlé de gaz acide carbonique, & que ce gaz est plus lourd que l'air atmosphérique, il arriveroit, si ce tuyau étoit assez long pour que l'air avant de parvenir à son extrémité pût se rapprocher de la température extérieure, qu'il tendroit à redescendre; d'où il faut conclure que la longueur des tuyaux qu'on ajoute sur les fourneaux est limitée par la nature des choses.
Les conséquences auxquelles nous conduisent ces réflexions, sont 1º. que le premier pied de tuyau qu'on ajoute sur le dôme d'un fourneau, fait plus d'effet que le sixième, par exemple; que le sixième en fait plus que le dixième: mais aucune expérience ne nous a encore fait connoître à quel terme on doit s'arrêter; 2º. que ce terme est d'autant plus éloigné que le tuyau est moins bon conducteur de chaleur, puisque 547 l'air s'y refroidit d'autant moins; en sorte que la terre cuite est beaucoup préférable à la tôle pour faire des tuyaux de fourneaux, & que si même on les formoit d'une double enveloppe, si on remplissoit l'intervalle de charbon pilé, qui est une des substances la moins propre à transmettre la chaleur, on retarderoit le refroidissement de l'air, & on augmenteroit par conséquent la rapidité du courant & la possibilité d'employer un tuyau plus long; 3º. que le foyer du fourneau étant l'endroit le plus chaud & celui par conséquent où l'air qui le traverse est le plus dilaté, cette partie du fourneau doit être aussi la plus volumineuse, & qu'il est nécessaire d'y ménager un renflement considérable. Il est d'une nécessité d'autant plus indispensable de donner beaucoup de capacité à cette partie du fourneau, qu'elle n'est pas seulement destinée au passage de l'air qui doit favoriser, ou pour mieux dire, opérer la combustion; elle doit encore contenir le charbon & le creuset; en sorte qu'on ne peut compter pour le passage de l'air que l'intervalle que laissent entr'eux les charbons.
C'est d'après ces principes que j'ai construit mon fourneau de fusion, & je ne crois pas qu'il en existe aucun qui produise un effet plus violent. Cependant je n'ose pas encore me flatter 548 d'être arrivé à la plus grande intensité de chaleur qu'on puisse produire dans les fourneaux chimiques. On n'a point encore déterminé par des expériences exactes l'augmentation de volume que prend l'air en traversant un fourneau de fusion; en sorte qu'on ne connoît point le rapport qu'on doit observer entre les ouvertures inférieures & supérieures d'un fourneau: on connoît encore moins la grandeur absolue qu'il convient de donner à ces ouvertures. Les données manquent donc, & on ne peut encore arriver au but que par tâtonnement.
Ce fourneau est représenté pl. XIII, fig. 6. Je lui ai donné, d'après les principes que je viens d'exposer, la forme d'un sphéroïde elliptique ABCD, dont les deux bouts sont coupés par un plan qui passeroit par chacun des foyers perpendiculairement au grand axe. Au moyen du renflement qui résulte de cette figure, le fourneau peut tenir une masse de charbon considérable, & il reste encore dans l'intervalle assez d'espace pour le passage du courant d'air.
Pour que rien ne s'oppose au libre accès de l'air extérieur, je l'ai laissé entièrement ouvert par-dessous, à l'exemple de M. Macquer, qui avoit déjà pris cette même précaution pour son fourneau de fusion, & je l'ai posé sur un trépied. La grille dont je me sers est à claire-voie 549 & en fer méplat; & pour que les barreaux opposent moins d'obstacle au passage de l'air, je les ai fait poser non sur leur côté plat, mais sur le côté le plus étroit, comme on le voit figure 7. Enfin j'ai ajouté à la partie supérieure AB un tuyau de 18 pieds de long en terre cuite, & dont le diamètre intérieur est presque de moitié de celui du fourneau. Quoique j'obtienne déjà avec ce fourneau un feu supérieur à celui qu'aucun Chimiste se soit encore procuré jusqu'ici, je le crois susceptible d'être sensiblement augmenté par les moyens simples que j'ai indiqués & dont le principal consiste à rendre le tuyau FGAB le moins bon conducteur de chaleur qu'il soit possible.
Il me reste à dire un mot du fourneau de coupelle ou fourneau d'essai. Lorsqu'on veut connoître si du plomb contient de l'or ou de l'argent, on le chauffe à grand feu dans de petites capsules faites avec des os calcinés, & qui, en termes d'essai, se nomment coupelles. Le plomb s'oxide, il devient susceptible de se vitrifier, il s'imbibe & s'incorpore avec la coupelle. On conçoit que le plomb ne peut s'oxider qu'avec le contact de l'air; ce ne peut donc être, ni dans un creuset où le libre accès de l'air extérieur est interdit, ni même au milieu d'un fourneau à travers les charbons ardens, puisque 550 l'air de l'intérieur d'un fourneau altéré par la combustion & réduit pour la plus grande partie à l'état de gaz azote & de gaz acide carbonique, n'est plus propre à la calcination & à l'oxidation des métaux. Il a donc fallu imaginer un appareil particulier où le métal fût en même tems exposé à la grande violence du feu, & garanti du contact de l'air devenu incombustible par son passage à travers les charbons. Le fourneau destiné à remplir ce double objet, a été nommé, dans les arts, fourneau de coupelle. Il est communément de forme quarrée, ainsi qu'il est représenté planche XIII, fig. 8. Voyez, aussi sa coupe, fig. 10. Comme tous les fourneaux, bien construits, il doit avoir un cendrier AABB, un foyer BBCC, un laboratoire CCDD, un dôme DDEE.
C'est dans le laboratoire qu'on place ce qu'on nomme la mouffle. C'est une espèce de petit four GH, figures 9 & 10, fait de terre cuite & fermé par le fond. On le pose sur des barres qui traversent le fourneau, il s'ajuste avec l'ouverture G de la porte, & on l'y lute avec de l'argile délayée avec de l'eau. C'est dans cette espèce de four que se placent les coupelles. On met du charbon dessus & dessous la mouffle par les portes du dôme & du foyer: l'air qui est entré par les ouvertures du cendrier, après avoir 551 servi à la combustion, s'échappe par l'ouverture supérieure EE. A l'égard de la mouffle, l'air extérieur y pénètre par la porte GG, & il y entretient la calcination métallique.
En réfléchissant sur cette construction, on s'apperçoit aisément combien elle est vicieuse. Elle a deux inconvéniens principaux: quand la porte GG est fermée, l'oxidation se fait lentement & difficilement à défaut d'air pour l'entretenir; lorsqu'elle est ouverte, le courant d'air froid qui s'introduit fait figer le métal & suspend l'opération. Il ne seroit pas difficile de remédier à ces inconvéniens, en construisant la mouffle & le fourneau de manière qu'il y eût un courant d'air extérieur toujours renouvellé qui rasât la surface du métal. On feroit passer cet air à travers un tuyau de terre qui seroit entretenu rouge par le feu même du fourneau, afin que l'intérieur de la mouffle ne fût jamais refroidi; & on feroit en quelques minutes ce qui demande souvent un tems considérable.
M. Sage a été conduit par d'autres principes à de semblables conséquences. Il place la coupelle qui contient le plomb allié de fin dans un fourneau ordinaire à travers les charbons; il la recouvre avec une petite mouffle de porcelaine, & quand le tout est suffisamment chaud, il dirige sur le métal le courant d'air d'un soufflet 552 ordinaire à main: la coupellation de cette manière se fait avec une grande facilité, & à ce qu'il paroît, avec beaucoup d'exactitude.
§. III.
Des moyens d'augmenter considérablement l'action du feu, en
substituant le gaz oxygène à l'air de l'atmosphère.
On a obtenu avec les grands verres ardens qui ont été construits jusqu'à ce jour, tels que ceux de Tchirnausen & celui de M. de Trudaine, une intensité de chaleur un peu plus grande que celle qui a lieu dans les fourneaux chimiques, & même dans les fours où l'on cuit la porcelaine dure. Mais ces instrumens sont extrêmement chers, & ils ne vont pas même jusqu'à fondre la platine brute; en sorte que leur avantage, relativement à l'effet qu'ils produisent, n'est presque d'aucune considération, & qu'il est plus que compensé par la difficulté de se les procurer & même d'en faire usage.
Les miroirs concaves à diamètre égal font un peu plus d'effet que les verres ardens; on en a la preuve par les expériences faites par MM. Macquer & Baumé, avec le miroir de M. l'Abbé Bouriot: mais comme la direction des rayons réfléchis est de bas en haut, il faut opérer en l'air & sans support; ce qui rend 553 absolument impossible le plus grand nombre des expériences chimiques.
Ces considérations m'avoient déterminé d'abord à essayer de remplir de grandes vessies de gaz oxygène, à y adapter un tube susceptible d'être fermé par un robinet, & à m'en servir pour animer avec ce gaz le feu des charbons allumés. L'intensité de chaleur fut telle, même dans mes premières tentatives, que je parvins à fondre une petite quantité de platine brute avec assez de facilité.
C'est à ce premier succès que je dois l'idée du gazomètre dont j'ai donné la description, page 346 & suivantes. Je l'ai substitué aux vessies; & comme on peut donner au gaz oxygène le degré de pression qu'on juge à propos, on peut non-seulement s'en procurer un écoulement continu, mais lui donner même un grand degré de vitesse.
Le seul appareil dont on ait besoin pour ce genre d'expériences, consiste en une petite table ABCD, pl. XII, fig. 15, percée d'un trou en F, à travers lequel on fait passer un tube de cuivre ou d'argent FG, terminé en G par une très-petite ouverture qu'on peut ouvrir ou fermer par le moyen du robinet H. Ce tube se continue par dessous la table en lmno, & va s'adapter au gazomètre avec l'intérieur duquel il 554 communique. Lorsqu'on veut opérer, on commence à faire avec le tourne-vis KI un creux de quelques lignes de profondeur dans un gros charbon noir. On place dans ce creux le corps que l'on veut fondre: on allume ensuite le charbon avec un chalumeau de verre, à la flamme d'une chandelle ou d'une bougie; après quoi on l'expose au courant de gaz oxygène qui sort avec rapidité par le bec ou extrémité G du tube FG.
Cette manière d'opérer ne peut être employée que pour les corps qui peuvent être mis sans inconvénient en contact avec les charbons, tels que les métaux, les terres simples, &c. A l'égard des corps dont les principes ont de l'affinité avec le charbon & que cette substance décompose, comme les sulfates, les phosphates, & en général presque tous les sels neutres, les verres métalliques, les émaux, &c. on se sert de la lampe d'émailleur, à travers de laquelle on fait passer un courant de gaz oxygène. Alors, au lieu de l'ajutage recourbé EG, on se sert de celui coudé ST, qu'on visse à la place & qui dirige le courant de gaz oxygène à travers la flamme de la lampe. L'intensité de chaleur que donne ce second moyen n'est pas aussi forte que celle qu'on obtient par le premier, & ce n'est qu'avec beaucoup 555 de peine qu'on parvient à fondre la platine.
Les supports dont on se sert dans cette seconde manière d'opérer, sont ou des coupelles d'os calcinés, ou de petites capsules de porcelaine, ou même des capsules ou cuillers métalliques. Pourvu que ces dernières ne soient pas trop petites, elles ne fondent pas, attendu que les métaux sont bons conducteurs de chaleur, que le calorique se répartit en conséquence promptement & facilement dans toute la masse, & n'en échauffe que médiocrement chacune des parties.
On peut voir dans les volumes de l'Académie, année 1782, page 476, & 1783, page 573, la suite d'expériences que j'ai faites avec cet appareil. Il en résulte, 1o. que le cristal de roche, c'est-à-dire la terre siliceuse pure, est infusible; mais qu'elle devient susceptible de ramollissement & de fusion, dès qu'elle est mélangée.
2o. Que la chaux, la magnésie & la baryte ne sont fusibles ni seules, ni combinées ensemble; mais qu'elles facilitent, sur-tout la chaux, la fusion de toutes les autres substances.
3o. Que l'alumine est complètement fusible seule, & qu'il résulte de sa fusion une substance vitreuse opaque très-dure, qui raye le verre comme les pierres précieuses.
556
4o. Que toutes les terres & pierres composées se fondent avec beaucoup de facilité, & forment un verre brun.
5o. Que toutes les substances salines, même l'alkali fixe, se volatilisent en peu d'instans.
6o. Que l'or, l'argent, etc. & probablement la platine, se volatilisent lentement à ce degré de feu, & se dissipent sans aucune circonstance particulière.
7o. Que toutes les autres substances métalliques, à l'exception du mercure, s'oxident quoique placées sur un charbon; qu'elles y brûlent avec une flamme plus ou moins grande & diversement colorée, & finissent par se dissiper entièrement.
8o. Que les oxides métalliques brûlent également tous avec flamme; ce qui semble établir un caractère distinctif de ces substances, ce qui me porte à croire, comme Bergman l'avoit soupçonné, que la baryte est un oxide métallique, quoiqu'on ne soit pas encore parvenu à en obtenir le métal dans son état de pureté.
9o. Que parmi les pierres précieuses, les unes, comme le rubis, sont susceptibles de se ramollir et de se souder, sans que leur couleur & même que leur poids soient altérés; que d'autres, comme l'hyacinthe dont la fixité est presque 557 égale à celle du rubis, perdent facilement leur couleur; que la topase de Saxe, la topase & le rubis du Bresil non-seulement se décolorent promptement à ce degré de feu, mais qu'ils perdent même un cinquième de leur poids, & qu'il reste, lorsqu'ils ont subi cette altération, une terre blanche semblable en apparence à du quartz blanc ou à du biscuit de porcelaine; enfin que l'émeraude, la chrysolite & le grenat fondent presque sur-le-champ en un verre opaque & coloré.
10o. Qu'à l'égard du diamant, il présente une propriété qui lui est toute particulière, celle de se brûler à la manière des corps combustibles & de se dissiper entièrement.
Il est un autre moyen dont je n'ai point encore fait usage, pour augmenter encore davantage l'activité du feu par le moyen du gaz oxygène; c'est de l'employer à souffler un feu de forge. M. Achard en a eu la première idée; mais les procédés qu'il a employés & au moyen desquels il croyoit déphlogistiquer l'air de l'atmosphère, ne l'ont conduit à rien de satisfaisant. L'appareil que je me propose de faire construire, sera très-simple: il consistera dans un fourneau ou espèce de forge d'une terre extrêmement réfractaire; sa figure sera à peu près semblable à celle du fourneau représenté 558 planche XIII, figure 4; il sera seulement moins élevé & en général construit sur de plus petites dimensions. Il aura deux ouvertures, l'une en E à laquelle s'adaptera le bout d'un soufflet, & une seconde toute semblable à laquelle s'ajustera un tuyau qui communiquera avec le gazomètre. Je pousserai d'abord le feu aussi loin qu'il sera possible par le vent du soufflet; & quand je serai parvenu à ce point, je remplirai entièrement le fourneau de charbons embrasés; puis interceptant tout-à-coup le vent du soufflet, je donnerai par l'ouverture d'un robinet accès au gaz oxygène du gazomètre, & je le ferai arriver avec quatre ou cinq pouces de pression. Je puis réunir ainsi le gaz oxygène de plusieurs gazomètres, de manière à en faire passer jusqu'à huit à neuf pieds cubes à travers le fourneau, & je produirai une intensité de chaleur certainement très-supérieure à tout ce que nous connoissons. J'aurai soin de tenir l'ouverture supérieure du fourneau très-grande, afin que le calorique ait une libre issue, & qu'une expansion trop rapide de ce fluide si éminemment élastique ne produise point une explosion.
FIN.
561
TABLES
A L'USAGE DES CHIMISTES.
No. I.
Table pour convertir les onces, gros & grains en fractions décimales
de livre, poids de marc.
| Table pour les grains. | ||||
| Grains poids de marc. | Fractions décimales de livre correspondantes. | Grains poids de marc. | Fractions décimales de livre correspondantes. | |
| livre. | livre. | |||
| 1 | 0,000108507 | 13 | 0,001410591 | |
| 2 | 0,000217014 | 14 | 0,001519098 | |
| 3 | 0,000325521 | 15 | 0,001627605 | |
| 4 | 0,000434028 | 16 | 0,001736112 | |
| 5 | 0,000542535 | 17 | 0,001844619 | |
| 6 | 0,000651042 | 18 | 0,001953125 | |
| 7 | 0,000759549 | 19 | 0,002061633 | |
| 8 | 0,000868056 | 20 | 0,002170140 | |
| 9 | 0,000976563 | 21 | 0,002278647 | |
| 10 | 0,001085070 | 22 | 0,002387154 | |
| 11 | 0,001193577 | 23 | 0,002495661 | |
| 12 | 0,001302084 | 24 | 0,002604168 | |
562
| Grains poids de marc. | Fractions décimales de livre correspondantes. | Grains poids de marc. | Fractions décimales de livre correspondantes. | |
| livre. | livre. | |||
| 25 | 0,002712675 | 51 | 0,005533857 | |
| 26 | 0,002821182 | 52 | 0,005642364 | |
| 27 | 0,002929689 | 53 | 0,005750871 | |
| 28 | 0,003038196 | 54 | 0,005859378 | |
| 29 | 0,003146703 | 55 | 0,005967885 | |
| 30 | 0,003255210 | 56 | 0,006076372 | |
| 31 | 0,003363717 | 57 | 0,006184899 | |
| 32 | 0,003472224 | 58 | 0,006293406 | |
| 33 | 0,003580731 | 59 | 0,006401913 | |
| 34 | 0,003689238 | 60 | 0,006510420 | |
| 35 | 0,003797745 | 61 | 0,006618927 | |
| 36 | 0,003906252 | 62 | 0,006727434 | |
| 37 | 0,004014759 | 63 | 0,006835941 | |
| 38 | 0,004123266 | 64 | 0,006944448 | |
| 39 | 0,004231773 | 65 | 0,007052955 | |
| 40 | 0,004340280 | 66 | 0,007161462 | |
| 41 | 0,004448787 | 67 | 0,007269969 | |
| 42 | 0,004557294 | 68 | 0,007378456 | |
| 43 | 0,004665801 | 69 | 0,007486983 | |
| 44 | 0,004774308 | 70 | 0,007595490 | |
| 45 | 0,004882815 | 71 | 0,007703997 | |
| 46 | 0,004991322 | 72 | 0,007812504 | |
| 47 | 0,005099829 | 73 | 0,007921011 | |
| 48 | 0,005208336 | 74 | 0,008029518 | |
| 49 | 0,005316843 | 75 | 0,008138025 | |
| 50 | 0,005425350 | 76 | 0,008246532 |
563
| Grains poids de marc. | Fractions décimales de livre correspondantes. | Grains poids de marc. | Fractions décimales de livre correspondantes. | |
| livre. | livre. | |||
| 77 | 0,008355039 | 89 | 0,009657123 | |
| 78 | 0,008463546 | 90 | 0,009765630 | |
| 79 | 0,008572053 | 91 | 0,009874137 | |
| 80 | 0,008680560 | 92 | 0,009982644 | |
| 81 | 0,008789067 | 93 | 0,010091151 | |
| 82 | 0,008897574 | 94 | 0,010199658 | |
| 83 | 0,009006081 | 95 | 0,010308165 | |
| 84 | 0,009114588 | 96 | 0,010416672 | |
| 85 | 0,009223095 | 97 | 0,010525179 | |
| 86 | 0,009331602 | 98 | 0,010633686 | |
| 87 | 0,009440109 | 99 | 0,010742193 | |
| 88 | 0,009548616 | 100 | 0,010850700 |
| Pour les Gros. | Pour les Onces. | |||
| gros. | livre. | onces. | livre. | |
| 1 | 0,0078125 | 1 | 0,0625000 | |
| 2 | 0,0156250 | 2 | 0,1250000 | |
| 3 | 0,0234375 | 3 | 0,1875000 | |
| 4 | 0,0312500 | 4 | 0,2500000 | |
| 5 | 0,0390625 | 5 | 0,3125000 | |
| 6 | 0,0468750 | 6 | 0,3750000 | |
| 7 | 0,0546875 | 7 | 0,4375000 | |
| 8 | 0,0625000 | 8 | 0,5000000 | |
| 9 | 0,0703125 | 9 | 0,5625000 | |
| 10 | 0,0781250 | 10 | 0,6250000 | |
| 11 | 0,0859375 | 11 | 0,6875000 | |
| 12 | 0,0937500 | 12 | 0,7500000 | |
| 13 | 0,1015625 | 13 | 0,8125000 | |
| 14 | 0,1093750 | 14 | 0,8750000 | |
| 15 | 0,1171875 | 15 | 0,9375000 | |
| 16 | 0,1250000 | 16 | 1,0000000 | |
564
No. II.
Table pour convertir les fractions décimales de livre en
fractions vulgaires.
| Pour les dixiemes de livre. | Pour les milliemes de livre. | |||||||
| Fractions décimales de livre. | Fractions vulgaires de livre correspondantes. | Fractions décimales de livre. | Fractions vulgaires de livre correspondantes. | |||||
| livre. | onces. | gros. | grains. | livre. | onces. | gros. | grains. | |
| 0,1 | 1 | 4 | 57,60 | 0,001 | » | » | 9,22 | |
| 0,2 | 3 | 1 | 43,20 | 0,002 | » | » | 18,43 | |
| 0,3 | 4 | 6 | 28,80 | 0,003 | » | » | 27,65 | |
| 0,4 | 6 | 3 | 14,40 | 0,004 | » | » | 36,86 | |
| 0,5 | 8 | 8 | 0 | 0,005 | » | » | 46,08 | |
| 0,6 | 9 | 4 | 57,60 | 0,006 | » | » | 55,30 | |
| 0,7 | 11 | 1 | 43,20 | 0,007 | » | » | 64,51 | |
| 0,8 | 12 | 6 | 28,80 | 0,008 | » | 1 | 1,73 | |
| 0,9 | 14 | 3 | 14,40 | 0,009 | » | 1 | 10,94 | |
| 1, | 16 | 0 | 0 | 0,010 | » | 1 | 20,16 | |
| Pour les centiemes de livre. | Pour les dix milliemes de livre. | |||||
| livre. | onces. | gros. | grains. | livre. | grains. | |
| 0,01 | » | 1 | 20,16 | 0,0001 | 0,92 | |
| 0,02 | » | 2 | 40,32 | 0,0002 | 1,84 | |
| 0,03 | » | 3 | 60,48 | 0,0003 | 2,76 | |
| 0,04 | » | 5 | 8,64 | 0,0004 | 3,69 | |
| 0,05 | » | 6 | 28,80 | 0,0005 | 4,61 | |
| 0,06 | » | 7 | 48,96 | 0,0006 | 5,53 | |
| 0,07 | 1 | 0 | 69,12 | 0,0007 | 6,45 | |
| 0,08 | 1 | 2 | 17,28 | 0,0008 | 7,37 | |
| 0,09 | 1 | 3 | 37,44 | 0,0009 | 8,29 | |
| 0,10 | 1 | 4 | 57,60 | 0,0010 | 9,22 | |
565
| Pour les cent milliemes de livre. | Pour les millioniemes de livre. | |||
| Fractions décimales de livre. | Fractions vulgaires de livre correspondantes. | Fractions décimales de livre. | Fractions vulgaires de livre correspondantes. | |
| livre. | grains. | livre. | grains. | |
| 0,00001 | 0,09 | 0,000001 | 0,01 | |
| 0,00002 | 0,18 | 0,000002 | 0,02 | |
| 0,00003 | 0,28 | 0,000003 | 0,03 | |
| 0,00004 | 0,37 | 0,000004 | 0,04 | |
| 0,00005 | 0,46 | 0,000005 | 0,05 | |
| 0,00006 | 0,55 | 0,000006 | 0,06 | |
| 0,00007 | 0,64 | 0,000007 | 0,07 | |
| 0,00008 | 0,74 | 0,000008 | 0,08 | |
| 0,00009 | 0,83 | 0,000009 | 0,09 | |
| 0,00010 | 0,92 | 0,000010 | 0,10 | |
566
No. III.
Table du nombre de Pouces cubes correspondans à un poids
déterminé d'eau.
| Table pour les grains. | ||||
| Grains d'eau, poids de marc. | Nombre de pouces cubes correspondans | Grains d'eau, poids de marc. | Nombre de pouces cubes correspondans. | |
| 1 | 0,003 | 23 | 0,062 | |
| 2 | 0,005 | 24 | 0,065 | |
| 3 | 0,008 | 25 | 0,067 | |
| 4 | 0,011 | 26 | 0,070 | |
| 5 | 0,013 | 27 | 0,073 | |
| 6 | 0,016 | 28 | 0,076 | |
| 7 | 0,019 | 29 | 0,078 | |
| 8 | 0,022 | 30 | 0,081 | |
| 9 | 0,024 | 31 | 0,084 | |
| 10 | 0,027 | 32 | 0,086 | |
| 11 | 0,030 | 33 | 0,089 | |
| 12 | 0,032 | 34 | 0,092 | |
| 13 | 0,035 | 35 | 0,094 | |
| 14 | 0,038 | 36 | 0,097 | |
| 15 | 0,040 | 37 | 0,100 | |
| 16 | 0,043 | 38 | 0,103 | |
| 17 | 0,046 | 39 | 0,105 | |
| 18 | 0,049 | 40 | 0,108 | |
| 19 | 0,051 | 41 | 0,111 | |
| 20 | 0,054 | 42 | 0,113 | |
| 21 | 0,057 | 43 | 0,116 | |
| 22 | 0,059 | 44 | 0,119 | |
567
| Grains d'eau, poids de marc. | Nombre de pouces cubes correspondans | Grains d'eau, poids de marc. | Nombre de pouces cubes correspondans. | |
| 45 | 0,121 | 59 | 0,159 | |
| 46 | 0,124 | 60 | 0,162 | |
| 47 | 0,127 | 61 | 0,165 | |
| 48 | 0,130 | 62 | 0,167 | |
| 49 | 0,132 | 63 | 0,170 | |
| 50 | 0,135 | 64 | 0,173 | |
| 51 | 0,138 | 65 | 0,175 | |
| 52 | 0,140 | 66 | 0,178 | |
| 53 | 0,143 | 67 | 0,181 | |
| 54 | 0,146 | 68 | 0,184 | |
| 55 | 0,148 | 69 | 0,186 | |
| 56 | 0,151 | 70 | 0,189 | |
| 57 | 0,154 | 71 | 0,192 | |
| 58 | 0,157 | 72 | 0,194 |
| Table pour les Gros. | Table pour les Onces. | |||
| pouces. cubes. | pouces. cubes. | |||
| 1 | 0,193 | 1 | 1,543 | |
| 2 | 0,386 | 2 | 3,086 | |
| 3 | 0,579 | 3 | 4,629 | |
| 4 | 0,772 | 4 | 6,172 | |
| 5 | 0,965 | 5 | 7,715 | |
| 6 | 1,158 | 6 | 9,258 | |
| 7 | 1,351 | 7 | 10,801 | |
| 8 | 1,543 | 8 | 12,344 | |
| 9 | 13,887 | |||
| 10 | 15,430 | |||
| 11 | 16,973 | |||
| 12 | 18,516 | |||
| 13 | 20,059 | |||
| 14 | 21,602 | |||
| 15 | 23,145 | |||
| 16 | 24,687 | |||
568
| Table pour les Livres. | ||||
| Livres d'eau, poids de marc. | Nombre de pouces cubes correspondans | Livres d'eau, poids de marc. | Nombre de pouces cubes correspondans. | |
| pouces. cubes. | pouces. cubes. | |||
| 1 | 24,687 | 20 | 493,740 | |
| 2 | 49,374 | 21 | 518,427 | |
| 3 | 74,061 | 22 | 543,114 | |
| 4 | 98,748 | 23 | 567,801 | |
| 5 | 123,420 | 24 | 592,448 | |
| 6 | 148,122 | 25 | 617,175 | |
| 7 | 172,809 | 26 | 641,862 | |
| 8 | 197,496 | 27 | 666,549 | |
| 9 | 222,180 | 28 | 691,236 | |
| 10 | 246,870 | 29 | 715,923 | |
| 11 | 271,557 | 30 | 740,610 | |
| 12 | 296,244 | 40 | 987,480 | |
| 13 | 320,931 | 50 | 1234,200 | |
| 14 | 345,618 | 60 | 1481,220 | |
| 15 | 370,305 | 70 | 1728,000 | |
| 16 | 394,992 | 80 | 1974,960 | |
| 17 | 419,676 | 90 | 2221,800 | |
| 18 | 444,360 | 100 | 2328,700 | |
| 19 | 469,050 | |||
569
No. IV.
Table pour convertir les lignes & fractions de lignes en
fractions décimales de pouce.
| Table pour les fractions de ligne. | Table pour les lignes. | |||
| Douzièmes de lignes. | Fractions décimales de pouce correspondantes. | Lignes. | Fractions décimales de pouce correspondantes. | |
| pouces. | pouces. | |||
| 1 | 0,00694 | 1 | 0,08333 | |
| 2 | 0,01389 | 2 | 0,16667 | |
| 3 | 0,02083 | 3 | 0,25000 | |
| 4 | 0,02778 | 4 | 0,33333 | |
| 5 | 0,03472 | 5 | 0,41667 | |
| 6 | 0,04167 | 6 | 0,50000 | |
| 7 | 0,04861 | 7 | 0,58333 | |
| 8 | 0,05556 | 8 | 0,66667 | |
| 9 | 0,06250 | 9 | 0,75000 | |
| 10 | 0,06944 | 10 | 0,83333 | |
| 11 | 0,07639 | 11 | 0,91667 | |
| 12 | 0,08333 | 12 | 1,00000 | |
570
No. V.
Table pour convertir les hauteurs d'eau observées dans les
cloches ou jarres, en hauteurs correspondantes de mercure exprimées en
fractions décimales de pouce.
| Hauteur de l'eau exprimée en lignes. | Hauteur correspondante du mercure exprimée en fractions décimales de pouce. | Hauteur de l'eau exprimée en lignes. | Hauteur correspondante du mercure exprimée en fractions décimales de pouce. | ||
| lignes. | pouces. | pouces. | lignes. | pouces. | |
| 1 | 0,00614 | 20 | 0,12284 | ||
| 2 | 0,01228 | 21 | 0,12898 | ||
| 3 | 0,01843 | 22 | 0,13512 | ||
| 4 | 0,02457 | 23 | 0,14126 | ||
| 5 | 0,03071 | 2 | 0,14741 | ||
| 6 | 0,03685 | 3 | 0,22111 | ||
| 7 | 0,04299 | 4 | 0,29481 | ||
| 8 | 0,04914 | 5 | 0,36852 | ||
| 9 | 0,05528 | 6 | 0,44222 | ||
| 10 | 0,06142 | 7 | 0,51593 | ||
| 11 | 0,06756 | 8 | 0,58963 | ||
| 12 | 0,07370 | 9 | 0,66333 | ||
| 13 | 0,07985 | 10 | 0,73704 | ||
| 14 | 0,08599 | 11 | 0,81074 | ||
| 15 | 0,09213 | 12 | 0,88444 | ||
| 16 | 0,09827 | 13 | 0,95815 | ||
| 17 | 0,10441 | 14 | 1,03185 | ||
| 18 | 0,11055 | 15 | 1,10556 | ||
| 19 | 0,11670 | 16 | 1,17926 | ||
571
No. VI.
Table des quantités de pouces cubiques françois correspondans
à une once, mesure de M. Priestley.
| Onces, mesure de M. Priestley. | Pouces cubiques françois correspondans. | Onces, mesure de M. Priestley. | Pouces cubiques françois correspondans. | |
| 1 | 1,567 | 20 | 31,340 | |
| 2 | 3,134 | 30 | 47,010 | |
| 3 | 4,701 | 40 | 62,680 | |
| 4 | 6,268 | 50 | 78,350 | |
| 5 | 7,835 | 60 | 94,020 | |
| 6 | 9,402 | 70 | 109,690 | |
| 7 | 10,969 | 80 | 125,360 | |
| 8 | 12,536 | 90 | 141,030 | |
| 9 | 14,103 | 100 | 156,700 | |
| 10 | 15,670 | 200 | 313,400 | |
| 11 | 17,237 | 300 | 470,100 | |
| 12 | 18,804 | 400 | 626,800 | |
| 13 | 20,371 | 500 | 783,500 | |
| 14 | 21,938 | 600 | 940,200 | |
| 15 | 23,505 | 700 | 1096,900 | |
| 16 | 25,072 | 800 | 1253,600 | |
| 17 | 26,639 | 900 | 1410,300 | |
| 18 | 28,206 | 1000 | 1567,000 | |
| 19 | 29,773 |
572
No. VII.
Table des pesanteurs des différens gaz à 28 pouces de
pression & à 10 degrés du thermomètre.
| Noms des airs ou gaz. | Poids du pouce cube. | Poids du pied cube. | Observations. | ||
| grains. | onces. | gros. | grains. | ||
| Air atmosphérique. | 0,46005 | 1 | 3 | 3,00 | D'après mes expér. |
| Gaz azote. | 0,44444 | 1 | 2 | 48,00 | D'après mes expér. |
| Gaz oxigène. | 0,50694 | 1 | 4 | 12,00 | D'après mes expér. |
| Gaz hydrogène. | 0,03539 | » | » | 61,15 | D'après mes expér. |
| Gaz acide carbonique. | 0,68985 | 2 | » | 40,00 | D'après mes expér. |
| Gaz nitreux. | 0,54690 | 1 | 5 | 9,04 | D'après M. Kirwan. |
| Gaz ammoniaque. | 0,27488 | » | 6 | 43,00 | D'après M. Kirwan. |
| Gaz acide sulfureux. | 1,03820 | 3 | » | 66,00 | D'après M. Kirwan. |
573
No. VIII.
Table des Pesanteurs spécifiques des substances minérales,
extraite de l'ouvrage de M. Brisson.
| Substances métalliques. | ||||||||||
| Noms des substances métalliques. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Or. | Or à 24 karats, fondu & non forgé. | 192581 | 12 | 3 | 62 | 1348 | 1 | 0 | 41 | |
| Le même fondu & forgé. | 193617 | 12 | 4 | 28 | 1355 | 5 | 0 | 60 | ||
| Or au titre de Paris, ou à 22 karats, fondu & non forgé. | 174863 | 11 | 2 | 48 | 1224 | 0 | 5 | 18 | ||
| Le même fondu & forgé. | 175894 | 11 | 3 | 15 | 1231 | 4 | 1 | 2 | ||
| Or au titre de la monoie de France, ou à 21 22/32 karats, fondu & non forgé. | 174022 | 11 | 2 | 17 | 1218 | 2 | 3 | 51 | ||
| Le même monoyé. | 176474 | 11 | 3 | 36 | 1235 | 5 | 0 | 51 | ||
| Or au titre des bijoux, ou à 20 karats, fondu & non forgé. | 157090 | 10 | 1 | 33 | 1099 | 10 | 0 | 46 | ||
| Le même, fondu & forgé. | 157746 | 10 | 1 | 57 | 1104 | 3 | 4 | 30 | ||
| Argent. | Argent à 12 deniers fondu & non forgé. | 104743 | 6 | 6 | 22 | 733 | 3 | 1 | 52 | |
| Le même fondu & forgé. | 105107 | 6 | 6 | 36 | 735 | 11 | 7 | 43 | ||
| 574Argent au titre de Paris, ou à 11 deniers 10 grains, fondu & non forgé. | 101752 | 6 | 4 | 55 | 712 | 4 | 1 | 57 | ||
| Le même, fondu & forgé. | 103765 | 6 | 5 | 58 | 726 | 5 | 5 | 32 | ||
| Argent au titre de la monoie de France, ou à 10 deniers 21 grains, fondu & non forgé. | 100476 | 6 | 4 | 7 | 703 | 5 | 2 | 36 | ||
| Le même monoyé. | 104077 | 6 | 5 | 70 | 728 | 8 | 4 | 71 | ||
| Platine. | Platine brut en grenailles. | 156017 | 10 | 0 | 65 | 1092 | 1 | 7 | 17 | |
| Le même décapé, par l'acide muriatique. | 167521 | 10 | 6 | 62 | 1172 | 10 | 2 | 59 | ||
| Platine purifié fondu. | 195000 | 12 | 5 | 8 | 1365 | 0 | 0 | 0 | ||
| Platine purifié forgé. | 203366 | 13 | 1 | 32 | 1423 | 8 | 7 | 67 | ||
| Platine purifié, passé par la filiere. | 210417 | 13 | 5 | 8 | 1472 | 14 | 5 | 46 | ||
| Platine purifié passé au laminoir. | 220690 | 14 | 2 | 31 | 1544 | 13 | 2 | 17 | ||
| Cuivre. | Cuivre rouge fondu & non forgé. | 77880 | 5 | 0 | 28 | 545 | 2 | 4 | 35 | |
| Le même fondu & passé à la filiere. | 88785 | 5 | 6 | 3 | 621 | 7 | 7 | 26 | ||
| Cuivre jaune fondu & non forgé. | 83958 | 5 | 3 | 38 | 587 | 11 | 2 | 26 | ||
| Le même fondu & passé à la filiere. | 85441 | 5 | 4 | 22 | 598 | 1 | 3 | 10 | ||
| 575Fer. | Fer fondu. | 72070 | 4 | 5 | 27 | 504 | 7 | 6 | 52 | |
| Fer forgé en barre, écroui ou non écroui. | 77880 | 5 | 0 | 28 | 545 | 2 | 4 | 35 | ||
| Acier ni trempé, ni écroui. | 78331 | 5 | 0 | 44 | 548 | 5 | 0 | 41 | ||
| Le même écroui & non trempé. | 78404 | 5 | 0 | 47 | 548 | 13 | 1 | 71 | ||
| Le même écroui & ensuite trempé. | 78180 | 5 | 0 | 39 | 547 | 4 | 1 | 20 | ||
| Le même trempé & non écroui. | 78163 | 5 | 0 | 38 | 547 | 2 | 2 | 3 | ||
| Etain. | Etain pur de Cornouailles, fondu & non écroui. | 72914 | 4 | 5 | 58 | 510 | 6 | 2 | 68 | |
| Le même fondu & écroui. | 72994 | 4 | 5 | 61 | 510 | 15 | 2 | 45 | ||
| Etain de Mélac, fondu & non écroui. | 72963 | 4 | 5 | 60 | 510 | 11 | 6 | 61 | ||
| Le même fondu & écroui. | 73065 | 4 | 5 | 64 | 511 | 7 | 2 | 17 | ||
| Plomb. | Plomb fondu. | 113523 | 7 | 2 | 62 | 794 | 10 | 4 | 44 | |
| Zinc. | Zinc fondu. | 71908 | 4 | 5 | 21 | 503 | 5 | 5 | 41 | |
| Bismuth. | Bismuth fondu. | 98227 | 6 | 2 | 67 | 687 | 9 | 3 | 28 | |
| Cobalt. | Cobalt fondu. | 78119 | 5 | 0 | 36 | 546 | 13 | 2 | 45 | |
| Antimoine. | Antimoine fondu. | 67021 | 4 | 2 | 54 | 469 | 2 | 2 | 59 | |
| Antimoine crud. | 40643 | 2 | 5 | 5 | 284 | 8 | 0 | 9 | ||
| Verre d'antimoine. | 49464 | 3 | 1 | 47 | 346 | 3 | 7 | 64 | ||
| 576Arsenic. | Arsenic fondu. | 57633 | 3 | 5 | 64 | 403 | 6 | 7 | 12 | |
| Nickel. | Nickel fondu. | 78070 | 5 | 0 | 35 | 546 | 7 | 6 | 52 | |
| Molybdène. | . . . . . . . . . . . . . . . . . . . . . . . | 47385 | 3 | 0 | 41 | 331 | 11 | 1 | 69 | |
| Tungstène. | . . . . . . . . . . . . . . . . . . . . . . . | 60665 | 3 | 7 | 33 | 424 | 10 | 3 | 60 | |
| Mercure. | . . . . . . . . . . . . . . . . . . . . . . . | 135681 | 8 | 6 | 25 | 949 | 12 | 2 | 13 | |
| Pierres précieuses. | ||||||||||
| Noms des pierres précieuses. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Diamant. | Diamant Oriental blanc. | 35212 | 2 | 2 | 19 | 246 | 7 | 5 | 69 | |
| Diamant Oriental couleur de rose. | 35310 | 2 | 2 | 22 | 247 | 2 | 5 | 55 | ||
| Rubis. | Rubis Oriental. | 42833 | 2 | 6 | 15 | 299 | 13 | 2 | 26 | |
| Rubis Spinelle. | 37600 | 2 | 3 | 36 | 263 | 3 | 1 | 43 | ||
| Rubis Balai. | 36458 | 2 | 2 | 65 | 255 | 3 | 2 | 26 | ||
| Rubis du Brésil. | 35311 | 2 | 2 | 22 | 247 | 2 | 6 | 47 | ||
| Topaze. | Topaze Orientale. | 40106 | 2 | 4 | 57 | 280 | 11 | 6 | 70 | |
| Topaze-pistache Orientale. | 40615 | 2 | 5 | 4 | 284 | 4 | 7 | 3 | ||
| Topaze du Brésil. | 35365 | 2 | 2 | 24 | 247 | 8 | 7 | 3 | ||
| 577Topaze de Saxe. | 35640 | 2 | 2 | 35 | 249 | 7 | 5 | 32 | ||
| Topaze blanche de Saxe. | 35535 | 2 | 2 | 31 | 248 | 11 | 7 | 26 | ||
| Saphir. | Saphir Oriental. | 39941 | 2 | 4 | 51 | 279 | 9 | 3 | 10 | |
| Saphir Oriental blanc. | 39911 | 2 | 4 | 50 | 279 | 6 | 0 | 18 | ||
| Saphir du Puy. | 40769 | 2 | 5 | 10 | 285 | 6 | 1 | 2 | ||
| Saphir du Brésil. | 31307 | 2 | 0 | 17 | 219 | 2 | 3 | 5 | ||
| Girasol. | . . . . . . . . . . . . . . . . . . . . . . . | 40000 | 2 | 4 | 53 | 280 | 0 | 0 | 0 | |
| Jargon. | Jargon de Ceylan. | 44161 | 2 | 6 | 65 | 309 | 2 | 0 | 18 | |
| Hyacinthe. | Hyacinthe commune. | 36873 | 2 | 3 | 9 | 258 | 1 | 5 | 22 | |
| Vermeille. | . . . . . . . . . . . . . . . . . . . . . . . | 42299 | 2 | 5 | 67 | 296 | 1 | 3 | 65 | |
| Grenat. | Grenat de Bohême. | 41888 | 2 | 5 | 52 | 293 | 3 | 3 | 47 | |
| Grenat en cristal dodécaèdre. | 40627 | 2 | 5 | 5 | 284 | 6 | 1 | 57 | ||
| Grenat en cristal à 24 faces, volcanisé. | 24684 | 1 | 4 | 58 | 172 | 12 | 4 | 62 | ||
| Grenat Syrien. | 40000 | 2 | 4 | 53 | 280 | 0 | 0 | 0 | ||
| Emeraude. | Emeraude du Pérou. | 27755 | 1 | 6 | 28 | 194 | 4 | 4 | 35 | |
| Chrysolite. | Chrysolite des Joailliers. | 27821 | 1 | 6 | 31 | 194 | 11 | 7 | 44 | |
| Chrysolite du Brésil. | 26923 | 1 | 5 | 69 | 188 | 7 | 3 | 1 | ||
| Aigue-marine. | Aigue-marine Orientale ou Béril. | 35489 | 2 | 2 | 29 | 248 | 6 | 6 | 10 | |
| Aigue-marine Occidentale. | 27227 | 1 | 6 | 8 | 190 | 9 | 3 | 28 | ||
| Pierres siliceuses. | ||||||||||
| Noms des pierres siliceuses. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| 578Cristal de Roche. | Cristal de Roche limpide de Madagascar. | 26530 | 1 | 5 | 54 | 185 | 11 | 2 | 64 | |
| Cristal de Roche du Brésil. | 26526 | 1 | 5 | 54 | 185 | 10 | 7 | 21 | ||
| Cristal de Roche gélatineux ou d'Europe. | 26548 | 1 | 5 | 55 | 185 | 13 | 3 | 1 | ||
| Quartz. | Quartz cristallisé. | 26546 | 1 | 5 | 55 | 185 | 13 | 1 | 16 | |
| Quartz en masse. | 26471 | 1 | 5 | 52 | 185 | 4 | 6 | 1 | ||
| Grès. | Grès des Paveurs. | 24158 | 1 | 4 | 38 | 169 | 1 | 5 | 41 | |
| Grès des Rémouleurs. | 21429 | 1 | 3 | 8 | 150 | 0 | 0 | 28 | ||
| Grès des Couteliers. | 21113 | 1 | 2 | 68 | 147 | 12 | 5 | 18 | ||
| Grès luisant de Fontainebleau. | 25616 | 1 | 5 | 20 | 179 | 4 | 7 | 67 | ||
| Pierre à faux à grain moyen d'Auvergne.. | 25638 | 1 | 5 | 21 | 179 | 7 | 3 | 47 | ||
| Pierre à faux de Lorraine. | 25298 | 1 | 5 | 8 | 177 | 1 | 3 | 1 | ||
| Agathe. | Agathe Orientale. | 25901 | 1 | 5 | 31 | 181 | 4 | 7 | 21 | |
| Agathe Onix. | 26375 | 1 | 5 | 49 | 184 | 10 | 0 | 0 | ||
| Calcédoine. | Calcédoine limpide. | 26640 | 1 | 5 | 59 | 186 | 7 | 5 | 32 | |
| Cornaline. | . . . . . . . . . . . . . . . . . . . . . . . | 26137 | 1 | 5 | 40 | 182 | 15 | 2 | 54 | |
| Sardoine. | Sardoine pure. | 26025 | 1 | 5 | 36 | 182 | 2 | 6 | 39 | |
| Prase. | . . . . . . . . . . . . . . . . . . . . . . . | 25805 | 1 | 5 | 27 | 180 | 10 | 1 | 20 | |
| Pierre à fusil. | Pierre à fusil blonde. | 25941 | 1 | 5 | 32 | 181 | 9 | 3 | 10 | |
| Pierre à fusil noirâtre. | 25817 | 1 | 5 | 28 | 180 | 11 | 4 | 2 | ||
| 579Caillou. | Caillou Onix. | 26644 | 1 | 5 | 59 | 186 | 8 | 1 | 2 | |
| Caillou de Rennes. | 26538 | 1 | 5 | 55 | 185 | 12 | 2 | 3 | ||
| Pierre meuliere. | . . . . . . . . . . . . . . . . . . . . . . . | 24835 | 1 | 4 | 63 | 173 | 13 | 4 | 12 | |
| Jade. | Jade blanc. | 29502 | 1 | 7 | 21 | 206 | 8 | 1 | 57 | |
| Jade verd. | 29660 | 1 | 7 | 27 | 207 | 9 | 7 | 26 | ||
| Jaspe. | Jaspe rouge. | 26612 | 1 | 5 | 58 | 186 | 4 | 4 | 25 | |
| Jaspe brun. | 26911 | 1 | 5 | 69 | 188 | 6 | 0 | 18 | ||
| Jaspe jaune. | 27101 | 1 | 6 | 4 | 189 | 11 | 2 | 36 | ||
| Jaspe violet. | 27111 | 1 | 6 | 4 | 189 | 12 | 3 | 33 | ||
| Jaspe gris. | 27640 | 1 | 6 | 24 | 193 | 7 | 5 | 32 | ||
| Jaspe Onix ou rubanné. | 28160 | 1 | 6 | 43 | 197 | 1 | 7 | 26 | ||
| Schorl. | Schorl noir, prismatique hexaèdre. | 33636 | 2 | 1 | 32 | 235 | 7 | 1 | 62 | |
| Schorl noir spathique. | 33852 | 2 | 1 | 40 | 236 | 15 | 3 | 28 | ||
| Schorl noir en masse, dit Basalte noir antique. | 29225 | 1 | 7 | 11 | 204 | 9 | 1 | 43 | ||
| Pierres argileuses ou alumineuses. | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Serpentine. | Serpentine opaque verte d'Italie, dite Gabro des Florentins. | 24295 | 1 | 4 | 43 | 170 | 1 | 0 | 23 | |
| 580Stéatite. | Craie de Briançon grossiere. | 27274 | 1 | 6 | 10 | 190 | 14 | 5 | 56 | |
| Craie d'Espagne. | 27902 | 1 | 6 | 34 | 195 | 5 | 0 | 14 | ||
| Pierre ollaire feuilletée du Dauphiné. | 27687 | 1 | 6 | 26 | 193 | 12 | 7 | 40 | ||
| Pierre ollaire feuilletée de Suéde. | 28531 | 1 | 6 | 57 | 199 | 11 | 3 | 56 | ||
| Talc. | Talc de Moscovie. | 27917 | 1 | 6 | 34 | 195 | 6 | 5 | 46 | |
| Mica noir. | 29004 | 1 | 7 | 3 | 203 | 0 | 3 | 42 | ||
| Schiste. | Schiste commun. | 26718 | 1 | 5 | 61 | 187 | 0 | 3 | 24 | |
| Ardoise neuve. | 28535 | 1 | 6 | 57 | 199 | 11 | 7 | 26 | ||
| Pierre à rasoir blanche. | 28763 | 1 | 6 | 66 | 201 | 5 | 3 | 47 | ||
| Pierre à rasoir noire & blanche. | 31311 | 2 | 0 | 17 | 219 | 2 | 6 | 47 | ||
| Pierres calcaires | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Spath calcaire. | Spath calcaire rhomboïdal dit Cristal d'Islande. | 27151 | 1 | 6 | 6 | 190 | 0 | 7 | 21 | |
| Spath calcaire pyramidal, dit Dent de cochon. | 27141 | 1 | 6 | 5 | 189 | 15 | 6 | 24 | ||
| Albâtre. | Albâtre Oriental blanc antique. | 27302 | 1 | 6 | 11 | 191 | 2 | 6 | 42 | |
| Marbre. | Marbre campan vert. | 27417 | 1 | 6 | 16 | 191 | 14 | 5 | 46 | |
| Marbre campan rouge. | 27242 | 1 | 6 | 9 | 190 | 11 | 0 | 60 | ||
| Marbre blanc de Carare. | 27168 | 1 | 6 | 6 | 190 | 2 | 6 | 38 | ||
| 581Marbre blanc de Paros. | 28376 | 1 | 6 | 51 | 198 | 10 | 0 | 65 | ||
| Pierres calcaires à bâtir. | Pierre de S. Leu, de la carriere de S. Leu. | 16593 | 1 | 0 | 43 | 116 | 2 | 3 | 24 | |
| Pierre de S. Leu, de la carriere de Notre Dame. | 18094 | 1 | 1 | 28 | 126 | 10 | 4 | 16 | ||
| Pierre de Vergelet, du plus gros grain. | 16542 | 1 | 0 | 42 | 115 | 12 | 5 | 46 | ||
| Pierre d'Arcueil. | 20605 | 1 | 2 | 49 | 144 | 3 | 6 | 6 | ||
| Pierre de Liais du fond de Bagneux, de la carriere de Mad. Ricateau. | 20778 | 1 | 2 | 56 | 145 | 7 | 1 | 6 | ||
| Pierre de Liais du fond de Bagneux, de la carriere de M. Ory. | 23902 | 1 | 4 | 28 | 167 | 5 | 0 | 14 | ||
| Pierre des carrieres de Bouré. | 13864 | 0 | 7 | 14 | 97 | 1 | 6 | 10 | ||
| Pierre de Passy près Tonnerre. | 23340 | 1 | 4 | 7 | 163 | 6 | 0 | 46 | ||
| Spaths. | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Spath pesant, ou Sulfate de baryte. | Spath pesant blanc. | 44300 | 6 | 70 | 310 | 1 | 4 | 58 | ||
| Spath fluor, ou Fluate de chaux. | Spath fluor blanc. | 31555 | 2 | 0 | 26 | 220 | 14 | 1 | 20 | |
| Spath fluor rouge. | 31911 | 2 | 0 | 39 | 223 | 6 | 0 | 18 | ||
| Spath fluor vert. | 31817 | 2 | 0 | 36 | 222 | 11 | 2 | 17 | ||
| Spath fluor bleu. | 31688 | 2 | 0 | 31 | 221 | 13 | 0 | 32 | ||
| Spath fluor violet. | 31757 | 2 | 0 | 34 | 222 | 4 | 6 | 20 | ||
582
| Zéolite. | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Zéolite. | Zéolite étincelante rouge d'Œdelfors. | 24868 | 1 | 4 | 64 | 174 | 1 | 1 | 52 | |
| Zéolite étincelante blanche. | 20739 | 1 | 2 | 54 | 145 | 2 | 6 | 10 | ||
| Zéolite cristallisée. | 20833 | 1 | 2 | 58 | 145 | 13 | 2 | 26 | ||
| Peischtein ou Pierre de poix. | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Pierres de poix. | Pierre de poix noire. | 20499 | 1 | 2 | 45 | 143 | 7 | 7 | 7 | |
| Pierre de poix jaune. | 20860 | 1 | 2 | 59 | 146 | 0 | 2 | 40 | ||
| Pierre de poix rouge. | 26695 | 1 | 5 | 61 | 186 | 13 | 6 | 52 | ||
| Pierre de poix noirâtre. | 23191 | 1 | 4 | 2 | 162 | 5 | 3 | 10 | ||
| Pierres Mélangées. | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Porphire. | Porphire rouge. | 27651 | 1 | 6 | 24 | 193 | 8 | 7 | 21 | |
| Porphire rouge du Dauphiné. | 27933 | 1 | 6 | 35 | 195 | 8 | 3 | 70 | ||
| Serpentin. | Serpentin vert. | 28960 | 1 | 7 | 1 | 202 | 11 | 4 | 12 | |
| Serpentin noir dit variolite du Dauphiné. | 29339 | 1 | 7 | 15 | 205 | 5 | 7 | 54 | ||
| Serpentin vert du Dauphiné. | 29883 | 1 | 7 | 36 | 209 | 2 | 7 | 12 | ||
| Ophite. | . . . . . . . . . . . . . . . . . . . . . . . | 29722 | 1 | 7 | 30 | 208 | 0 | 6 | 66 | |
| Granitelle. | . . . . . . . . . . . . . . . . . . . . . . . | 30626 | 1 | 7 | 63 | 214 | 6 | 0 | 65 | |
| Granit. | Granit rouge d'Egypte. | 26541 | 1 | 5 | 55 | 185 | 12 | 4 | 53 | |
| Granit d'un beau rouge. | 27609 | 1 | 6 | 23 | 193 | 4 | 1 | 48 | ||
| Granit de la Vallée de Girardmas dans les Vosges. | 27163 | 1 | 6 | 6 | 190 | 2 | 2 | 3 | ||
583
| Pierres de volcans. | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Pierres de volcans. | Pierre-ponce. | 9145 | » | 4 | 53 | 64 | 0 | 1 | 66 | |
| Lave pleine de Volcans, dite Pierre obsidienne. | 23480 | 1 | 4 | 13 | 164 | 5 | 6 | 6 | ||
| Pierre de Volvic. | 23205 | 1 | 4 | 2 | 162 | 6 | 7 | 49 | ||
| Basalte de la chaussée des Géans. | 28642 | 1 | 6 | 61 | 200 | 7 | 7 | 17 | ||
| Basalte prismatique d'Auvergne. | 24215 | 1 | 4 | 40 | 169 | 8 | 0 | 46 | ||
| Basalte, dit pierre de touche. | 24153 | 1 | 4 | 38 | 169 | 1 | 1 | 6 | ||
| Vitrifications artificielles. | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Verres. | Laitier des forges. | 28548 | 1 | 6 | 58 | 199 | 13 | 3 | 1 | |
| Verre des bouteilles. | 27325 | 1 | 6 | 12 | 191 | 4 | 3 | 14 | ||
| Verre vert ou commun des vitres. | 26423 | 1 | 5 | 50 | 184 | 15 | 3 | 1 | ||
| Verre blanc ou cristal de France. | 28922 | 1 | 7 | 0 | 202 | 7 | 2 | 8 | ||
| Cristal des glaces de S. Gobin. | 24882 | 1 | 4 | 65 | 174 | 2 | 6 | 20 | ||
| Cristal d'Angleterre, dit Flint-glass. | 33293 | 2 | 1 | 19 | 233 | 0 | 6 | 38 | ||
| Verre de borax. | 26070 | 1 | 5 | 37 | 182 | 7 | 6 | 52 | ||
| Porcelaines. | Porcelaine dure du Roi, ou de Sèves. | 21457 | 1 | 3 | 9 | 150 | 3 | 1 | 34 | |
| Porcelaine de Limoges. | 23410 | 1 | 4 | 10 | 163 | 13 | 7 | 26 | ||
| Porcelaine de la Chine. | 23847 | 1 | 4 | 26 | 166 | 14 | 6 | 66 | ||
584
| Matières inflammables. | ||||||||||
| Noms des pierres. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Soufre. | Soufre natif. | 20332 | 1 | 2 | 39 | 142 | 5 | 1 | 34 | |
| Soufre fondu. | 19907 | 1 | 2 | 23 | 139 | 5 | 3 | 56 | ||
| Bitumes. | Charbon de terre compacte. | 13292 | 0 | 6 | 64 | 93 | 0 | 5 | 46 | |
| Ambre gris. | 9263 | 0 | 4 | 58 | 64 | 13 | 3 | 47 | ||
| Ambre jaune ou Succin transparent. | 10780 | 0 | 5 | 42 | 75 | 7 | 2 | 63 | ||
585
Table des Pesanteurs spécifiques des Fluides.
| Eaux. | ||||||||||
| Especes. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| on. | g. | grai. | liv. | on. | g. | gr. | ||||
| Eaux. | Eau distillée. | 10000 | 0 | 5 | 13 1/3 | 70 | 0 | 0 | 0 | |
| Eau de pluie. | 10000 | 0 | 5 | 13 1/3 | 70 | 0 | 0 | 0 | ||
| Eau de la Seine filtrée. | 10001,5 | 0 | 5 | 13,4 | 70 | 0 | 1 | 25 | ||
| Eau d'Arcueil. | 10004,6 | 0 | 5 | 13,5 | 70 | 0 | 4 | 9 | ||
| Eau de Ville-d'Avray. | 10004,3 | 0 | 5 | 13,5 | 70 | 0 | 3 | 61 | ||
| Eau de mer. | 10263 | 0 | 5 | 23 | 71 | 13 | 3 | 47 | ||
| Eau du lac Asphaltite, ou de la Mer morte. | 12403 | 0 | 6 | 31 | 86 | 13 | 1 | 6 | ||
| Liqueurs spiritueuses. | ||||||||||||
| Especes. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||||
| on. | g. | gra. | liv. | on. | g. | gr. | ||||||
| Vins. | Vin de Bourgogne. | 9915 | 0 | 5 | 10 | 69 | 6 | 3 | 60 | |||
| Vin de Bordeaux. | 9939 | 0 | 5 | 11 | 69 | 9 | 1 | 25 | ||||
| Vin de Malvoisie de Madère. | 10382 | 0 | 5 | 28 | 72 | 10 | 6 | 20 | ||||
| Bierre rouge. | 10338 | 0 | 5 | 26 | 72 | 5 | 6 | 61 | ||||
| Bierre blanche. | 10231 | 0 | 5 | 22 | 71 | 9 | 6 | 70 | ||||
| Cidre. | 10181 | 0 | 5 | 20 | 71 | 4 | 2 | 13 | ||||
| Esprit-de-vin, ou alkool. | Alkool du commerce. | 8371 | 0 | 4 | 25 | 68 | 9 | 3 | 30 | |||
| Alkool très-rectifié. | 8293 | 0 | 4 | 22 | 58 | 0 | 6 | 38 | ||||
| Alkool mêlé d'eau. | ||||||||||||
| Alkool. | Eau. | |||||||||||
| parties. | parties. | |||||||||||
| 15 | 1 | 8527 | 0 | 4 | 30 | 59 | 11 | 0 | 14 | |||
| 14 | 2 | 8674 | 0 | 4 | 36 | 60 | 11 | 4 | 3 | |||
| 13 | 3 | 8815 | 0 | 4 | 41 | 61 | 11 | 2 | 17 | |||
| 12 | 4 | 8947 | 0 | 4 | 46 | 62 | 10 | 0 | 37 | |||
| 11 | 5 | 9075 | 0 | 4 | 51 | 63 | 8 | 3 | 14 | |||
| 10 | 6 | 9199 | 0 | 4 | 55 | 64 | 6 | 2 | 22 | |||
| 9 | 7 | 9317 | 0 | 4 | 60 | 65 | 3 | 4 | 2 | |||
| 586 | 8 | 8 | 9427 | 0 | 4 | 64 | 65 | 15 | 6 | 43 | ||
| 7 | 9 | 9519 | 0 | 4 | 67 | 66 | 10 | 1 | 2 | |||
| 6 | 10 | 9598 | 0 | 4 | 70 | 67 | 2 | 7 | 58 | |||
| 5 | 11 | 9674 | 0 | 5 | 1 | 67 | 11 | 3 | 66 | |||
| 4 | 12 | 9733 | 0 | 5 | 3 | 68 | 2 | 0 | 55 | |||
| 3 | 13 | 9791 | 0 | 5 | 6 | 68 | 8 | 4 | 53 | |||
| 2 | 14 | 9852 | 0 | 5 | 8 | 68 | 15 | 3 | 28 | |||
| 1 | 15 | 9919 | 0 | 5 | 10 | 69 | 6 | 7 | 31 | |||
| Ethers. | Ether sulfurique. | 7396 | 0 | 3 | 60 | 51 | 12 | 2 | 59 | |||
| Ether nitrique. | 9088 | 0 | 4 | 51 | 63 | 9 | 6 | 61 | ||||
| Ether muriatique. | 7296 | 0 | 3 | 56 | 51 | 1 | 1 | 16 | ||||
| Ether acétique. | 8664 | 0 | 4 | 35 | 60 | 10 | 2 | 68 | ||||
| Liqueurs acides. | ||||||||||
| Especes. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| on. | g. | gr. | liv. | on. | g. | gr. | ||||
| Acides minéraux. | Acide sulfurique. | 18409 | 1 | 1 | 39 | 128 | 13 | 6 | 33 | |
| Acide nitrique. | 12715 | » | 6 | 43 | 89 | 0 | 0 | 46 | ||
| Acide muriatique. | 11940 | » | 6 | 14 | 83 | 9 | 2 | 17 | ||
| Acides végétaux. | Acide acéteux rouge. | 10251 | 0 | 5 | 23 | 71 | 12 | 0 | 65 | |
| Acide acéteux blanc. | 10135 | 0 | 5 | 18 | 70 | 15 | 0 | 69 | ||
| Acide acéteux distillé. | 10095 | 0 | 5 | 17 | 70 | 10 | 5 | 9 | ||
| Acide acétique. | 10626 | 0 | 5 | 37 | 74 | 6 | 0 | 65 | ||
| Acides animaux. | Acide formique. | 9942 | 0 | 5 | 11 | 69 | 9 | 6 | 2 | |
| Alkali volatil ou Ammoniaque. | |||||||||
| Especes. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | |||||
| on. | g. | gr. | livres. | on. | g. | gr. | |||
| Ammoniaque. | Ammoniaque en liqueur. | 8970 | 0 | 4 | 47 | 62 | 12 | 5 | 9 |
587
| Liqueurs huileuses. | ||||||||||
| Especes. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| on. | g. | gr. | livres. | on. | g. | gr. | ||||
| Huiles volatiles, ou essentielles. | Huile essentielle de térébenthine. | 8697 | 0 | 4 | 37 | 60 | 14 | 0 | 37 | |
| Térébenthine liquide. | 9910 | 0 | 5 | 10 | 69 | 5 | 7 | 26 | ||
| Huile essentielle de Lavande. | 8938 | 0 | 4 | 46 | 62 | 9 | 0 | 32 | ||
| Huile essentielle de Gérofle. | 10363 | 0 | 5 | 27 | 72 | 8 | 5 | 18 | ||
| Canelle. | 10439 | 0 | 5 | 30 | 73 | 1 | 1 | 25 | ||
| Huiles fixes, ou grasses. | Huile d'olives. | 9153 | 0 | 4 | 54 | 64 | 1 | 1 | 6 | |
| Huile d'amande douce. | 9170 | 0 | 4 | 54 | 64 | 3 | 0 | 23 | ||
| Huile de lin. | 9403 | 0 | 4 | 63 | 65 | 13 | 1 | 6 | ||
| Huile de pavot. | 9288 | 0 | 4 | 57 | 64 | 10 | 5 | 18 | ||
| Huile de faîne. | 9176 | 0 | 4 | 55 | 64 | 3 | 5 | 50 | ||
| Huile de baleine. | 9233 | 0 | 4 | 57 | 64 | 10 | 0 | 55 | ||
| Liqueurs animales. | ||||||||||
| Especes. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| on. | g. | gr. | livres. | on. | g. | gr. | ||||
| Liqueurs animales. | Lait de femme. | 10203 | 0 | 5 | 21 | 71 | 6 | 5 | 64 | |
| Lait de jument. | 10346 | 0 | 5 | 26 | 72 | 6 | 6 | 1 | ||
| Lait d'ânesse. | 10355 | 0 | 5 | 27 | 72 | 7 | 6 | 6 | ||
| Lait de chèvre. | 10341 | 0 | 5 | 26 | 72 | 6 | 1 | 39 | ||
| Lait de brebis. | 10409 | 0 | 5 | 29 | 72 | 13 | 6 | 33 | ||
| Lait de vache. | 10324 | 0 | 5 | 25 | 72 | 4 | 2 | 22 | ||
| Petit-lait de vache clarifié. | 10193 | 0 | 5 | 20 | 71 | 5 | 4 | 67 | ||
| Urine humaine. | 10106 | 0 | 5 | 17 | 70 | 1 | 6 | 70 | ||
588
Table des Pesanteurs spécifiques de quelques substances végétales & animales
| Especes. | Variétés. | Pesanteur spécifique. | Poids du pouce cube. | Poids du pied cube. | ||||||
| onc. | g. | gr. | livres. | on. | g. | gr. | ||||
| Résines. | Résines jaune ou blanche du pin. | 10727 | 5 | 40 | 75 | 1 | 3 | 28 | ||
| Arcançon | 10857 | 5 | 45 | 75 | 15 | 7 | 63 | |||
| Galipot. | 10819 | 5 | 54 | 75 | 11 | 5 | 59 | |||
| Baras. | 10441 | 5 | 30 | 73 | 1 | 3 | 10 | |||
| Sandaraque. | 10920 | 5 | 48 | 76 | 7 | 0 | 23 | |||
| Mastic. | 10742 | 5 | 41 | 75 | 3 | 0 | 60 | |||
| Storax. | 11098 | 5 | 54 | 77 | 10 | 7 | 58 | |||
| Résine ou gomme copale opaque. | 11398 | 5 | 28 | 72 | 12 | 4 | 44 | |||
| Gomme copale transparente. | 10452 | 5 | 30 | 73 | 2 | 4 | 71 | |||
| Gomme copale de Madagascar. | 10600 | 5 | 36 | 74 | 3 | 1 | 43 | |||
| Gomme copale de la Chine. | 10628 | 5 | 37 | 74 | 6 | 2 | 50 | |||
| Résine ou Gomme Elémi. | 10182 | 5 | 20 | 71 | 4 | 3 | 5 | |||
| Résine ou gomme animée d'Orient. | 10284 | 5 | 24 | 71 | 15 | 6 | 33 | |||
| Résine ou gomme animée d'Occident. | 10426 | 5 | 29 | 72 | 15 | 5 | 50 | |||
| Labdanum. | 11862 | 6 | 11 | 83 | 0 | 4 | 25 | |||
| Labdanum in tortis. | 24933 | 1 | 4 | 67 | 174 | 8 | 3 | 70 | ||
| Résine ou gomme de gayac. | 12289 | 6 | 27 | 86 | 0 | 2 | 68 | |||
| Résine de jalap. | 12185 | 6 | 23 | 85 | 4 | 5 | 55 | |||
| Sang-dragon. | 12045 | 6 | 18 | 84 | 5 | 0 | 23 | |||
| Résine ou gomme-laque. | 11390 | 5 | 65 | 79 | 11 | 5 | 32 | |||
| Résine tacamaque. | 10463 | 5 | 31 | 73 | 3 | 6 | 61 | |||
| Benjoin. | 10924 | 5 | 48 | 76 | 7 | 3 | 65 | |||
| Résine ou gomme alouchi. | 10604 | 5 | 36 | 74 | 3 | 5 | 13 | |||
| 589Résine ou gomme caragne. | 11244 | 5 | 60 | 78 | 11 | 2 | 45 | |||
| Résine ou gomme élastique. | 9335 | 4 | 61 | 65 | 5 | 4 | 12 | |||
| Camphre | 9887 | 5 | 9 | 69 | 3 | 2 | 54 | |||
| Gommes-résines. | Gomme ammoniaque. | 12071 | 6 | 19 | 84 | 7 | 7 | 44 | ||
| Gomme séraphique. | 12008 | 6 | 16 | 84 | 0 | 7 | 12 | |||
| Gomme de lierre, ou hédérée. | 12948 | 6 | 51 | 90 | 10 | 1 | 29 | |||
| Gomme gutte. | 12216 | 6 | 24 | 85 | 8 | 1 | 39 | |||
| Euphorbe. | 11244 | 6 | 60 | 78 | 11 | 2 | 45 | |||
| Oliban ou encens. | 11732 | 6 | 6 | 82 | 1 | 7 | 63 | |||
| Mirrhe. | 13600 | 7 | 4 | 95 | 3 | 1 | 43 | |||
| Bdelium. | 13717 | 5 | 65 | 79 | 10 | 1 | 57 | |||
| Scammonée d'Alep. | 12354 | 6 | 29 | 86 | 7 | 5 | 13 | |||
| Scammonée de Smyrne. | 12743 | 6 | 44 | 89 | 3 | 1 | 52 | |||
| Galbanum. | 12120 | 6 | 20 | 84 | 13 | 3 | 37 | |||
| Assa fœtida. | 13275 | 6 | 64 | 92 | 14 | 6 | 29 | |||
| Sarcocolle. | 12684 | 6 | 42 | 88 | 12 | 4 | 62 | |||
| Opopanax. | 16226 | 1 | 0 | 30 | 113 | 9 | 2 | 36 | ||
| Gommes. | Gomme commune, ou de Païs. | 14817 | 0 | 7 | 49 | 103 | 11 | 4 | 2 | |
| Gomme arabique. | 14523 | 7 | 38 | 101 | 10 | 4 | 44 | |||
| Gomme adraganthe. | 13161 | 6 | 59 | 92 | 2 | 0 | 18 | |||
| Gomme de Bassora. | 14346 | 7 | 32 | 100 | 6 | 6 | 1 | |||
| Gomme d'Acajou. | 14456 | 7 | 36 | 101 | 3 | 0 | 41 | |||
| Gomme monbain. | 14206 | 7 | 26 | 99 | 7 | 0 | 41 | |||
| Sucs épaissis. | Suc de réglisse. | 17228 | 1 | 0 | 67 | 120 | 9 | 4 | 21 | |
| Suc d'acacia. | 15153 | 7 | 62 | 106 | 1 | 1 | 6 | |||
| Suc d'arec. | 14573 | 7 | 40 | 102 | 0 | 1 | 29 | |||
| Cachou. | 13980 | 7 | 18 | 97 | 13 | 6 | 6 | |||
| Aloès hépatique. | 13586 | 7 | 3 | 95 | 1 | 5 | 4 | |||
| Aloès socotrin. | 13795 | 7 | 11 | 96 | 9 | 0 | 23 | |||
| 590Hypociste. | 15263 | 7 | 66 | 106 | 13 | 3 | 47 | |||
| Opium. | 13366 | 6 | 67 | 93 | 8 | 7 | 3 | |||
| Fécules. | Indigo. | 7690 | 0 | 3 | 71 | 53 | 13 | 2 | 17 | |
| Roucou. | 5956 | 0 | 3 | 6 | 41 | 11 | 0 | 41 | ||
| Cires & graisses. | Cire jaune. | 9648 | 5 | 0 | 67 | 8 | 4 | 44 | ||
| Cire blanche. | 9686 | 5 | 2 | 67 | 12 | 6 | 47 | |||
| Cire d'ouarouchi. | 8970 | 4 | 47 | 62 | 12 | 5 | 9 | |||
| Beurre de cacao. | 8916 | 4 | 45 | 62 | 6 | 4 | 53 | |||
| Blanc de baleine. | 9433 | 4 | 64 | 66 | 0 | 3 | 70 | |||
| Graisse de bœuf. | 9232 | 4 | 57 | 64 | 9 | 7 | 63 | |||
| Graisse de veau. | 9341 | 4 | 61 | 65 | 6 | 1 | 39 | |||
| Graisse de mouton. | 9235 | 4 | 57 | 64 | 10 | 2 | 40 | |||
| Suif. | 9419 | 4 | 64 | 65 | 14 | 7 | 31 | |||
| Graisse de cochon. | 9368 | 4 | 62 | 65 | 9 | 1 | 52 | |||
| Lard. | 9478 | 4 | 66 | 66 | 5 | 4 | 21 | |||
| Beurre. | 9423 | 4 | 64 | 65 | 15 | 3 | 1 | |||
| Bois. | Chêne de 60 ans: le cœur. | 11700 | 6 | 5 | 81 | 14 | 3 | 14 | ||
| Liège. | 2400 | 1 | 18 | 16 | 12 | 6 | 29 | |||
| Orme: le tronc. | 6710 | 3 | 35 | 46 | 15 | 4 | 12 | |||
| Fresne: le tronc. | 8450 | 4 | 27 | 59 | 2 | 3 | 14 | |||
| Hêtre. | 8520 | 4 | 30 | 59 | 10 | 1 | 66 | |||
| Aune. | 8000 | 4 | 11 | 56 | 0 | 0 | 0 | |||
| Erable. | 7550 | 3 | 66 | 52 | 13 | 4 | 58 | |||
| Noyer de France. | 6710 | 3 | 35 | 46 | 15 | 4 | 12 | |||
| Saule. | 5850 | 3 | 2 | 40 | 15 | 1 | 43 | |||
| Tilleul. | 6040 | 3 | 9 | 42 | 4 | 3 | 60 | |||
| Sapin mâle. | 5500 | 2 | 61 | 38 | 8 | 0 | 0 | |||
| Sapin femelle. | 4980 | 2 | 42 | 34 | 13 | 6 | 6 | |||
| Peuplier. | 3830 | 1 | 71 | 26 | 12 | 7 | 49 | |||
| Peuplier blanc d'Espagne. | 5294 | 2 | 54 | 37 | 0 | 7 | 31 | |||
| Pommier. | 7930 | 4 | 8 | 55 | 8 | 1 | 20 | |||
| Poirier. | 6610 | 3 | 31 | 46 | 4 | 2 | 40 | |||
| 591Coignassier. | 7050 | 3 | 47 | 49 | 5 | 4 | 58 | |||
| Nefflier. | 9440 | 4 | 64 | 66 | 1 | 2 | 17 | |||
| Prunier. | 7850 | 4 | 5 | 54 | 15 | 1 | 43 | |||
| Olivier. | 9270 | 4 | 58 | 64 | 14 | 1 | 66 | |||
| Cerisier. | 7150 | 3 | 51 | 50 | 0 | 6 | 29 | |||
| Coudrier ou noisetier. | 6000 | 3 | 8 | 42 | 0 | 0 | 0 | |||
| Buis de France. | 9120 | 4 | 52 | 63 | 13 | 3 | 37 | |||
| Buis de Hollande. | 13280 | 6 | 64 | 92 | 15 | 2 | 63 | |||
| If de Hollande. | 7880 | 4 | 6 | 55 | 2 | 4 | 35 | |||
| If d'Espagne. | 8070 | 4 | 13 | 56 | 7 | 6 | 52 | |||
| Cyprès d'Espagne. | 6440 | 3 | 24 | 45 | 1 | 2 | 17 | |||
| Thuya. | 5608 | 2 | 65 | 39 | 4 | 0 | 55 | |||
| Grenadier. | 13540 | 7 | 1 | 94 | 12 | 3 | 60 | |||
| Mûrier d'Espagne. | 8970 | 4 | 47 | 62 | 12 | 5 | 9 | |||
| Gayac. | 13330 | 6 | 66 | 93 | 4 | 7 | 49 | |||
| Oranger. | 7050 | 3 | 47 | 49 | 5 | 4 | 58 | |||
592
TABLE
DES MATIERES.
A
Acides. Ils résultent en général d'un premier ordre de combinaisons formées par la réunion de deux principes simples, 163.-Savoir, d'un radical particulier & d'un principe acidifiant commun à tous, l'oxigène, 69.-C'est, en général, le résultat de la combustion ou de l'oxigénation d'un corps, 70.-Leurs dénominations générales se tirent de celle de leur base acidifiable, 72.-Difficultés de les nommer lorsque les bases sont inconnues, 71 & 73.-Leurs noms se terminent en eux lorsqu'ils contiennent peu d'oxigène, 72.-Ils se terminent en ique, lorsqu'ils sont plus chargés de ce principe, ibid.-Ils peuvent être regardés comme de véritables principes salifians, 163.-Leurs combinaisons avec les bases salifiables, 189.-Leur nombre s'est beaucoup accru depuis les nouvelles découvertes chimiques, 209. Chaque acide nouveau enrichit la Chimie de 24 ou de 48 sels, 183.
Acide acéteux, vulgairement appelé vinaigre, 159.-Son radical est composé d'une proportion encore indéterminée d'hydrogène & de carbone, 159 & 160.-Il est le résultat de l'oxigénation du vin, ibid.-Il absorbe l'oxigène de l'air en se formant, ibid.-Tableau de ses combinaisons, 160.
— Acétique. Tableau de ses combinaisons, 298.-Appelé autrefois vinaigre radical. Dernier degré d'oxygénation, que puisse prendre le radical hydro-carboneux.-Il n'est pas encore démontré qu'il soit plus oxigéné que l'acide acéteux; il pourroit en différer par la différence de proportion des principes du radical.-Moyens de l'obtenir, 299.
— Animaux. On n'en connoît encore que six, 131.-Il paroît qu'ils se rapprochent beaucoup les uns des autres, 593 131.-Il entre ordinairement dans leur composition 4 bases acidifiables, 125.
Acide arsenique. Tableau de ses combinaisons, 269.-Enlève l'oxigène à l'acide nitrique, devient un véritable acide, soluble dans l'eau.-Se combine avec la potasse & avec un grand nombre de bases salifiables, 269, 270 & 271.-Plusieurs moyens de l'obtenir, 269, 270.
— Benzoïque. Tableau de ses combinaisons, 302.-On l'obtient par sublimation & par la voie humide.-Procédé pour l'obtenir.-On le recueille sous forme concrète, 303.
— Bombique. Tableau de ses combinaisons, 314.-Se tire de la chrysalide du ver à soie.-Moyen de l'obtenir. Ses propriétés & ses affinités ne sont pas bien déterminées.-Son radical paroît être composé de carbone, d'hydrogène & peut-être de phosphore, 313.
— Boracique. Combinaison du radical boracique avec l'oxigène, 229.-Tableau de ses combinaisons, 264.-Se tire du borax.-Sel sédatif des anciens, 265.-Moyens de l'obtenir du borax, 266.-Ses propriétés, ses affinités différentes selon qu'on opère par voie sèche ou par voie humide.-Son radical est inconnu.-Ce n'est que par analogie qu'on croit que l'oxigène fait partie de sa composition, 267.
— Camphorique. Tableau de ses combinaisons, 304.-Moyens de l'obtenir.-Il est très-analogue à l'acide oxalique.-Il peut être regardé comme un mêlange d'acide oxalique & d'acide malique, 305.
— Carbonique. Très-abondamment répandu dans la nature.-Tout formé dans les craies, les marbres, neutralisé par la chaux. Moyens de l'obtenir.-Il s'unit à l'eau à-peu-près à volume égal.-Le carbone est son radical.-On peut le former artificiellement en oxigénant le carbone, 251.-Sa formation dans la combustion des végétaux, 166.-Il emporte avec lui une portion de calorique qui le constitue dans l'état de gaz, ibid.-Il est un des produits de la fermentation vineuse, 139.-On le convertit en un acide végétal en lui combinant de l'hydrogène, 160.-Sa décomposition seroit bien importante pour les arts.-On peut y parvenir par les affinités doubles, 252;-Tableau de ses combinaisons, 251.
— Citrique. Tableau de ses combinaisons, 284.-On le tire du jus de citron; on le trouve dans beaucoup 594 d'autres fruits.-Moyens de l'obtenir pur, 285.
Acide Fluorique. Combinaison du radical fluorique avec l'oxigène, 229.-Tableau de ses combinaisons, 261.-Il est tout formé dans le spath fluor, spath phosphorique.-Moyens de le dégager de ses bases.-Il est naturellement sous forme de gaz.-Dissout le verre. On pourroit tenter de le décomposer par les affinités doubles, 263.
— Formique. Tableau de ses combinaisons, 312.-Il a été connu dans le siècle dernier.-Espèce de fourmi dont on le tire.-Moyens de l'obtenir, 313.
— Gallique. Tableau de ses combinaisons, 306.-Se tire de la noix de galle.-Moyen de l'obtenir.-Ses propriétés acides sont peu marquées. Il se trouve dans beaucoup de végétaux.-Son radical est inconnu, 307.
— Lactique. Tableau de ses combinaisons, 308.-Se trouve dans le petit lait. Procédés pour l'obtenir. S'unit avec toutes les bases salifiables.-Il a beaucoup de rapport avec l'acide acéteux, 309.
— Lithique. Tableau de ses combinaisons, 318.-Moyens de l'obtenir.-Ses propriétés sont peu connues.-Il pourroit bien être déjà combiné à une base & dans l'état de phosphate de chaux, 319.
Acide malique. Tableau de ses combinaisons, 280.-Se trouve tout formé dans le jus de pommes & d'autres fruits.-Moyen de l'obtenir. Il est mêlé avec l'acide citrique & tartareux dans beaucoup de fruits.-Tient le milieu entre l'acide oxalique & l'acide acéteux. Son radical contient du carbone & de l'hydrogène. On le forme artificiellement, 282, 283.
— Marin. Est naturellement dans l'état de gaz, au degré de pression de l'atmosphère, 94. Voy. Acide Muriatique.
— Marin oxigéné. S'obtient en distillant de l'acide marin sur des oxides métalliques, 257. Voy. Acide Muriatique oxigéné.
— Molybdique. Tableau de ses combinaisons.-Moyens de l'obtenir.-On le recueille sous forme pulvérulente de couleur blanche comme de la craie.-Il est toujours concret & peu soluble, 273.
— Muriatique. Combinaison du radical muriatique avec l'oxigène, 229.-Son nom dérivé de celui latin muria, 76.-Il est dans l'état de gaz au degré de pression & de température ordinaire, 74.-Se combine facilement avec l'eau, 76.-Il est très-répandu 595 dans le règne minéral, uni à différentes bases.-N'a été décomposé dans aucune expérience chimique.-Son radical est inconnu, 75 & 255.-Opinion sur sa nature, 255. Tient foiblement à ses bases.-Moyens de l'en séparer. Appareils pour la distillation, 246. On le surcharge d'oxigène, en le distillant sur des oxides métalliques, tels que le manganèse, 247.-Il est susceptible de différens genres d'oxigénation, 76.-L'excès d'oxigène le rend moins miscible à l'eau, 77; plus volatil, ibid.-Pourquoi on n'a pas donné à son nom la terminaison en eux, ibid.-Tableau de ses combinaisons, 253.
Acide muriatique oxigéné. Il est plus volatil que l'acide muriatique ordinaire, 77. Il ne peut exister que sous forme gazeuse.-N'est absorbable par l'eau qu'en petite quantité.-Se combine avec un grand nombre de bases salifiables.-Les sels qu'il forme détonnent avec le carbone.-Ces détonations sont dangereuses, par l'expansion du calorique, 257.-Il dissout les substances métalliques sans effervescence, 178.-Il perd son excès d'oxigène dans la dissolution des métaux & devient acide muriatique ordinaire, 178.-Tableau de ses combinaisons, 254.
Acide nitreux. Raisons de lui conserver ce nom; celui d'azotique lui conviendroit mieux, 79.-Se tire ordinairement du salpêtre, 77 & 233.-Moyens de l'obtenir, 234.-Il est le résultat de la combinaison de l'oxigène & de l'azote, 78 & 214.-C'est l'acide du nitre surchargé d'azote ou de gaz nitreux, 81.-Et par conséquent un véritable acide azoteux, 78.-Il est le premier dans lequel l'existence de l'oxigène ait été bien démontrée, ibid. Les principes qui le constituent tiennent peu ensemble, ibid. Il est rouge & fumant, 81.-Il laisse échapper son excès de gaz nitreux & une légère chaleur, ibid. Il est formé par la réunion de trois parties d'oxigène & d'une d'azote, 80.-Tableau de ses combinaisons, 233.
— Nitrique. Le gaz azote est son radical, 56.-C'est l'acide nitreux surchargé d'oxigène, 81.-Il est composé de 4 parties d'oxigène & une d'azote, ibid.-Il est blanc, sans couleur, plus fixe au feu que l'acide nitreux, ibid.-Se tire ordinairement du salpêtre, 233.-Moyens de l'obtenir, 234 & suiv.-Retient une grande partie du calorique 596 de l'oxigène qui est entré dans sa composition, 110. Le calorique s'en dégage avec fracas lors de sa décomposition, 112.-Peut servir à oxigéner beaucoup de substances par la voie humide, 207.-Il est uni très-souvent à la chaux & à la magnésie, 233.-Moyens de l'obtenir pur, 236.-Il a une grande tendance à la combinaison & se décompose lui-même aisément, 237. Tableau de ses combinaisons, 233.
Acide nitro-muriatique. Anciennement appelé eau régale.-C'est un acide à deux bases, 259, 260.-Il a des propriétés particulières qui dépendent de l'action combinée de ses deux bases acidifiables, 124 & 259. Les métaux s'oxident dans cet acide avant de s'y dissoudre.-Gaz qui se dégagent pendant la dissolution, 259.-Tableau de ses combinaisons, 259.
— Oxalique. Tableau de ses combinaisons, 292.-Il se retire du suc de l'oseille; il se trouve dans cette plante uni à la potasse, & dans l'état d'un sel neutre avec excès d'acide.-Moyen de le dégager de sa base.-Il cristallise lorsqu'il est pur. Uni à sa base peut entrer tout entier dans un grand nombre de combinaisons; il en résulte des sels à deux bases, 293, 294.
Acide phosphoreux. Combinaison du phosphore avec l'oxigène par une combustion lente, 248.-Se convertit en acide phosphorique par une longue exposition à l'air, 249.-Tableau de ses combinaisons, 246.
— Phosphorique. Produit par la combustion du phosphore dans le gaz oxigène, 59. Il est naturellement dans l'état concret après la combustion, 61, 104 & 248. Moyen de l'obtenir pur, 248.-Quantité d'oxigène qu'absorbe le phosphore dans sa conversion en acide, ibid.-Ne peut pas être regardé comme un acide animal, parce qu'il appartient aux trois règnes, 131. Tableau de ses combinaisons, 246.
— Prussique. Tableau de ses combinaisons, 320.-Uni au fer il le colore en bleu. Son radical est inconnu. C'est un acide à base double ou triple, dont l'azote est un des principes constituans, 320, 321, 322 & 415.-Il ne jouit même que d'une partie des propriétés acides, 321, 322.
— Pyro-ligneux. Tableau de ses combinaisons, 286.-Se retire du bois.-Moyens de l'obtenir pur.-Son radical est formé d'hydrogène & de carbone.-Il est le même de quelque 597 nature de bois qu'on le retire, 287.
Acide pyro-muqueux. Tableau de ses combinaisons, 290. On le retire de tous les corps sucrés par la distillation à feu nud.-Accidens à éviter.-Procédé pour le concentrer.-On le convertit en acide malique & en acide oxalique en l'oxigénant, 291.
— Pyro-tartareux. On le retire du tartre par distillation à feu nud.-Moyens pour l'obtenir.-Il se dégage pendant la distillation une grande quantité d'acide carbonique.-Explosion dans la rectification, 289.-Tableau de ses combinaisons, 288.
— Saccho-lactique. Tableau de ses combinaisons, 310. Extrait du sucre de petit-lait.-Son action sur les métaux peu connue.-Les sels qui résultent de sa combinaison avec les bases salifiables sont peu solubles, 311.
— Sébacique. Tableau de ses combinaisons, 316.-C'est la graisse animale oxigénée. Moyen de l'obtenir, 317.
— Succinique. Tableau de ses combinaisons, 300.-On le retire du succin.-Moyens de l'obtenir.-Il n'a pas dans un degré très-éminent les qualités acides, 301.
— Sulfureux. Premier degré d'oxigénation du soufre, 71 & 244.-Les métaux lorsqu'ils sont oxidés sont dissolubles dans cet acide, 244, 245.-On l'obtient par différens procédés, 244.-Il est dans l'état de gaz à la pression ordinaire de l'atmosphère.-Il se condense par le froid, 244. Tableau de ses combinaisons, 243.
Acide sulfurique. Il est formé par la combinaison du soufre & de l'oxigène, 66, 72 & 240.-Proportion d'oxigène qui entre dans sa combinaison, 241, 242.-Il est incombustible, 66.-Son poids est égal à celui du soufre qu'on a brûlé pour le former, & de l'oxigène qu'il a absorbé pendant la combustion, ibid. Difficulté de le condenser, ibid.-Il se combine avec l'eau en toutes proportions, 67.-On le trouve tout formé dans les argiles, les gypses.-Moyens de le ramener à l'état de soufre par voie de décomposition & d'affinité, 221.-Décompose le nitre, 78.-Les métaux le décomposent & le réduisent à l'état d'acide sulfureux, 242.-Tableau de ses combinaisons avec les bases salifiables, 238 & 239.
— Tartareux. Tableau de ses combinaisons.-Moyens de l'obtenir pur.-Son radical est en excès.-C'est par cette raison qu'on a donné à son nom la terminaison en eux. Sa base est le radical carbone-hydreux.-L'azote entre 598 dans sa composition.-En l'oxigénant on le change en acides malique, oxalique & acéteux, 278, 279 & 280.-On observe deux degrés de saturation dans ses combinaisons avec les alkalis.-Le premier degré avec excès d'acide; tartrite acidule de potasse.-Le second degré, sel parfaitement neutre; tartrite de potasse, 279, 280.
Acide tunstique. Tableau de ses combinaisons.-Se retire de la mine de tunstene, dans laquelle il est déjà sous forme d'acide.-Moyens de l'obtenir.-Ses affinités avec les acides métalliques ne sont pas déterminées, 275, 276.
— Végétaux.-On en connoît 13 jusqu'à présent, 129.-Leur composition est connue, mais la proportion des principes qui les constituent ne l'est pas encore, 127 & 161.-Ils ont tous pour base l'hydrogène, le carbone & quelquefois le phosphore, 124, 197, 198.-Ils ne diffèrent entr'eux que par la proportion d'hydrogène & de carbone, & par leur degré d'oxigénation, 126.-Quoique composés d'hydrogène & de carbone, ne contiennent cependant ni eau, ni acide carbonique; mais les principes propres à les former, 130.-Peuvent se convertir les uns dans les autres, en changeant la proportion de leurs principes constituans, 210.
Affinités. Les données manquent encore pour entreprendre un traité complet sur cet objet, Discours préliminaire, xiij & xiv.-Il s'en exerce de doubles & triples dans la décomposition des végétaux, 135.-Elles sont très-compliquées dans la putréfaction, 153.
Agens chimiques. Ce que c'est, 422.
Air atmosphérique composé de deux fluides élastiques, l'un respirable & l'autre qui ne l'est pas, 39 & 54.-Observations sur les expériences analytiques, relatives à l'air atmosphérique, 48 & suiv.-Sa décomposition par le mercure, 34 & suiv. N'est plus respirable après la calcination du mercure, 37.-Est décomposé par le fer, 40.-Diminue d'une quantité en poids égale à l'augmentation que le fer acquiert dans sa calcination, 47.-Est décomposé par le gaz nitreux, 80.-Par la combustion du soufre, 66. Voy. Atmosphère.
— Fixe. Premier nom de l'acide carbonique, 68. Voy. Acide carbonique.
— Vital. Voy. Gaz oxigène.
Alkali de la soude se retire de la lexiviation des cendres des plantes qui croissent au bord de la mer, principalement du kali, 169.-On ne 599 connoît pas ses principes constituans, 170.-On ne sait pas si cette substance est toute formée dans les végétaux antérieurement à la combustion, ibid.-Elle est presque toujours saturée d'acide carbonique, 169.-Ses cristaux s'effleurissent à l'air & y perdent leur eau de cristallisation, ibid.
Alkali fixe, ou Potasse. C'est un résultat de la combustion des végétaux, 166.-Moyens de l'obtenir, 167.-On ne connoît pas les principes constituans, 170.-L'analogie pourroit porter à croire que l'azote est un des principes constituans des alkalis en général, ibid.-Se volatilise très-promptement au feu alimenté par le gaz oxigène, 556.
Alkool. Raisons qui ont fait adopter ce nom générique pour toutes les liqueurs spiritueuses, 140.-Il est composé de carbone & d'hydrogène, 150.-L'hydrogène & le carbone ne sont pas dans l'état d'huile dans cette combinaison, ibid.-Se décompose en passant à travers un tube de verre rougi au feu, ibid.-Appareil pour sa combustion, 501.
Alliages. Combinaison des métaux les uns avec les autres, 116.-Celui des mentaux qui prédomine donne le nom à l'alliage.-Les alliages ont leur degré de saturation très-marqué, 230.
Alumine. C'est principalement dans les argiles qu'on la rencontre, 173.-La composition de cette terre est absolument inconnue, 172.-Elle a moins de tendance à la combinaison que les autres terres, 173.-Est parfaitement fusible au feu alimenté par le gaz oxigène, 555.-Son état après la combustion, ibid.
Amalgamme. Combinaison du mercure avec les autres métaux, 117.
Amidon. Oxide végétal à deux bases, 125.
Ammoniaque. Résultat de la combinaison de l'azote & de l'hydrogène, 79 & 155.-Sur 1000 parties elle est composée de 807 d'azote & de 193 d'hydrogène, 171.-Moyens de l'amener à un grand degré de pureté, ibid.-Lorsqu'elle est très-pure, elle ne peut exister que sous forme gazeuse, ibid.-Dans l'état aériforme elle porte le nom de gaz ammoniac, 172.-Dans cet état l'eau en absorbe une grande quantité, 171.
Appareils chimiques. Raisons qui ont déterminé à en placer la description à la fin de l'ouvrage, 324.
— Pneumato-chimiques à l'eau & au mercure. Leur description, 342 & suiv.
Argent se volatilise lentement au feu alimenté par 600 le gaz, oxigène, 556.
Arsenic est susceptible de s'oxigéner.-Dans cet état il a la propriété de s'unir aux bases salifiables, 269 & suiv.
Atmosphere terrestre. Sa constitution, 17, 28 & suiv. Son analyse, 33.-Composée de tous les fluides susceptibles d'exister dans un état de vapeurs & d'élasticité constante au degré habituel de chaleur & de pression que nous éprouvons, 31.-Sa pression est un obstacle à la vaporisation, 29.-Quelles sont ses parties constituantes, 51.-Sa limite, 29. Voy. Air atmosphérique, Gaz oxigène, Gaz azote.
Attraction tend à réunir les molécules des corps, tandis que le calorique tend à les écarter, 3.
Aurores boréales. Conjectures sur les causes qui les produisent, 32.
Azote. C'est la partie non respirable de l'air, 79.-C'est un des principes le plus abondamment répandu dans la nature, 213.-Avec le calorique il forme le gaz azote qui demeure toujours dans l'état de gaz à la pression de l'atmosphère, 213.-Combiné avec l'oxigène, il forme les acides nitreux & nitrique, 79, 214 & 235.-Se trouve dans les substances végétales & animales, 135 & 198.-Sur-tout dans les matieres animales dont il forme un des principes, 213.-Combiné avec l'hydrogène, il forme l'ammoniaque, 79, 214.-Dans la décomposition des végétaux & des matieres animales, il s'unit à l'hydrogène pour former l'ammoniaque, 136, 155.-C'est un des principes constituans de l'acide prussique, 215.-Ses combinaisons avec les substances simples sont peu connues. Elles portent le nom d'azotures, 214.
B
Balances. Instrumens dont l'objet est de déterminer le poids absolu des corps.-Combien il en faut dans un laboratoire.-De leur perfection.-Des précautions pour les conserver, 333 & suiv.
— Hydrostatique. Moyen de s'en servir.-Ses usages, 336, 337.
Baromètre. Corrections barométriques du volume des gaz, relativement à la différence de pression de l'atmosphère, 371 & suiv.-Modèle de calcul pour ces corrections, 380 & suiv.
Bases salifiables. Il en existe 24; savoir, 3 alkalis, 4 terres, & 17 substances métalliques, 182.
Baryte. La composition de cette terre est encore inconnue, 172.-Il est probable que c'est un oxide métallique, 601 174.-Mais qui n'est pas réductible par les moyens que nous employons, ibid. Elle est peu abondante; on ne la trouve que dans le règne minéral, 173.-Effet que produit sur elle le feu le plus violent, alimenté par le gaz oxigène.
Borax. Sel concret avec excès de base qui est la soude. Son origine est inconnue. Sa purification est encore un mystère, 265, 266.
Bougie. Sa combustion, 112.
C
Calcul de la vessie fournit l'acide lithique, 319.
Calorimètre. Sa description, 387 & suiv.-Principes de sa construction, ibid. Manière de s'en servir, 396 & suiv.
Calorique. Cause de la chaleur, 5.-Peut être considéré d'une manière abstraite, 6.-Comment il agit sur les corps, 6, 7.-Paroit être le plus élastique de la nature, 24.-Tous les corps y sont plongés, & il remplit les intervalles que laissent entr'elles leurs molécules.-Il se fixe quelquefois de manière à constituer leurs parties solides.-C'est de son accumulation que dépend l'état aériforme, 200.-Il fait l'office de dissolvant dans toute espèce de gaz, 17.-On appelle du nom générique de gaz toute substance portée à l'état aériforme par une addition suffisante de calorique, 200.-Le soufre & le charbon en brûlant lui enlevent l'oxigène, 66.-Il en est de même du gaz hydrogène, 95.-Moyen de mesurer la quantité qui s'en dégage des corps pendant leur combustion, 23, 103 & suiv.-Appareil imaginé pour remplir cet objet, 387.-Plan d'expériences pour déterminer la quantité que la plupart des corps en contiennent, 115.-Son dégagement dans la combustion du fer, 41.-Dans la combinaison des métaux avec la base du gaz oxigène, 82.-Dans la combustion du charbon, 66 & 108.-Dans la combustion du phosphore, 107.-Dans la combustion de la cire, 113.-Dans la combustion de l'huile d'olives, ibid.-Dans la combustion du gaz hydrogène, 109.-Il reste uni à l'oxigène, dans la formation de l'acide nitrique, 110.-Il entre dans la composition des nitrates & des muriates, en quantité presqu'égale à celle qui est nécessaire pour constituer le gaz oxigène, 207.-Il se dégage avec une telle abondance dans la combinaison de l'oxigène avec les corps combustibles, que rien ne peut résister à son expansion, 207.-Il 602 décompose les substances végétales & animales, 132.
Calorique combiné. Tient aux corps par l'attraction & constitue une partie de leur substance, 21.
— Libre. C'est celui qui n'est engagé dans aucune combinaison, 21.
— Spécifique des corps. C'est le rapport des quantités de calorique, nécessaires pour élever d'un même nombre de degrés, la température de plusieurs corps égaux en poids, 21.
Camphre. Espèce d'huile concrète qu'on retire par sublimation d'un laurier du Japon, 305.
Capsules de porcelaine, servent de support aux substances dans la fusion par le gaz oxigène, 555.
Carbone ou charbon pur. Substance simple combustible, 67 & 227.-Manière d'opérer sa combustion, 67.-Décompose le gaz oxigène à une certaine température, 67,133, 227 & 228;-appareil pour sa combustion, 483 & suiv.-Quantité de calorique qui se dégage dans cette opération, 67, 108.-Enlève sa base au calorique, 67.-Décompose l'eau à une chaleur rouge & enlève l'oxigène à l'hydrogène, 91, 218.-Il s'en dissout une portion dans le gaz hydrogène, 92 & 118. Il est contenu dans le fer & dans l'acier, 48.-Il existe dans les végétaux antérieurement à la combustion, & forme avec le phosphore, l'hydrogène & l'azote, des radicaux composés, 227.-Moyens d'obtenir celui qui est contenu dans les matières végétales & animales, 227 & 228.-Ses combinaisons avec les substances simples, 224.-Il a très-peu d'affinité avec le calorique, 133.-Il forme une des parties constituantes des huiles, 119.-Et en général de tous les acide végétaux, 124.-Il tient très-peu aux huiles volatiles animales, 136.-Il fait partie du radical des gommes, du sucre & de l'amidon, 125.-Il est combiné dans ces substances avec l'hydrogène, de manière à ne former qu'une seule base portée à l'état d'oxide par une portion d'oxigène, 126.-Quantité qu'en contient le sucre, 142.
Carbures, nom donné aux combinaisons du carbone avec les métaux, 118.
Cendres, elles forment ordinairement la vingtième portion du poids d'un végétal brûlé, 166.-Il paroît qu'elles existent dans les végétaux avant leur incinération. C'est la terre qui forme la partie osseuse ou la carcasse des végétaux, 168.
Chaleur dilate les corps, 1. 603-Ses causes.-Nécessaire à l'oxigénation.-Différente pour l'oxigénation des différens corps, 203 & suiv.-Ce qu'on entend par cette expression, 133. Voy. Calorique.
Chaleur sensible. N'est que l'effet produit sur nos organes par le dégagement du calorique des corps environnans, 22.
Charbon de bois. L'on croit qu'il contient du phosphore, 225.-Sert de support aux substances simples fondues au feu alimenté par le gaz oxigène, 554.
Chaux. C'est de toutes les bases salifiables la plus abondamment répandue dans la nature, 172.-Sa composition est absolument inconnue, ibid.-Elle est presque toujours saturée d'acide carbonique, & forme alors la craie, les spaths calcaires & une partie des marbres, ibid.-Les anciens ont appelé de ce nom générique, toutes les substances long-tems exposées au feu sans se fondre, 83.-Effet que produit sur elle le feu le plus violent alimenté par le gaz oxigène, 555.
Chrysolyte. Se fond presque sur le champ au feu alimenté par le gaz oxigène, 557.
Cire. Quantité de calorique qui se dégage pendant sa combustion, 113.
Clarification. Moyen pour mettre une liqueur en état d'être filtrée, 417.
Cloches. Manière de les graduer, 362, 363.
Combustion du fer, 41 & suiv.-Du phosphore, 57 & suiv.-Du soufre.-Du charbon, 67 & suiv.-Du gaz hydrogène, 97 & suiv. Voyez ces mots.-Théorie de la combustion des végétaux, 165.-La plus grande portion du végétal est réduite en eau & en acide carbonique, 166.-Opérations relatives à la combustion, 478 & suiv.-Conditions nécessaires pour l'opérer, 480 & suiv.
Creusets, instrumens propres à la fusion, 335.
Cristal de roche. Effet que produit sur lui le feu le plus violent alimenté par le gaz oxigène, 555.
Cristallisation. Opération par laquelle les parties intégrantes d'un corps qui étoient séparées par un fluide, sont réunies par la force d'attraction, 437.-Calorique qui se dégage pendant cette opération, ibid.-Vaisseaux dans lesquels on l'opère, 441 & 442.
D
Décantation. Peut suppléer à la filtration, 419.-Elle est préférable dans les opérations qui exigent une 604 précision rigoureuse, 420.
Détonnation. Explication de ses phénomènes, 526 & suiv.-Ils sont produits par le passage brusque & instantané d'une substance concrète à l'état aériforme, 525.-Expériences sur celle du salpêtre, 529 & suiv.
Diamant, se brûle à la manière des corps combustibles, & s'évapore au feu alimenté par le gaz oxigène, 557.
Dissolutions métalliques. Appareils pour les opérer, 460 & suiv.
Distillation composée. Elle opère une véritable décomposition.-C'est une des opérations des plus compliquées de la Chimie.-Appareils pour cet objet, 449 & suiv.
— Simple. N'est autre chose qu'une évaporation en vaisseaux clos.-Appareils distillatoires, 443 & suiv.
E
Eau. Ses différens états selon la quantité de calorique qui lui est combinée, 4 & 54.-Se transforme en un fluide élastique à un degré de chaleur supérieur à celui de l'ébullition, 15.-Se dissout dans les gaz, 50.-Regardée par les anciens comme un élément ou substance simple, 87.-Preuves qu'elle est composée, 100.-D'un radical qui lui est propre & d'oxigène, 94.-Son passage à travers un tube de verre incandescent, 89.-Appareil pour sa décomposition, 465 & suiv.-Sa décomposition par le carbone, 87 & 90.-Sa décomposition par le fer; il n'y a pas de dégagement d'acide carbonique, 87, 92 & 98.-Oxide de fer qui en résulte, 93.-Phénomènes de la fermentation spiritueuse & de la putréfaction dus à la décomposition de l'eau, 101.-Cette décomposition s'opère continuellement dans la nature, 100.-Les principes qui la constituent séparés l'un de l'autre ne peuvent exister que sous forme de gaz, ibid.-Sa recomposition, 96 & suiv. 506 & suiv.-85 Parties en poids d'oxigène & 15 en poids d'hydrogène, composent 100 parties d'eau, 100.-Se combine avec le gaz acide carbonique, 67.-Se combine en toutes proportions avec l'acide sulfurique, ibid.-Avec l'acide muriatique très-facilement, 75.-N'est pas toute formée dans le sucre, 150.
Eau régale. Nom ancien donné à un acide composé qui dissout l'or, 124. Voy. Acide nitro-muriatique.
Ebullition, n'est autre chose que la vaporisation d'un fluide ou sa combinaison 605 avec le calorique, 12.
Effervescence, est produite par le passage rapide d'un corps solide ou liquide à l'état gazeux, 177.
Elasticité. Comment on doit la concevoir, 25 & suiv.
Emeraude, fond sur le champ en un verre opaque au feu alimenté par le gaz oxigène, 557.
Ether, seroit habituellement dans l'état aériforme sans la pression de l'atmosphère, 9.-Se vaporise à 33 degrés, 13 & suiv.-Appareil pour sa combustion, 503 & suiv.
Evaporation. Opération pour séparer deux substances qui ont un degré de volatilité différent, 431 & suiv.-Action du calorique dans cette opération, 433.
F
Fer. Il décompose l'air atmosphérique, 41.-Il augmente de poids dans la calcination d'une quantité égale à celle que l'air a perdue, 47.-Appareil pour son oxidation, 519.-Sa combustion dans le gaz oxigène, 41.-Il décompose l'eau & s'oxide à un degré de chaleur rouge, 92, 93 & 218.-Il est moins attirable à l'aimant après qu'il a décomposé l'eau; c'est de l'oxide noir de fer, 42 & 93.-Ce métal contient de la matière charbonneuse, 48.
Fermentation acéteuse. C'est l'acidification du vin à l'air libre par l'absorption de l'oxigène, 159.
— Putride, s'opère en raison d'affinités très-compliquées, 153.-Appareil relatif à cette opération, 461 & suiv.-L'hydrogène se dégage sous la forme de gaz pendant la décomposition des substances animales, 154.-Il se forme des combinaisons binaires, 153.
— Vineuse. Moyens de l'exciter, 139.-Moyen d'analyse des substances susceptibles de fermenter, 151.-Description des appareils relatifs à cette opération, 461 & suiv.-Ses résultats & ses effets, 150 & suiv.-Détail de ce qui se passe dans la décomposition du sucre, 149.
Filtration. C'est un tamisage qui ne laisse passer que les parties liquides, 413.
Filtres. De leur choix & des moyens de s'en servir, 412 & suiv.
Fluides élastiques. Sont une modification des corps, 11.-Il s'absorbe du calorique dans leur formation, ibid.-S'obtiennent à un degré de chaleur déterminé, 12.-Leurs noms génériques & particuliers, 54.
Fourmis. Espèce qui fournit l'acide formique, 313.
606
Fourneaux. De leur construction, 537 & suiv.-Des fourneaux de fusion, 543 & suiv.-Leur objet, ibid.-Principes de leur construction, 547 & suiv.-Moyen de faire passer à travers un courant de gaz oxigène, 577 & suiv.
— de Coupelle. Sa description, 550 & suiv.-Son objet 545.-Sa construction est vicieuse, 551.-Moyens qu'a employés M. Sage pour y suppléer, 551 & 552.
Fusion. C'est une véritable solution par le feu, 534.-Description de l'appareil pour l'opérer à l'aide du gaz oxigène, 552 & suiv.
G
Gaz. Explication de ce mot, 17.-C'est le nom générique par lequel on désigne une substance quelconque, assez imprégnée de calorique pour passer de l'état liquide à l'état aériforme, 53, 54 & 200.-Ils dissolvent l'eau, 50.-Manière d'en mesurer le poids & le volume, 360 & suiv. 384 & suiv.-Moyens de les séparer les uns des autres, 365 & suiv.-De la correction à faire à leur volume, relativement à la pression de l'atmosphère, 370 & suiv.-Et aux degrés du thermomètre, 378.
— Aqueux. Eau combinée avec le calorique, 54.
Gaz acide carbonique, formé par la combustion du charbon dans le gaz oxygène, 67.-Est susceptible d'être absorbé par l'eau, 67.-Ne se condense pas au degré de pression de l'atmosphère, ibid.-De tous les gaz c'est celui qui dissout le plus d'eau, 50.-S'unit à toutes les bases susceptibles de former des sels neutres, 67.-Provenant de la décomposition de l'eau par le charbon, 91.
— Acide muriatique. Moyens de le dégager, 74.
— Azote. Fait partie de l'air atmosphérique, 39 & 203.-Plusieurs manières de l'obtenir, 214, 215.-Sa pesanteur, 55.-Ses propriétés chimiques ne sont pas encore bien connues, ibid.-Il prive de la vie les animaux qui le respirent, 56.-L'azote entre dans la composition de l'acide nitrique, ibid.-Dans celle de l'ammoniaque, ibid.
— Hépatique. C'est le gaz hydrogène sulfuré, 118.
— Hydrogène est formé par l'union du calorique & de l'hydrogène, 94 & 217.-C'est le radical constitutif de l'eau, 94.-On l'obtient en présentant à l'eau un corps pour lequel l'oxigène ait plus d'affinité; l'hydrogène s'unit au calorique pour le former, 217.-Se dégage dans la décomposition de l'eau par le fer, 93.-Et dans 607 celle de l'eau par le charbon, 91.-Moyens de l'obtenir pur, 98.-Sa pesanteur, 95.-Ne peut se condenser au degré de pression de l'atmosphère, 99.-Enleve l'oxigène au calorique & décompose l'air dans la combustion, 95.-Sa combustion avec le gaz oxigène s'opère instantanément & avec explosion.--Précautions qu'exige cette expérience, 96.-Appareil pour sa combustion en grand, 506 & suiv.-Quantité de calorique qui se dégage pendant sa combustion, 109.-Dans la combustion des végétaux il s'allume par le contact de l'air & produit la flamme, 166.-Il n'est pas absorbable par l'eau, 95.-Il se combine avec tous les corps combustibles, 156.-Il dissout le carbone, 118.-Le phosphore, ibid.-Le soufre, ibid.-Les métaux, ibid.-Dénomination qu'il prend alors, ibid.-On en obtient d'autant moins qu'on a pris plus de précautions pour écarter l'eau dans les expériences sur les métaux, 122.
Gaz hydrogène carboné. Résultat de la combinaison du gaz hydrogène avec le carbone, 156.
— Hydrogène phosphoré. Résultat de la combinaison du gaz hydrogène avec le phosphore, 156 & 225.-S'enflamme spontanément lorsqu'il a le contact de l'air, 119.-Il a l'odeur du poisson pourri, ibid.-Et il s'exhale vraisemblablement de la chair des poissons en putréfaction, ibid.
Gaz hydrogène sulfuré. Résultat de la combinaison du gaz hydrogène avec le soufre, 156.-C'est à son émanation que les déjections animales doivent leur odeur infecte, 119.
— Inflammable. Voy. Gaz hydrogène.
— Nitro-muriatique. Se dégage pendant la dissolution de l'or dans l'acide nitro-muriatique.-N'a pas encore été décrit.-Son odeur est désagréable.-Il est funeste aux animaux qui le respirent.-L'eau en absorbe une grande quantité, 259.
— Nitreux. Premier degré de combinaison de l'azote avec l'oxigène, 80.-C'est une espece d'oxide d'azote, 81.-Proportions d'azote & d'oxigène qui le constituent, 80.-Surchargé d'oxigène, compose un acide très-puissant, l'acide nitrique, ibid.-Enleve l'oxigène à l'air de l'atmosphère, ibid.-Sert d'eudiomètre pour connoître la quantité d'oxigène contenue dans l'air atmosphérique, ibid.-Il est immiscible à l'eau, ibid.
— Oxigène. Combinaison de l'oxigène avec le calorique, 608 55.-Moyen de s'assurer s'il ne contient point d'acide carbonique, 98.-Le calorique & la lumière qui se dégagent dans la combustion sont-ils fournis par le corps qui brûle, ou par le gaz oxigène qui se fixe dans les opérations? 219.-Est décomposé par le charbon, 67.-Par le phosphore, 58 & suiv.-Perd son calorique dans cette combinaison, 60.-Sa décomposition par les métaux, 82.-Par le fer 41.-Par le soufre, 66.-Entre dans la décomposition de l'air atmosphérique, 55.-Retiré de l'oxide de mercure, 523.-Retiré de l'oxide de manganèse ou du nitrate de potasse, 524.-Change de nature par la détonnation avec le charbon, & se convertit en acide carbonique, 525.-Moyen de s'en servir pour augmenter l'intensité du feu, 552.-Son emploi dans les fusions, ibid.
Gazomètre. Instrument propre à mesurer le volume des substances aériformes, 342.-Sa description, 346 & suiv.-Sa graduation, 358 & suiv.-Expériences qui ont donné l'idée de sa construction, 553.-On peut avec cet instrument donner un grand degré de vîtesse au gaz oxigène, 553;-& l'employer à augmenter l'action du feu, 553 & suiv.
Gazomètrie. C'est l'art de mesurer le poids & le volume des substances aériformes, 342.
Gommes. Oxides végétaux à deux bases, 125.-Réunies sous le nom générique de muqueux, ibid.
Graisse animale. Formée par la partie musculaire de cadavres enterrés à une certaine profondeur & privés du contact de l'air, 157.-Le suif fournit l'acide sébacique, 317.
Grenat. Fond presque sur le champ au feu alimenté par le gaz oxigène, 557.
H
Huiles. Elles sont composées de carbone & d'hydrogène, 119.-Ce sont de véritables radicaux carbone-hydreux, 198.-Proportion des principes qui les constituent, 120.-Sont-elles base ou radical des acides végétaux & animaux.-Raisons qui font pencher pour la négative, 211.-Appareil pour leur combustion, 493 & suiv.-Se convertissent en brûlant en acide carbonique & en eau, 120.
— d'Olives. Quantité de calorique qui s'en dégage, 113.
— Fixes. Contiennent un excès de carbone, 119.-Elles le perdent à un degré de chaleur supérieur à l'eau bouillante, 119.
609
Huiles volatiles. Elles sont formées par une juste proportion d'hydrogène & de carbone, 119.-A un degré supérieur à l'eau bouillante, elles se combinent au calorique pour former un gaz; c'est dans cet état qu'elles passent dans la distillation, 120.
— Volatiles animales. Le carbone y tient si peu qu'il s'en sépare par leur simple exposition à l'air libre, 136 & 137.-Il se sépare encore plus promptement quand on les expose dans le gaz oxigène, & l'huile devient noire; en même tems il se forme de l'eau, 137.-Elles redeviennent blanches par la rectification & le charbon s'en sépare, 136.-Elles se décomposent & se convertissent entièrement en charbon & en eau par des rectifications répétées, 136 & 137.
Hyacinthe. Perd sa couleur au feu alimenté par le gaz oxigène, 556 & 557.
Hydrogène. Est un des principes de l'eau, 217.-Son existence & ses propriétés ne sont connues que depuis peu de tems.-C'est un des principes les plus répandus dans la nature.-Il joue le principal rôle dans le règne animal & végétal, 217.-Son affinité avec le calorique est telle qu'il est toujours dans l'état de gaz.-Il est impossible de l'obtenir seul sous forme concrète, 217 & suiv.-On l'obtient dans l'état de gaz en décomposant l'eau par le fer & par le carbone, 218.-Sa combinaison avec le phosphore, 225.-Avec l'oxigène, 217.-Est-il susceptible de se combiner avec les corps simples dans l'état concret? 121.-Ce ne peut être qu'en très-petite quantité, ibid.-Il est un des principes constitutifs des huiles, & du radical de tous les acides végétaux & animaux, 119.-De l'amidon, des gommes, du sucre, 125.-Quantité qu'en contient le sucre, 142.-Quelques chimistes ont supposé que c'étoit le phlogistique de Stahl.-Ils ne le prouvent point.-Ils n'expliquent pas les phénomènes de la calcination & de la combustion, 219.
I
Instrumens propres à déterminer le poids absolu & la pesanteur spécifique des corps, 327 & suiv.-Description de la machine qui sert à les comparer. Elle se nomme balance. L'action se nomme pesée. Variation de l'unité d'un pays à l'autre.-De la nécessité de n'employer que des poids dont on connoît les rapports entre eux, 327 & suiv.
610
L
Lampe d'émailleur. Sert d'intermédiaire, dans la fusion par le gaz oxigène, pour les substances composées qui ont de l'affinité avec le charbon, 554.
Lavage. Moyen de diviser les corps en poudres de grosseurs uniformes, 420.
Lexiviation. Opération dont l'objet est de séparer les substances solubles dans l'eau de celles qui ne le sont pas, 428 & suiv.
Limes. Servent à diviser les matières soit malléables, soit fibreuses, 408.
Limphe. Oxide animal, 130.
Lumière. Qualités qui lui sont communes avec le calorique, 6.-Nécessaire aux animaux comme aux végétaux.-Il n'existe d'êtres organisés que dans les lieux exposés à la lumière, 202.-Son dégagement dans la combustion du fer, 41.-Sa manière d'agir sur les corps est inconnue.-Elle contribue avec le calorique à constituer l'oxigène dans l'état de gaz.-Se combine avec quelques parties des plantes; c'est à cette combinaison qu'est due la couleur verte des feuilles, 201.
Luts, (préparation des) 468.-Résineux.-Gras.-De chaux & de blanc d'œufs, 469, 470 & suiv.-Leur emploi, 475 & suiv.-Moyens d'y suppléer, 477.-Pour enduire les cornues, 541.
M
Magnésie. La composition de cette terre est absolument inconnue, 172.-On la trouve dans l'eau de la mer, 173.-Et dans un grand nombre d'eaux minérales, 173.-Effet que produit sur elle le feu le plus violent, alimenté par le gaz oxigène, 555.
Matières fécales sont composées de carbone & d'hydrogène, 157.-Produisent de l'huile par la distillation, ibid.
Mercure. Appareil pour son oxidation, 35, 507 & suiv.-Absorbe dans cette opération la partie respirable de l'air, 38.-Ne l'absorbe pas en entier, 40.
Métaux. Sont susceptibles de se combiner les uns avec les autres, 116.-Ne sont pas dissolubles dans les acides; il faut qu'ils ayent été portés auparavant à l'état d'oxides, 176.
Miroirs concaves. Ont un plus grand degré d'intensité que les verres ardens.-La difficulté de s'en servir rend impossibles un grand nombre des expériences chimiques, 553.
Mophète. Voy. Azote & Gaz Azote.
Molécules élémentaires des 611 corps ne se touchent point, 3.
Molybdène. Substance métallique qui a la propriété de s'oxigèner & de former un véritable acide.-La nature nous le présente dans l'état de sulfure de molybdène, 273.
Mortiers. Leur description. Leur usage, 404 & 405.
Muriates oxigénés. Le calorique entre dans leur composition en quantité presqu'égale à celle qui est nécessaire pour constituer le gaz oxigène, 207.
N
Nitrates. Sels résultans de l'union de l'acide nitrique avec différentes bases, 237.-Appareil pour en retirer l'acide, 78.-Dégagement de gaz oxigène qui l'accompagne, ibid.
Nitrites. Sels résultans de l'union de l'acide nitreux avec différentes bases, 237.
Noix de galle. Elles fournissent le principe astringent ou acide gallique par une simple infusion dans l'eau, 307.
Nomenclature. Systême général d'après lequel elle est formée.-Discours préliminaire.-Ses difficultés, 128.-Le point où en est la science oblige de conserver au moins pour un tems les noms anciens pour les acides & oxides animaux & végétaux, 129.
O
Odeur fétide. Elle est produite par la dissolution des corps combustibles dans le gaz hydrogène, 156.
Opérations manuelles de la Chimie.-Se divisent en plusieurs classes, 325.-Les unes ne sont que méchaniques, elles ne font que diviser les corps.-Les autres sont véritablement chimiques, 325 & suiv.
Or, se dissout dans l'acide nitro-muriatique.-S'oxide avant sa dissolution, 259.-Se volatilise lentement au feu alimenté par le gaz oxigène, 556.
Os des animaux. Ce sont de véritables phosphates de chaux, 224.
Oxides. Nom générique pour exprimer le premier degré d'oxigénation de toutes les substances, 85.-Le règne végétal & le règne animal ont leurs oxides, ibid.
— A deux bases, moyen d'expliquer sans périphrase le principe qui est en excès, 126.
— Animaux. Leur nombre est encore indéterminé, 130.-Il entre ordinairement dans leur composition 4 bases oxidables, 125.-Les principes qui les constituent se désunissent à un très-léger 612 changement de température, 131.
Oxides métalliques. Combinaisons de l'oxigène avec les métaux, 82.-Les anciens Chimistes les confondoient sous le nom de chaux, avec un grand nombre de substances de nature très-différente, 84.-On les spécifie par leur couleur qui varie en raison de la quantité plus ou moins grande d'oxigène qu'ils contiennent, 85.-Brûlent avec flamme au feu alimenté par le gaz oxigène, 556.-Réflexions sur ce phénomène, ibid.
— Végétaux. Leur nomenclature, 138 & suiv.-Se décomposent à un degré de chaleur supérieur à l'eau bouillante; le calorique rompt l'équilibre qui existoit entre les parties qui les constituoient, 130.-Comment ils different entr'eux, 210.-Leur décomposition par la fermentation vineuse, 139.
— Rouge de mercure. L'oxigène y tient très-peu. Moyens d'oxider les corps à une chaleur médiocre, 206.
Oxigénation. Combinaison d'un corps avec l'oxigène, 66.
Oxigène, a une grande affinité pour la lumière.-Elle contribue avec le calorique à le constituer dans l'état de gaz, 201.-Dans cet état il forme la partie respirable de l'air, 54.-Il entre pour un tiers dans le poids de notre atmosphère; l'azote constitue les deux autres tiers, 203.-Abandonne le calorique pour s'unir à l'hydrogène dans la combustion, 95.-C'est le principe acidifiant de tous les acides, 69.-Un premier degré de combinaison de ce principe avec l'azote forme le gaz nitreux, 80.-Un second degré constitue l'acide nitreux, ibid.-Un troisieme constitue l'acide nitrique, 214.-Ses combinaisons avec les substances simples se nomment binaires, ternaires, quaternaires, selon le nombre de ces substances, 207.-Tableau de ses combinaisons binaires avec les substances simples métalliques & non métalliques, 203.-Se dégage pendant la décomposition du nitre par l'acide sulfurique, 78.-Il tient peu à l'acide nitrique, 207.-Condition nécessaire pour sa combinaison, 203 & suiv.-Il est le moyen d'union entre les métaux & les acides, 179.-Tout porte à croire que les substances qui ont une grande affinité avec les acides contiennent de l'oxigène, 179.-Et qu'il entre dans la composition des terres regardées comme simples, 180.-Quantité 613 que le sucre en contient, 142.-Il conserve une grande partie de son calorique en se combinant au gaz nitreux, 110.
P
Pesanteur spécifique. On a désigné sous ce nom le poids absolu des corps divisé par leur volume.-On détermine cette pesanteur par le moyen de la balance hydrostatique, 337.
Pese-liqueurs, servent à déterminer la pesanteur spécifique des fluides, 338.-Leur description.-Manière de s'en servir. On les construit en verre & en métal, 338 & suiv.
Phosphore. Substance inconnue des anciens Chimistes. C'est un produit de l'art. Epoque de sa découverte. On le retire à présent des os des animaux.-Manière de le préparer, 224.-C'est un corps combustible simple.-Il se rencontre, à ce qu'il paroît, dans toutes les substances animales & dans quelques plantes, 198, 199, 225.-Il y est ordinairement combiné avec l'azote, l'hydrogène, &c.-Il s'allume à 32 degrés de chaleur, 225.-Décompose le gaz oxigène à cette température, 58 & suiv.-Absorbe une fois & demie son poids d'oxigène, 63.-Se convertit en un acide, 66.-Il devient incombustible par la combinaison avec l'oxigène, 65.-Appareils pour sa combustion, 58, 61, 482 & suiv.-Quantité de calorique qui se dégage pendant sa combustion, 62 & 107.-Ses combinaisons avec les substances simples, 223.-Avec les métaux, 118.-Avec le gaz hydrogène, ibid.-Il paroît qu'il demeure combiné avec le charbon dans la distillation des végétaux, 136.-Enleve l'oxigène à l'acide nitrique & à l'acide muriatique oxigéné, 249.-C'est une des bases des acides animaux, 124.
Pierres composées, se fondent au feu alimenté par le gaz oxigène, 556.
— Précieuses. Celles qui sont décolorées par le feu alimenté de gaz oxigène, ont l'apparence d'une terre blanche, & de la porcelaine, 557.
Plantes. La couleur des feuilles & la diversité de celles des fleurs tient à la combinaison de la lumière avec elles, 201.-Contiennent du phosphore, 225.
Poids. Division de la livre en fractions décimales, moyen de simplifier les calculs, 333.-Table pour convertir les fractions décimales en fractions vulgaires & réciproquement.
614
Porphirisation. Instrumens propres à l'opérer, 403.
Potasse. Son origine.-Procédés pour l'extraire, 165 & suiv.-Il n'est pas démontré qu'elle existe dans le charbon avant la combustion, 228.-Il ne paroît pas qu'on puisse l'extraire des végétaux sans des intermedes qui fournissent de l'azote & de l'oxigène, 169.-Presque toujours saturée d'acide carbonique, pourquoi, 167.-Elle est soluble dans l'eau, 168.-Elle attire l'humidité de l'air avec une grande rapidité.-Elle est en conséquence très-propre à opérer la dessication des gaz, 168.-Elle est soluble dans l'esprit-de-vin, ibid.
Poudre à canon. Il se dégage de l'azote & du gaz acide carbonique dans son inflammation, 525 & 526.
Pression de l'atmosphère. Elle met obstacle à l'écartement des molécules des corps, 8.-Sans elle il n'y auroit pas de fluides proprement dits, ibid.-Expériences qui le prouvent, 9 & 10.
Pulvérisation. Instrumens propres à l'opérer, 403.
Putréfaction. Ses phénomènes sont dus en partie à la décomposition de l'eau, 101.-Est très-lente lorsque le corps qui l'éprouve ne contient pas d'azote, 155.-C'est dans le mêlange des substances végétales & animales que consiste toute la science des amendemens & des fumiers, 155.
— Des végétaux, n'est autre chose que l'analyse des substances végétales dans laquelle la totalité de leurs principes se dégage sous la forme de gaz, 154.
Pyrites, nom que les anciens donnoient à la combinaison du soufre & des métaux, 117.
R
Radical acéteux. Tableau de ses combinaisons, 294.-Acide à deux bases.-C'est le plus oxigéné des acides végétaux.-Contient un peu d'azote.-Moyens de l'obtenir & de l'avoir pur.-Libre de toute combinaison, il est dans l'état de gaz au degré de température dans lequel nous vivons.-La plupart des sels qu'il forme avec les bases salifiables ne sont pas cristallisables, 295 & suiv.
— Boracique. Sa nature est inconnue, 229.
— Fluorique. Sa nature est inconnue, 229.-Ses combinaisons avec l'oxigène, ibid.
Radical malique. Tableau de ses combinaisons, 281.
— Muriatique. Sa nature est encore inconnue, 229.
615
— Tartareux. Tableau de ses combinaisons, 227.
Radicaux des acides, leur tableau, 196.-Combinaisons des radicaux simples avec l'oxigène, 203 & suiv.-Combinaison des radicaux composés avec l'oxigène, 208 & suiv.
— Hydro-carboneux & Carbone-hydreux, 198.
— Oxidables & Acidifiables. Sont simples dans le règne minéral.-Sont composés dans les deux autres, 209.
Rape. Sert à diviser les substances pulpeuses, 405.
Réductions métalliques. Ne sont autre chose que des oxigénations du charbon par l'oxigène contenu dans les oxides métalliques, 206.
Respiration. Raisons qui ont empêché d'en parler dans cet ouvrage, 202.
Rubis. Se ramollit, se soude & se fond sans altération de sa couleur, par l'action du feu alimenté par le gaz oxigène, 556.
— du Brésil. Se décolore & perd un cinquième de son poids au feu alimenté par le gaz oxigène, 557.
S
Salpêtre. Combinaisons de l'acide nitrique & de la potasse, 233.-Moyens d'obtenir ce sel, ibid.-Son rafinage fondé sur la différente solubilité des sels, 439, 440.
Sang. La partie rouge est un oxide animal, 130.
Sécrétions animales. Sont de véritables oxides, 130.
Sel marin. Combinaison de l'acide muriatique & de la soude, 259.
— Muriatique oxigéné de potasse. Fournit un gaz oxigène absolument pur, 507.
— Sédatif. Voy. Acide Boracique, 265.
— Neutres. Leur formation, 162 & 189.-Ils résultent de la réunion d'une substance simple oxigénée avec une base quelconque, 164.-Ou, ce qui est la même chose, de l'union des acides avec les substances métalliques terreuses & alkalines, 162.-Quelles sont les bases. salifiables susceptibles de se combiner avec les acides, 162, & 164.-Le nombre des sels connus a augmenté en raison des acides qui ont été découverts, 209.-Dans l'état actuel de nos connoissances, il est de 1152, 182.-Mais il est probable que toutes ces combinaisons salines ne sont pas possibles, 183.-Combinaisons salines présentées sous la forme de tableaux.-On a suivi pour les classer les mêmes principes que pour les substances simples, 183 & suiv.-Leur nomenclature, 183.-On les distingue par le nom de leur base salifiable, 184 & suiv.-Plan d'expériences sur les sels neutres, 187.-De leur solution, 616 403.-Par le calorique, 424 & 438.-On confondoit autrefois la solution & la dissolution, 423 & 424.-Des différens degrés de solubilité des sels, 426 & suiv.-Travail à faire sur les sels neutres, 428.
Siphon. Sa description, 412.
Soufre. Substance combustible qui est dans l'état concret à la température de l'atmosphère, & qui se liquéfie, à une chaleur supérieure à l'eau bouillante, 221.-Sa combinaison avec les substances simples, ibid.-Avec le gaz hydrogène, 118.-Avec différens autres gaz, 66.-Avec le charbon, 67.-Il décompose l'air, 66.-Enleve l'oxigène au calorique, ibid.-Il est susceptible de plusieurs degrés de saturation en se combinant avec l'oxigène, 72.-Moyen d'exciter sa combustion pour la formation de l'acide sulfurique, 241.
Sublimation.-Distillation des matières qui se condensent sous forme concrète, 448.
Substances animales sont composées d'hydrogène, de carbone, de phosphore, d'azote & de soufre, le tout porté à l'état d'oxide par une portion d'oxigène, 158.-Leur distillation donne les mêmes résultats que les plantes crucifères, 136.-Elles donnent seulement plus d'huile & plus d'ammoniaque, en raison de l'azote & de l'hydrogène qu'elles contiennent dans une plus grande proportion, 136.-Elles favorisent la putréfaction, parce qu'elles contiennent de l'azote, 155.-Elles peuvent varier en raison de la proportion de leurs principes constituans & de leur degré d'oxigénation, 213.-Sont décomposées par le feu, 132.
Substances combustibles. Ce sont celles qui ont une grande appétence pour l'oxigène, 116.-Peuvent s'oxigéner par leur combinaison avec les nitrates & les muriates oxigénés, 206 & 207.
— Métalliques. A l'exception de l'or & quelquefois de l'argent, elles se présentent rarement dans la nature sous la forme métallique, 173.-Celles que nous pouvons réduire sous forme métallique sont au nombre de 17, 174.-Celles qui ont plus d'affinité avec l'oxigène qu'avec le carbone ne sont pas susceptibles d'être amenées à cet état, 174.-Considérées comme bases salifiables, 175.-Ne peuvent le dissoudre que lorsqu'elles s'oxident, 176 & 177.-L'effervescence qui a lieu pendant leur dissolution dans les acides prouve qu'elles s'oxident, ibid.-Se dissolvent sans effervescence dans les acides lorsqu'elles 617 ont été préalablement oxidées, 178.-Se dissolvent sans effervescence dans l'acide muriatique oxigéné, ibid.-Dans l'acide sulfureux, 245.-Celles qui sont trop oxigénées s'y dissolvent & forment des sulfates métalliques, ibid.-Décomposent toutes le gaz oxigène, excepté l'or & l'argent, 82, 203 & suiv.-Elles s'oxident & perdent leur éclat métallique, 83.-Pendant cette opération elles augmentent de poids à proportion de l'oxigène qu'elles absorbent, ibid.-Les anciens donnoient improprement le nom de chaux aux métaux calcinés ou oxides métalliques, 83.-Appareils pour accélérer l'oxidation, 514 & suiv.-N'ont pas toutes le même degré d'affinité pour l'oxigène, 513.-Lorsqu'on ne peut en séparer l'oxigène, elles demeurent constamment dans l'état d'oxides & se confondent pour nous avec les terres, 174.-Décomposent l'acide sulfurique en lui enlevant une portion de son oxigène, & alors elles s'y dissolvent, 242.-Leurs combinaisons les unes avec les autres, 230.-Les alliages qui en résultent sont plus cassans que les métaux alliés, 116.-C'est à leurs différens degrés de fusibilité que sont dus une partie des phénomènes que présentent ces combinaisons, 117.-Brûlent avec flamme colorée & se dissipent entiérement au feu alimenté par le gaz oxigène, 556.-Toutes, excepté le mercure, s'y oxident sur un charbon, ibid.
Substances salines se volatilisent au feu alimenté par le gaz oxigène, 556.
— Simples. Leur définition. Ce sont celles que la chimie n'a pas encore pu parvenir à décomposer, 193 & suiv.-Leur tableau, 192.-Leurs combinaisons avec le soufre, 221.-Avec le phosphore, 223.-Avec le carbone, 227.-Avec l'hydrogène, 217.-Avec l'azote, 213.
— Végétales. Leurs principes constitutifs sont l'hydrogène & le carbone, 132.-Contiennent quelquefois du phosphore & de l'azote, 136.-Manière d'envisager leur composition & leur décomposition, 132.-Leur décomposition se fait en vertu d'affinités doubles & triples, 135.-Tous les principes qui les composent sont en équilibre entr'eux au degré de température dans lequel nous vivons, 133.-Leur distillation fournit la preuve de cette théorie, 135.-A un degré peu supérieur à l'eau bouillante, une partie du carbone devient libre, 134.-L'hydrogène & l'oxigène se réunissent pour former de l'eau, ibid.-Une 618 portion d'hydrogène & de carbone s'unissent & forment de l'huile volatile, ibid.-A une chaleur rouge l'huile formée seroit décomposée, 135.-L'oxigène alors s'unit au carbone avec lequel il a plus d'affinité à ce degré, 134.-L'hydrogène s'échappe sous la forme de gaz en s'unissant au calorique, ibid.
Sucre. Oxide végétal à deux bases, 125.-Son analyse, 142 & suiv.-En l'oxigénant on forme de l'acide oxalique, de l'acide malique, de l'acide acéteux, selon la proportion d'oxigène, 294.-Moyens de rompre l'équilibre de ses principes par la fermentation, 142.-Récapitulation des résultats obtenus par la fermentation, 148.-Contient les substances propres à former de l'eau, mais non de l'eau toute formée, 151.
— de lait oxigéné forme l'acide saccholactique, 311.
Sulfates. Combinaisons de l'acide sulfurique avec les différentes bases, 245.
— Métalliques. Combinaisons des métaux avec l'acide sulfurique, 245.
Sulfites. Combinaisons de l'acide sulfureux avec les différentes bases, 245.
— Métalliques pourroient bien ne pas exister, 245.
Sulfures. Combinaisons du soufre avec les métaux, 118.
T
Tableau des acides & de leurs bases salifiables, 180 & suiv.-Des substances simples, 192.-Des radicaux composés, 196.-Des combinaisons de l'oxigène, 203, 208.-Des combinaisons de l'azote, 212.-De l'hydrogène, 216.-Du soufre, 220.-Du phosphore, 222.-Du carbone, 226.-De l'acide nitrique, 232.-De l'acide sulfurique, 238.-De l'acide sulfureux, 243.-De l'acide phosphoreux, 246.-De l'acide phosphorique, 247.-De l'acide carbonique, 250.-De l'acide muriatique, 253.-De l'acide muriatique oxigéné, 254.-De l'acide nitro-muriatique, 258.-De l'acide fluorique, 261.-De l'acide boracique, 264.-De l'acide arsenique, 268.-De l'acide molybdique, 272.-De l'acide tunstique, 274.-De l'acide tartareux, 277.-De l'acide malique, 281.-De l'acide citrique, 284.-De l'acide pyro-ligneux, 286.-De l'acide pyro-tartareux, 288.-De l'acide pyro-muqueux, 290.-De l'acide oxalique, 292.-De l'acide acétique, 298,-De l'acide succinique, 300.-De l'acide benzoïque, 302.-De l'acide camphorique, 304.-De l'acide gallique, 306.-De l'acide lactique, 308.-De l'acide saccholactique, 619 310.-De l'acide formique, 312.-De l'acide bombique, 314.-De l'acide sébacique, 316.-De l'acide lithique, 318.-De l'acide prussique, 320.
Tamisage. Moyen de séparer les corps en molécules de grosseurs à-peu-près uniformes, 409.
Tartre est composé de l'acide appelé tartarum, & de potasse.-Moyen de le décomposer pour en obtenir l'acide pur, 378, 379.
Tartrite acidule de potasse. Combinaison de la potasse & de l'acide tartareux, avec excès d'acide, 280.
— de potasse. Sel parfaitement neutre, résultant de la combinaison de l'acide tartareux & de la potasse, 280.
Terre ou terreau. Principe fixe qui reste après l'analyse des substances végétales fermentées, 154.
— On les regarde comme des êtres simples, 172.-Il y a quelques raisons de penser qu'elles contiennent de l'oxigène, 180, ibid.-Et peut-être qu'elles sont des métaux oxidés, ibid.-Elles ont une grande tendance à la combinaison, 172.
Terres composées. Se fondent au feu alimenté par le gaz oxigène sous la forme d'un verre blanc, 556.
Thermomètre. Corrections du volume des gaz relatives aux différens degrés du thermomètre.-Modèle de calcul pour ces corrections, 380 & suiv.
Topaze de Saxe. Se décolore & perd un cinquième de son poids au feu alimenté par le gaz oxigène, 557.
Trituration. Instrumens propres à l'opérer, 403.
Tunstène. Métal particulier souvent confondu avec l'étain.-Sa cristallisation.-Sa pesanteur spécifique.-Il se trouve naturellement dans l'état d'oxide.-Il fait fonction d'acide.-Il y est uni à la chaux, 275.
V
Vaisseaux évaporatoires. Leur forme, 434 & suiv.
Vaporisation. Passage d'un fluide liquide à l'état aériforme, 12.
Verres ardens. Ne produisent pas d'aussi grands effets qu'on avoit lieu de l'attendre 552.
Vers à soie. Sa crysalide fournit l'acide bombique, 315.
W
Wolfram. Substance métallique.-Véritable tunstène, 275.
Fin de la Table des Matières.
620
EXTRAIT des Registres de l'Académie Royale des Sciences.
Du 4 Février 1789.
L'Académie nous a chargés, M. d'Arcet & moi, de lui rendre compte d'un Traité élémentaire de Chimie, que lui a présenté M. Lavoisier.
Ce Traité est divisé en trois parties: la première a principalement pour objet, la formation des fluides aëriformes & leur décomposition, la combustion des corps simples, & la formation des acides.
Les molécules des corps peuvent être considérées comme obéissant à deux forces, l'une répulsive, l'autre attractive. Pendant que la derniere de ces forces l'emporte, le corps demeure dans l'état solide; si, au contraire, l'attraction est plus foible, les parties du corps perdent l'adhérence qu'elles avoient entr'elles, & il cesse d'être un solide.
La force répulsive est due au fluide très-subtil qui s'insinue à travers les molécules de tous les corps, & qui les écarte; cette substance, quelle qu'elle soit, étant la cause de la chaleur, ou, en d'autres termes, la sensation que nous appelons chaleur, étant l'effet de l'accumulation de cette substance, on ne peut pas, dans un langage rigoureux, la désigner par le nom de chaleur, parce que la même dénomination ne peut pas exprimer la cause & l'effet; c'est ce qui a déterminé M. Lavoisier, avec les autres Auteurs de la Nomenclature chimique, à la désigner sous le nom de calorique.
Nous nous contenterons, dans ce rapport, d'employer la nomenclature adoptée par M. Lavoisier; mais dans le cours de son ouvrage, après avoir établi, par les expériences les plus exactes, les faits qui doivent servir de base aux connoissances chimiques, il a toujours soin de justifier la nomenclature dont il fait usage, & de suivre les rapports qui doivent se trouver entre les idées & les mots qui les représentent.
621
S'il n'existoit que la force attractive des molécules de la matière, & la force répulsive du calorique, les corps passeroient brusquement de l'état de solide à celui de fluide aëriforme; mais une troisième force, la pression de l'atmosphère, met obstacle à cet écartement, & c'est à cet obstacle qu'est due l'existence des fluides. M. Lavoisier établit, par plusieurs expériences, quel est le degré de pression qui est nécessaire pour contenir différentes substances dans l'état liquide, & quel est le degré de chaleur nécessaire pour vaincre cette résistance. Mais il y a un certain nombre de substances qui, à la pression de notre atmosphère & au degré de froid connu, n'abandonnent jamais l'état de fluide aëriforme; ce sont celles-là qu'on désigne sous le nom de gaz.
Puisque les molécules de tous les corps de la nature sont dans un état d'équilibre entre l'attraction, qui tend à les rapprocher & à les réunir, & les efforts du calorique, qui tend à les écarter, non-seulement le calorique environne de toutes parts les corps, mais encore il remplit les intervalles que leurs molécules laissent entr'elles, & comme c'est un fluide extrêmement compressible, il s'y accumule, il s'y resserre & s'y combine en partie. De ces considérations, M. Lavoisier déduit l'explication de ce qu'on doit entendre par le calorique libre, le calorique combiné, la capacité de calorique, la chaleur absolue, la chaleur latente, la chaleur sensible. On pourroit lui reprocher d'avoir insisté trop peu sur la propriété élastique & compressible du calorique, & de-là résulte une différence entre ses principes & la théorie de M. Black, sur la capacité de chaleur, mais en écartant cette considération, les idées de M. Lavoisier ont acquis l'avantage d'avoir plus de clarté.
Après ces principes généraux, M. Lavoisier décrit le moyen qu'a imaginé M. de la Place pour déterminer par la quantité de glace fondue, celle du calorique qui s'est dégagé au milieu de cette glace, d'un corps qui étoit élevé à une certaine température, ou d'une combinaison qui s'y est formée. Il passe ensuite à des vues générales sur la formation & la constitution de 622 l'atmosphère de la terre, non-seulement en la considérant dans l'état où elle se trouve, mais encore dans différens états hypothétiques.
Notre atmosphère est formée de toutes les substances susceptibles de demeurer dans l'état aëriforme au degré habituel de température & de pression que nous éprouvons. Il étoit bien important de déterminer quel est le nombre & quelle est la nature des fluides élastiques qui composent cette couche inférieure que nous habitons. On sait que les connoissances que nous avons acquises sur cet objet, font la gloire de la Chimie moderne; que non-seulement on a analysé ces fluides, mais qu'on a encore appris à connoître une foule de combinaisons qu'ils formoient avec les substances terrestres, & que par-là le vide immense que les anciens Chimistes cherchoient à déguiser par quelques suppositions, a été comblé pour la plus grande partie. Il est bien intéressant de voir celui qui a le plus contribué à nous procurer ces connoissances nouvelles, en tracer lui-même le tableau, rapprocher les résultats des expériences qui ont fait l'objet d'un grand nombre de ses Mémoires, perfectionner ces expériences & tous les appareils qu'il a fallu imaginer; mais il n'est pas possible de suivre dans un extrait les descriptions que M. Lavoisier présente avec beaucoup de concision, sur l'analyse de l'air de l'atmosphère, la décomposition du gaz oxigène par le soufre, le phosphore & le charbon, sur la formation des acides en général, la décomposition du gaz oxigène par les métaux, la formation des oxides métalliques, le principe radical de l'eau, sa décomposition par le charbon & par le fer, la quantité de calorique qui se dégage des différentes espèces de combustion, & la formation de l'acide nitrique.
Après tous ces objets, M. Lavoisier examine la combinaison des substances combustibles les unes avec les autres.
Le soufre, le phosphore, le charbon ont la propriété de s'unir avec les métaux, & de-là naissent les combinaisons que M. Lavoisier désigne sous le nom de sulfures, phosphures & carbures.
623
L'hydrogène peut aussi se combiner avec un grand nombre de substances combustibles; dans l'état de gaz, il dissout le carbone ou charbon pur, le soufre, le phosphore, & de-là viennent les différentes espèces de gaz inflammable.
Lorsque l'hydrogène & le carbone s'unissent ensemble, sans que l'hydrogène ait été porté à l'état de gaz par le calorique, il en résulte, selon M. Lavoisier, cette combinaison particuliere qui est connue sous le nom d'huile, & cette huile est fixe ou volatile, selon les proportions de l'hydrogène & du carbone. Il a exposé dans les Mémoires de 1784, les expériences qui l'ont conduit à cette opinion.
Cependant il nous paroît que cette opinion n'est pas à l'abri des objections, nous nous contenterons d'en proposer une. Toutes les huiles donnent un peu d'eau & un peu d'acide lorsqu'on les distille, & en réitérant les distillations, on peut les réduire entièrement en eau, en acide, en charbon, en gaz carbonique & en gaz hydrogène carboné. Cet acide & cette eau qu'on retire dans chaque opération, n'annoncent-ils pas qu'il entroit de l'oxigène dans la composition de l'huile; car il est facile de prouver que l'air qui est contenu dans les vaisseaux qui servent à la distillation, n'a pas pu contribuer d'une manière sensible à leur production?
Il falloit d'abord examiner les phénomènes que présente l'oxigénation des quatre substances combustibles simples, le phosphore, le soufre, le carbone & l'hydrogène; mais ces substances, en se combinant les unes avec les autres, ont formé des corps combustibles composés, tels que les huiles, dont l'oxigénation doit présenter d'autres résultats. Selon M. Lavoisier, il existe des acides & des oxides à base double & triple: il donne en général le nom d'oxide à toutes les substances qui ne sont pas assez oxigénées pour prendre le caractère acide. Tous les acides du règne végétal ont pour base l'hydrogène & le carbone, quelquefois l'hydrogène, le carbone & le phosphore. Les acides & oxides du règne animal sont encore plus composés; il entre dans la composition 624 de la plupart quatre bases acidifiables, l'hydrogène, le carbone, le phosphore & l'azote. M. Lavoisier tâche de rendre raison par ces principes très-simples, de la nature & de la différence des acides végétaux & des autres substances d'une nature végétale & d'une nature animale; il ne seroit pas juste dans ce moment de juger avec sévérité ces apperçus ingénieux, parce que l'Auteur se propose de les développer dans des Mémoires particuliers.
L'hydrogène, l'oxigène & le carbone, sont des principes communs à tous les végétaux, & pour cette raison, M. Lavoisier les appelle primitifs. Ces principes, en raison de la quantité de calorique avec lequel ils se trouvent combinés dans les végétaux, sont tous à-peu-près en équilibre à la température dans laquelle nous vivons; ainsi les végétaux ne contiennent ni huile, ni eau, ni acide carbonique, & seulement les élémens de toutes ces substances; mais un changement léger dans la température suffit pour renverser cet ordre de combinaison. L'hydrogène & l'oxigène s'unissent plus intimément & forment de l'eau qui passe dans la distillation; une portion de l'hydrogène & une portion du carbone se réunissent ensemble pour former de l'huile volatile, une autre partie du carbone devient libre & reste dans la cornue. Dans les substances animales, l'azote, qui est un de leurs principes primitifs, s'unit à une portion d'hydrogène pour former l'alkali volatil. M. Lavoisier donne des explications analogues à celles que nous venons d'indiquer, des phénomènes & des produits de la fermentation vineuse, & de la putréfaction.
Il y a un grand rapport entre ces dernieres idées de M. Lavoisier & celles que M. Higgins a exposées dans un traité sur l'acide acéteux, la distillation, la fermentation, &c. qu'il a publié en 1786, & dans lequel il admet la formation de l'eau & des huiles par l'action de la chaleur; mais n'ayant pas distingué le gaz hydrogène qu'il appelle phlogistique (ce qui est tout-à-fait indifférent), du charbon & de leur combinaison, il n'a pu déterminer les effets de la chaleur & de la fermentation avec autant d'exactitude que M. Lavoisier.
625
Les substances acidifiables, en s'unissant avec l'oxigène & en se convertissant en acides, acquièrent une grande tendance à la combinaison: elles deviennent propres à s'unir avec des substances terreuses & métalliques. Mais une circonstance remarquable distingue ces deux espèces de combinaison; c'est que les métaux ne peuvent contracter d'union avec les acides que par l'intermède de l'oxigène, de manière qu'il faut qu'ils soient réduits en oxides, ou qu'ils décomposent l'eau dont ils dégagent alors le gaz hydrogène, ou qu'ils trouvent de l'oxigène dans l'acide, & c'est ainsi qu'ils forment du gaz nitreux avec l'acide nitrique.
La considération des phénomènes qui accompagnent les dissolutions, conduit M. Lavoisier à celle des bases alkalines, des terres & des métaux, & à déterminer le nombre des sels qui peuvent résulter de la combinaison de ces différentes bases avec tous les acides connus.
Dans la seconde partie de son ouvrage, M. Lavoisier présente successivement le tableau des substances simples, ou plutôt de celles que l'état actuel de nos connoissances nous oblige à considérer comme telles, celui des radicaux ou bases oxidables & acidifiables, composées de la réunion de plusieurs substances simples, ceux des combinaisons de l'azote, de l'hydrogène, du carbone, du soufre & du phosphore, avec des substances simples, & enfin ceux des combinaisons de tous les acides connus, avec les différentes bases. Chaque tableau est accompagné d'une explication sur la nature & les préparations de la substance qui en est l'objet, & sur ses principales combinaisons.
M. Lavoisier a réuni, dans la troisième partie de son ouvrage, la description sommaire de tous les appareils & de toutes les opérations manuelles qui ont rapport à la Chimie élémentaire. Les détails indispensables dans lesquels il faut entrer, auroient interrompu la marche des idées rapides qu'il a présentées dans les deux premières parties, & en auroient rendu la lecture fatigante.
Cette description est d'autant plus précieuse, que non-seulement elle est faite avec beaucoup de méthode & 626 de clarté, mais encore qu'elle a particulièrement pour objet les appareils relatifs à la Chimie moderne, dont plusieurs sont dûs à M. Lavoisier lui-même, & qui, en général, sont encore peu connus, même de ceux qui font une étude particulière de la Chimie; mais il est impossible de tracer une esquisse de ces descriptions, & nous sommes obligés de nous borner à l'énumération des chapitres dans lesquels elles sont classées.
Le chapitre premier traite des instrumens propres à déterminer le poids absolu & la pesanteur spécifique des corps solides & liquides.
Le second est destiné à la gazométrie, ou à la mesure du poids & du volume des substances aëriformes.
Le chapitre troisième contient la description des opérations purement mécaniques, qui ont pour objet de diviser les corps, telles que la trituration, la porphirisation, le tamisage, la filtration, &c.
M. Lavoisier décrit, dans le chapitre cinquième, les moyens que la Chimie emploie pour écarter les unes des autres les molécules des corps sans les décomposer, & réciproquement pour les réunir, ce qui comprend la solution des sels, leur lexiviation, leur évaporation, leur cristallisation, & les appareils distillatoires.
Les distillations pneumato-chimiques, les dissolutions métalliques, & quelques autres opérations qui exigent des appareils très-compliqués, sont l'objet du sixième chapitre.
Le chapitre septième contient la description des opérations relatives à la combustion & à la détonnation. Les appareils qui sont décrits dans ce chapitre sont entièrement nouveaux.
Enfin le chapitre huitième est destiné aux instrumens nécessaires pour opérer sur les corps à de très-hautes températures.
Toutes ces descriptions sont rendues sensibles par un grand nombre de planches qui présentent tous les détails qu'on peut desirer, & qui sont gravées avec beaucoup de soin. Nous ne devons pas laisser ignorer à la reconnoissance des Chimistes, qu'elles ne sont point 627 l'ouvrage d'un burin mercenaire, mais qu'elles sont dûes au zèle & aux talens variés du traducteur de l'ouvrage de M. Kirwan sur le phlogistique.
Ces nouveaux élémens sont terminés par quatre tables; la première donne le nombre des pouces cubiques correspondans à un poids déterminé d'eau; la seconde est destinée à convertir les fractions vulgaires en fractions décimales, & réciproquement; la troisième présente le poids des différens gaz, & la quatrième, la pesanteur spécifique des différentes substances.
Ainsi M. Lavoisier, en partant des notions les plus simples & des objets les plus élémentaires, conduit successivement aux combinaisons plus composées. Ses raisonnemens sont presque toujours fondés sur des expériences rigoureuses, ou plutôt ils n'en sont que le résultat; & il finit par donner les élémens de l'art des expériences qui doit servir de guide aux Chimistes qui, au lieu de se livrer à de vaines hypothèses, veulent établir leurs opinions la balance à la main.
L'ouvrage est précédé d'un discours dans lequel M. Lavoisier rend compte des motifs qui l'ont engagé à l'entreprendre, & de la marche qu'il a suivie dans son exécution.
S'étant imposé la loi de ne rien conclure au-delà de ce que les expériences présentent & de ne jamais suppléer au silence des faits, il n'a point compris dans ses élémens la partie de la Chimie la plus susceptible peut-être de devenir un jour une science exacte, c'est celle qui traite des affinités ou attractions chimiques; mais les données principales manquent, ou du moins celles que nous avons ne sont encore ni assez précises, ni assez certaines pour devenir la base sur laquelle doit porter une partie aussi importante de la Chimie.
M. Lavoisier a la modestie d'avouer qu'une considération secrète a peut-être donné du poids aux raisons qu'il pouvoit avoir de se taire sur les affinités; c'est que M. de Morveau est au moment de publier l'article affinité de l'Encyclopédie méthodique, & qu'il a redouté de traiter en concurrence avec lui, un objet qui exige des discussions très-délicates.
628
Quoique les Savans s'empressent de toutes parts de rendre justice aux connoissances profondes de M. de Morveau, il doit néanmoins être flatté d'un aveu qui honore également celui qui l'a fait.
Si M. Lavoisier ne parle point, dans ce Traité, des parties constituantes & élémentaires des corps, c'est qu'il regarde comme hypothétique tout ce qu'on a dit sur les quatre élémens: il est probable que nous ne connoissons pas les molécules simples & indivisibles qui composent les corps; mais il est un terme auquel nous conduisent nos analyses, & ce sont les derniers résultats que nous en obtenons, qui sont pour nous des substances simples, ou, si l'on veut, des élémens.
Mais l'objet principal de ce discours est de faire sentir la liaison qui se trouve entre l'abus des mots & les idées fausses, & entre la précision du langage & les progrès des sciences.
Nous pensons que ces nouveaux Elémens sont très-dignes d'être imprimés sous le privilége de l'Académie.
Fait à l'Académie, le 4 Février 1789.
Signé, d'Arcet & Bertholet.
Je certifie le présent extrait conforme à l'original, & au jugement de l'Académie. A Paris, ce 7 Février 1789.
Signé, le Marquis de Condorcet.
629
EXTRAIT des Registres de la Société Royale
de Médecine.
Du 6 Février 1789.
La Société nous a chargés, M. de Horne & moi, d'examiner un Ouvrage de M. Lavoisier, ayant pour titre, Traité élémentaire de Chimie, présenté dans un ordre nouveau, & d'après les découvertes modernes. Comme ce Traité, que nous avons lu avec le plus vif intérêt, offre une méthode élémentaire différente de toutes celles qu'on a suivies dans les Ouvrages du même genre, nous avons cru devoir en rendre un compte très-détaillé à la Compagnie.
Les Physiciens, & tous les hommes, qui s'adonnent à l'étude de la Philosophie naturelle, savent que c'est aux expériences de M. Lavoisier qu'est due la révolution que la Chimie a éprouvée depuis quelques années; à peine M. Black eut-il fait connoître, il y a bientôt vingt ans, l'être fugace qui adoucit la chaux & les alkalis, & qui avoit jusques-là échappé aux recherches des Chimistes; à peine M. Priestley eut-il donné ses premières expériences sur l'air fixe & ce qu'il appeloit les différentes espèces d'air, que M. Lavoisier, qui ne s'étoit encore appliqué qu'à mettre dans les opérations de Chimie de l'exactitude & de la précision, conçut le vaste projet de répéter & de varier toutes les expériences des deux célèbres Physiciens Anglois, & de poursuivre avec une ardeur infatigable une carrière nouvelle, dont il prévoyoit dès-lors l'étendue. Il sentit sur-tout que l'art de faire des expériences vraiment utiles, & de contribuer aux progrès de la science de l'analyse, consistoit à ne rien laisser échapper, à tout recueillir, à tout peser. Cette idée ingénieuse, à laquelle sont dues toutes les découvertes modernes, l'engagea à imaginer, pour les effervescences, pour les combustions, 630 pour la calcination des métaux, &c. des appareils capables de porter la lumière la plus vive sur la cause & les résultats de ces opérations. On connoît trop généralement aujourd'hui la plupart des faits & des découvertes que cette route expérimentale nouvelle a fait naître, pour que nous ayons besoin d'en suivre ici les détails; nous nous contenterons de rappeler que c'est à l'aide de ces procédés, à l'aide de ce nouveau sens, ajouté, pour ainsi dire, à ceux que le Physicien possédoit déjà, que M. Lavoisier est parvenu à établir des vérités & une doctrine nouvelles sur la combustion, sur la calcination des métaux, sur la nature de l'eau, sur la formation des acides, sur la dissolution des métaux, sur la fermentation & sur les principaux phénomènes de la nature. Ces instrumens si ingénieux, cette méthode expérimentale si exacte & si différente des procédés employés autrefois par les Chimistes, n'ont cessé, depuis 1772, de devenir entre les mains de M. Lavoisier & des Physiciens qui ont suivi la même route, une source féconde de découvertes. Les Mémoires de l'Académie des Sciences offrent, depuis 1772 jusqu'en 1786, une suite non interrompue de travaux, d'expériences, d'analyses faites par ce Physicien sur le même plan. Ce qu'il y a de plus frappant pour ceux qui aiment à suivre les progrès de l'esprit humain dans ce genre de recherches, dont on n'avoit aucune idée il y a vingt ans, c'est que toutes les découvertes qui se sont succédées depuis cette époque, n'ont fait que confirmer les premiers résultats trouvés par M. Lavoisier, & donner plus de force & plus de solidité à la doctrine qu'il a proposée. Une autre considération, qui nous paroît également importante, c'est que les expériences de Bergman, de Schéele, de MM. Cavendish, Priestley, & d'un grand nombre d'autres Chimistes dans différentes parties de l'Europe, quoique faites sous des points de vue & avec des moyens différens en apparence, se sont tellement accordées avec les résultats généraux dont nous parlions plus haut, que cet accord, bien propre à convaincre les Physiciens qui cherchent la vérité sans prévention, & avec le courage 631 nécessaire pour résister aux préjugés, n'a fait que rendre plus solides & plus inébranlables les fondemens sur lesquels repose la nouvelle doctrine chimique. C'est dans cet état de la science, c'est à l'époque où les faits nouveaux, généralement reconnus, n'excitent encore des discussions entre les Physiciens, que relativement à leur explication, que M. Lavoisier, auteur de la plus grande partie de ces découvertes, & de la théorie simple & lumineuse qu'elles ont créée, s'est proposé d'enchaîner dans un nouvel ordre les vérités nouvelles, & d'offrir aux Savans, ainsi qu'à ceux qui veulent le devenir, l'ensemble de ses travaux. Ceux qui ont suivi avec soin les progrès successifs de la Chimie, ne trouveront dans l'Ouvrage dont nous nous occupons, que les faits qu'ils connoissent déjà; mais ils se présenteront à eux dans un ordre qui les frappera par sa clarté & sa précision. Ce sera donc spécialement sur la marche des faits, des idées & des raisonnemens tracés par M. Lavoisier, que nous insisterons dans ce rapport.
Ce Traité est divisé en trois parties. Dans la première, M. Lavoisier expose les élémens de la science & les bases sur lesquelles elle est fondée. C'est sur les corps les plus simples, & sur le premier ordre de leurs combinaisons, que roule cette première partie, comme nous le dirons tout-à-l'heure.
La seconde partie présente les tableaux de toutes les combinaisons de ces corps simples entr'eux, & des mixtes qu'ils forment les uns avec les autres. Les composés salins neutres en sont particulièrement le sujet.
Dans la troisième partie, M. Lavoisier décrit les appareils nouveaux, dont il a imaginé la plus grande partie, & à l'aide desquels il a établi les vérités exposées dans la première partie.
Considérons chacune de ces parties plus en détail, & suivons l'Auteur jusqu'à ses dernières divisions, pour faire connoître l'utilité & l'importance de son Ouvrage.
632
Première Partie.
En exposant, dans un Discours préliminaire, les motifs qui l'ont engagé à écrire son Ouvrage, M. Lavoisier annonce que c'est en s'occupant de la nomenclature & en développant ses idées sur les avantages & la nécessité de lier les mots aux faits, qu'il a été entraîné comme malgré lui à faire un Traité élémentaire de Chimie; que cette nomenclature méthodique l'ayant conduit du connu à l'inconnu, cette marche qu'il s'est trouvé forcé de suivre, lui a paru propre à guider les pas de ceux qui veulent étudier la Chimie; il pense que, quoique cette science ait encore beaucoup de lacunes & ne soit pas complette comme la Géométrie élémentaire, les faits qui la composent s'arrangent cependant d'une manière si heureuse dans la doctrine moderne, qu'il est permis de la comparer à cette dernière, & qu'on peut espérer de la voir s'approcher, de nos jours, du degré de perfection qu'elle est susceptible d'atteindre. Son but a été de ne rien conclure au-delà de l'expérience, de ne jamais suppléer au silence des faits.
C'est pour cela qu'il n'a point parlé des principes des corps, sur lesquels on a depuis si long-temps donné des idées vagues, dans les écoles & dans les Ouvrages élémentaires; qu'il n'a rien dit des attractions ou affinités chimiques, qui ne sont point encore connues, suivant lui, avec l'exactitude nécessaire pour en exposer les généralités dans des élémens. Il termine ce discours en retraçant les raisons & les motifs qui ont guidé les Chimistes dans le travail de la nouvelle nomenclature, & en faisant voir quelle influence les noms exacts proposés dans ce travail, peuvent avoir sur les progrès & l'étude de la science.
La première partie qui suit immédiatement ce Discours préliminaire, comprend dix-sept chapitres.
M. Lavoisier annonce qu'il traite, dans cette première Partie, de la formation des fluides aëriformes & de leur décomposition; de la combustion des corps simples, & de la formation des acides. Ce titre, qui n'auroit certainement 633 pas rappelé aux anciens Chimistes l'ensemble de leur science, le comprend cependant tout entier pour ceux qui la possèdent, & en effet, l'un de nous en traçant la marche & l'état de toutes les connoissances chimiques modernes dans quelques séances sur les fluides élastiques, a fait voir que toute la science est comprise dans l'histoire de leur développement & de leur fixation. Il est donc vrai de dire, que quoique le domaine de la Chimie ait été singulièrement agrandi par le nombre considérable de faits nouveaux qu'elle a acquis depuis quelques années, le rapprochement, la liaison & la cohérence de ces faits, peuvent en resserrer les élémens dans l'esprit de ceux qui les possèdent, & de ceux qu'une méthode exacte guide dans leurs études; si les expériences semblent effrayer l'imagination par leur nombre, les résultats simples qu'on en tire, & les données générales qu'elles fournissent, font évanouir les difficultés, & rendent le travail de la mémoire plus facile. Cette vérité sera mise dans tout son jour, par l'exposé des divers objets compris dans cette première partie de l'ouvrage de M. Lavoisier.
Le premier Chapitre traite de la combinaison des corps avec le calorique ou la matière de la chaleur, & de la formation des fluides élastiques. Le calorique dilate tous les corps en écartant leurs molécules, qui tendent à se rapprocher par la force d'attraction. On peut donc considérer son effet comme celui d'une force répulsive ou opposée à l'attraction. Lorsque l'attraction des molécules est plus forte, que l'écartement ou la force répulsive communiquée par le calorique, le corps est solide; si la force répulsive l'emporte sur l'attraction, les molécules s'écartent jusqu'à un certain point, la fusion, & enfin la fluidité élastique naissent de cet effet. Comme la diminution ou l'enlèvement du calorique permet le rapprochement des molécules des corps dont l'attraction agit alors librement, & comme on peut concevoir un refroidissement toujours croissant, beaucoup plus fort que celui que nous connoissons, & conséquemment un rapprochement proportionné dans les molécules des corps, il s'ensuit 634 que ces molécules ne se touchent pas, qu'il existe des intervalles entr'elles; ces intervalles sont remplis par le calorique. On peut l'y accumuler; c'est cette accumulation qui détruit l'attraction de ces molécules, & qui donne enfin naissance à un fluide élastique. Tous les corps liquides prendroient, à la surface du globe, cette forme de fluides élastiques, si la pression de l'air atmosphérique ne s'y opposoit pas, c'est en raison de cette pression qu'il faut que la température de l'eau soit élevée à 80 degrés pour qu'elle se réduise en vapeur; l'éther à 30 ou 33 degrés, l'alkool à 67, Mais les fluides supposés réduits en vapeurs par la suppression du poids de l'atmosphère, se formeroient bientôt un obstacle à eux-mêmes par leur pression.
On voit d'après cela qu'un fluide élastique ou un gaz n'est qu'une combinaison d'un corps quelconque ou d'une base avec le calorique. On voit encore que, suivant les espaces ou les intervalles compris entre les molécules des différens corps, il faudra plus ou moins de calorique pour les dilater au même point; c'est cette différence qu'on nomme capacité de chaleur, & la quantité de calorique nécessaire pour élever chaque corps à la même température, se nomme chaleur ou calorique spécifique. Comme les corps, en se combinant au calorique, deviennent des fluides élastiques, l'élasticité paroît être due à la répulsion des molécules du calorique, ou plutôt à une attraction plus forte entre ces dernières, qu'entre celles des corps fluides élastiques, qui sont alors repoussées par l'effet du premier.
Ces idées simples & fondées sur des expériences exactes, conduisent l'Auteur à donner, dans le second chapitre, des vues sur la formation & la constitution de l'atmosphère de la terre; elle doit être formée des substances susceptibles de se volatiliser au degré ordinaire de chaleur qui existe sur le globe, & à la pression moyenne qui soutient le mercure à 28 pouces. La terre étant supposée à la place d'une planète beaucoup plus rapprochée du soleil, comme l'est Mercure, l'eau, le mercure même entreroient en expansion, & se mêleroient 635 à l'air jusqu'à ce que cette expansion fût limitée par la pression exercée par ces nouveaux fluides élastiques. Si le globe étoit, au contraire, transporté à une distance beaucoup plus éloignée du soleil qu'il ne l'est, l'eau seroit solide & comme une pierre dure & transparente. La solidité, la liquidité, la fluidité élastique sont donc des modifications des corps dues au calorique. Les fluides habituellement vaporeux qui forment notre atmosphère, doivent, ou se mêler lorsqu'ils ont de l'affinité, ou se séparer suivant l'ordre de leurs pesanteurs spécifiques, s'ils ne sont pas susceptibles de s'unir. M. Lavoisier pense que la couche supérieure de l'atmosphère est surmontée des gaz inflammables légers qu'il regarde comme la matière & le foyer des météores lumineux.
Il étoit très-naturel que ces considérations générales sur l'atmosphère de la terre fussent suivies de l'analyse de l'air qui la compose; cette analyse fait le sujet du troisième chapitre, dans lequel est consignée une des plus belles découvertes du siècle & de la Chimie moderne. La combustion du mercure dans un ballon, la perte de poids d'un sixième de l'air, l'augmentation correspondante du poids du mercure, la qualité délétère des cinq sixièmes d'air restant; la séparation de l'air de la chaux de mercure fortement échauffée, la pureté de celui-ci, la recomposition de l'air semblable à celui de l'atmosphère par l'addition de cette partie tirée du mercure à celle restée dans le ballon; la chaleur vive & la flamme brillante dégagée de l'air par le fer qu'on y brûle, suffisent à M. Lavoisier pour prouver que l'air atmosphérique est un composé de deux fluides élastiques différens, l'un respirable, l'autre non respirable, que le premier forme 0,27, & le second 0,73.
Dans le quatrième chapitre, ce Savant expose les noms donnés à ces deux gaz qui composent l'air atmosphérique, & les raisons qui les ont fait proposer; le premier porte, comme on sait, le nom d'air vital & de gaz oxigène, & le second celui de gaz azote.
La quantité des deux principes de l'atmosphère étant connue, la nature du gaz oxigène occupe ensuite M. 636 Lavoisier. Le cinquième chapitre est destiné à l'examen de la décomposition du gaz oxigène ou air vital par le soufre, le phosphore, le charbon, & de la formation des acides. Cent grains de phosphore brûlé dans un ballon bien plein d'air vital, absorbent 154 grains de cet air ou de sa base, & forment 254 grains d'acide phosphorique concret. Vingt-huit grains de charbon absorbent 72 grains d'air vital, & forment 100 grains d'acide carbonique. Le soufre en absorbe plus que son poids & devient acide sulfurique. La base de cet air a donc la propriété, en se combinant avec ces trois corps combustibles, de les convertir en acides; de-là le nom d'oxigène donné à cette base de l'air vital, & celui d'oxigénation donné à l'opération par laquelle cette base se fixe.
La nomenclature des différens acides forme le sujet du sixième chapitre; le nom général d'acide désigne la combinaison avec l'oxigène; les noms particuliers appartiennent aux bases différentes unies à l'oxigène. Le soufre forme l'acide sulfurique, le phosphore l'acide phosphorique, le carbone ou charbon pur l'acide carbonique. La terminaison variée dans ces mots exprime la proportion d'oxigène; ainsi le soufre combiné avec peu d'oxigène & dans l'état d'un acide foible, donne l'acide sulfureux, tandis qu'une plus grande proportion de ce principe acidifiant, forme l'acide sulfurique. Nous n'insisterons pas davantage sur les principes de cette nomenclature, qui sont déjà bien connus de la Société. M. Lavoisier donne, à la fin de ce chapitre, les proportions d'azote & d'oxigène qui constituent l'acide du nitre en différens états, comme l'a découvert M. Cavendish.
Il parle, dans le septième chapitre, de la décomposition du gaz oxigène par les métaux. On sait que ces corps combustibles absorbent la base de l'air vital plus ou moins facilement, & à des températures plus ou moins élevées; mais comme l'affinité de ces corps pour l'oxigène est en général rarement plus forte que celle de celui-ci pour le calorique, les métaux s'y combinent plus ou moins difficilement. Les composés des métaux & d'oxigène 637 n'étant pas des acides, on a proposé le nom d'oxides pour les désigner, au lieu de celui de chaux, qui étoit équivoque, & fondé sur une fausse analogie. M. Lavoisier donne les détails de cette nomenclature à la fin de ce chapitre.
Il traite, dans le huitième, du principe radical de l'eau, & de la décomposition de ce fluide par le charbon & le fer. L'eau que l'on fait passer à travers un tube de verre ou de porcelaine rougi au feu, se réduit seulement en vapeur, sans éprouver d'altération. En passant à travers le même tube chargé de vingt-huit grains de charbon, il y a 85 grains d'eau changée de nature, & le charbon disparoît. On obtient 100 grains ou 144 pouces d'acide carbonique, qui contiennent, outre les 28 grains de carbone, 72 grains d'oxigène, provenant nécessairement de l'eau, puisqu'aucun autre corps n'a pu le lui fournir; ce gaz acide carbonique est mêlé de 13 grains ou 380 pouces cubes de gaz inflammable; ces 13 grains ajoutés aux 72 grains d'oxigène enlevé par le carbone, font les 85 grains d'eau qui manquent; & en effet, en brûlant dans un appareil fermé 85 grains d'air vital & 15 de gaz inflammable, on a 100 grains d'eau. L'eau est donc composée de ces deux principes. L'oxigène est déjà connu par les détails précédens; la base du gaz inflammable a été nommée hydrogène, ou principe radical de l'eau; M. Lavoisier en décrit les propriétés & sur-tout celles qu'il a dans l'état de gaz.
Le neuvième chapitre contient des détails absolument neufs sur la quantité de calorique qui se dégage dans la combustion de différens corps combustibles, ou, ce qui est la même chose en d'autres termes, pendant la fixation de l'air vital ou gaz oxigène. Pour bien concevoir l'objet de cet article important, rappelons que l'air vital est, comme tous les autres fluides élastiques, une base solidifiable unie à du calorique; que ce gaz ne peut se fixer, ou sa base devenir solide dans les combinaisons où elle entre, qu'en perdant le calorique qui la tenoit écartée & divisée en fluide élastique. Cela posé, 638 il est clair qu'en partant d'une expérience où l'air vital paroît laisser déposer sa base la plus solide possible en perdant tout le calorique qu'il contient, on aura une mesure à peu de chose près exacte de la quantité absolue de calorique contenu dans une quantité donnée de gaz oxigène. Mais comment mesurer cette chaleur. M. Lavoisier s'est servi, pour cela, d'un appareil ingénieux, dont la première idée est due à M. Wilcke, Physicien Anglois, mais qui a été changé & bien perfectionné par M. de la Place. Ce sont des enveloppes de tôle garnies de glace, & laissant un espace vide dans lequel on fait les expériences de combustion, absolument comme dans une sphère de glace assez épaisse pour que la température extérieure n'influe en aucune manière sur sa cavité intérieure. Le calorique se sépare pendant la fixation de l'oxigène, fond une partie de cette glace, proportionnelle à la quantité qui s'en dégage. En opérant ainsi la combustion du phosphore, M. Lavoisier a vu qu'une livre de ce combustible fond 100 livres de glace, en absorbant une livre 8 onces d'air vital; & comme l'acide phosphorique concret qui résulte de cette combustion paroît contenir l'oxigène le plus solide & le plus séparé de calorique, il en conclut que, dans l'état d'air vital, une livre d'oxigène contient une quantité de calorique suffisante pour fondre 66 livres 10 onces 5 gros 24 grains de glace à zero. En partant de cette expérience, M. Lavoisier a trouvé qu'une livre de charbon absorbant 2 livres 9 onces 1 gros 10 grains d'oxigène, & ne faisant fondre que 96 livres 8 onces de glace, tout le calorique contenu dans cette quantité d'air vital n'est pas dégagé, puisqu'il se seroit fondu 171 livres 6 onces 5 gros de glace; la différence de cette quantité de calorique, c'est-à-dire, une quantité capable de fondre 74 livres 14 onces 5 gros de glace, est employée à tenir sous forme de gaz 3 livres 9 onces 1 gros 10 grains d'acide carbonique, produit dans cette opération. La combustion du gaz hydrogène brûlé dans l'appareil de glace, lui a présenté le résultat suivant relativement au dégagement du calorique. Une livre de ce gaz absorbe 5 livres 10 onces 639 5 gros 24 grains d'air vital en brûlant; il se dégage dans cette combustion une quantité de calorique capable de faire fondre 295 livres 9 onces 3 gros & demi de glace; or, comme cette dose d'air vital auroit donné, si on l'avoit fait servir à la combustion du phosphore, où l'oxigène paroît être le plus solide possible, une quantité de calorique suffisante pour fondre 377 livres 12 onces 3 gros de glace, il s'ensuit que la différence de ces deux quantités de calorique, qui est exprimée par celle de 82 livres 9 onces 7 gros & demi de glace fondue, reste dans l'eau à 0 de température, & que chaque livre de ce liquide à cette température, contient dans la portion d'oxigène qui fait un de ses principes, une quantité de calorique capable de fondre 12 livres 5 onces 2 gros 48 grains de glace. M. Lavoisier a trouvé, par les mêmes expériences, la quantité de calorique contenu dans l'oxigène de l'acide nitrique, & celle qui se dégage dans la combustion de la cire & de l'huile; & si ces recherches avoient été suivies avec un soin égal sur la quantité de calorique que chaque métal dégage de l'air vital en absorbant l'oxigène, ou en se calcinant, cette appréciation seroit, comme le dit M. Lavoisier à la fin de ce chapitre, d'une grande utilité pour l'explication de beaucoup de phénomènes chimiques.
L'Auteur décrit dans le dixieme chapitre la nature générale des combinaisons des substances combustibles déjà examinées dans les chapitres précédens, les unes avec les autres. Les alliages des métaux, les dissolutions du soufre, du phosphore, du charbon dans le gaz hydrogène, l'union du carbone & de l'hydrogène qui constitue les huiles en général, sont indiqués successivement. Dans ce chapitre comme dans tous les précédens, on trouve des vues neuves sur l'union encore inconnue de plusieurs substances combustibles entr'elles.
Dans tous les chapitres précédens qui ont pour objet la décomposition de l'air vital, l'absorption de l'oxigène par les corps combustibles & les phénomènes de leur combustion & de leurs produits, il n'est question que des substances combinées, une à une avec l'oxigène. Le 640 deuxième chapitre présente les combinaisons de ce principe acidifiant avec plusieurs bases à la fois, conséquemment des oxides & des acides à plusieurs bases, & de la composition des matieres végétales & animales. On reconnoît par la lecture de ce chapitre la clarté des principes de la Chimie moderne, & en même tems la richesse de la nature dans la variété des composés qu'elle forme avec très-peu d'élémens. L'analyse la plus exacte prouve que l'hydrogène & le carbone privés de la plus grande quantité de leur calorique & unis ensemble dans des proportions différentes, à des quantités diverses d'oxigène constituent les matieres végétales, M. Lavoisier range ces matieres parmi les oxides lorsque la quantité d'oxigène est trop peu abondante pour leur donner le caractère acide, ou parmi les acides lorsque ce principe y est plus abondant. Le phosphore & l'azote font quelquefois partie de ces composés; & alors ils se rapprochent des matieres animales. Ainsi trois ou quatre corps simples unis en différentes proportions & dans différens états de pression ou de privation de calorique, suffisent à la Chimie moderne pour rendre raison de la diversité des matieres végétales, oxides & acides; & en y ajoutant l'azote, le phosphore & le soufre, les composés plus compliqués qui en résultent, donnent une idée exacte de la nature des substances animales, oxides ou acides. M. Lavoisier fait voir qu'on pourroit suivant les regles de la nouvelle Nomenclature désigner les principales especes des matieres végétales composées d'hydrogène, de carbone & d'oxigène, soit oxides, soit acides; mais la nécessité d'associer trop de mots pour désigner ces composés formeroit un langage barbare, & l'Auteur préfère les noms des treize acides végétaux & des six acides animaux, adoptés dans la nouvelle Nomenclature. Il termine ce chapitre par le dénombrement de ces acides.
Ces principes aussi clairs que simples sur la composition des substances végétales & animales, conduisent M. Lavoisier à faire connoître avec une égale clarté dans le douzieme chapitre, la décomposition de ces matières par le feu. Des trois principes les plus abondans qui les 641 constituent, l'hydrogène & l'oxigène tendent à prendre la forme de gaz par leur combinaison avec le calorique; le troisième ou le carbone n'a pas la même propriété. Une chaleur au-dessus de celle où ces principes restent en équilibre, doit donc détruire cet équilibre. A une température supérieure à celle de l'eau bouillante, l'oxigène s'unit à l'hydrogène & forme de l'eau qui se dégage; une partie du carbone unie séparément à l'hydrogène forme de l'huile; une autre se précipite seule. Une chaleur beaucoup plus forte, comme celle qu'on nomme chaleur rouge, sépare ces principes dans un autre ordre, décompose même l'huile formee par la premiere chaleur, & réduit entièrement les matières végétales à de l'acide carbonique, à de l'eau & à une partie de charbon isolée. L'azote, le phosphore & le soufre ajoutés à ces premiers principes, dans les matières animales compliquent cet effet du feu, & donnent naissance à l'ammoniaque que ces matieres fournissent dans leur distillation. Tous ces phénomènes ne tiennent qu'à des changemens de proportions dans l'union des principes & à leur diverse affinité pour le calorique.
Des changemens également simples ont lieu dans les fermentations vineuse, putride & acéteuse, dont M. Lavoisier expose avec soin les phénomènes dans les chapitres 13, 14 & 15. Ces opérations naturelles paroissoient autrefois inexplicables aux Chimistes, & il n'y a pas plus de quinze ans qu'on désespéroit encore d'en apprécier la cause. M. Lavoisier par des procédés ingénieux est parvenu à prouver que dans la fermentation vineuse, la matiere sucrée qu'il regarde comme un oxide & qui est formée suivant ses recherches, de 8 parties d'hydrogène, 28 de carbone, & 64 d'oxigène, sur cent parties de cette matière, est séparée en deux portions (par le changement & le partage seul de l'oxigène entre les deux bases oxidables), une grande partie du carbone prend plus d'oxigène en se séparant de l'hydrogène, & se convertit en gaz acide carbonique qui se dégage pendant cette fermentation, tandis que l'hydrogène, privé de l'oxigène & uni à un peu de carbone, & à l'eau ajoutée, 642 constitue l'alkool. Ainsi la nature change par cette fermentation des combinaisons ternaires en combinaisons binaires. Un effet analogue a lieu dans la putréfaction. Les cinq substances simples & combustibles qui forment les bases oxidables & acidifiables des matières animales, l'hydrogène, le carbone, l'azote, le soufre & le phosphore, & qui sont unies en différentes proportions à l'oxigène, se dégagent peu-à-peu en gaz hydrogène sulfuré, carboné, phosphoré, en gaz azote, en gaz acide carbonique, & en gaz ammoniaque. La fermentation acéteuse ne consiste que dans l'absorption de l'oxigène qui y porte plus de principe acidifiant. Il semble que l'acide carbonique n'ait besoin que d'hydrogène pour devenir acide acéteux, puisqu'en effet, ôtez ce dernier principe au vinaigre, il passe à l'état d'acide carbonique. Quoique cette théorie de la putréfaction & de l'acétification paroisse presque aussi simple que celle de la fermentation vineuse, M. Lavoisier convient que la Chimie n'est pas aussi avancée dans la connoissance de ces deux phénomènes, que dans celle du premier.
Dans le seizième chapitre, l'auteur considère la formation des sels neutres & les bases de ces sels. Les acides dont M. Lavoisier a exposé la nature dans les premiers chapitres, peuvent se combiner avec quatre bases terreuses, trois bases alkalines & dix-sept bases métalliques. Il expose succinctement l'origine, l'extraction & les principales propriétés de la potasse, de la soude, de l'ammoniaque, de la chaux, de la magnésie, de la baryte & de l'alumine; ces matières, si l'on en excepte l'ammoniaque, sont les moins connues de tous les corps naturels, & quoique, d'après quelques expériences, on pense qu'elles sont composées, on n'en a point encore séparé les élémens; aussi M. Lavoisier n'en parle-t-il que très-brièvement. Il termine cet exposé en annonçant qu'il est possible que les alkalis fixes se forment pendant la combustion des substances végétales à l'air. L'un de nous a déjà fait présumer dans plusieurs mémoires & dans ses leçons, que l'azote, qu'il a considéré comme principe des alkalis ou comme alkaligène, pourroit bien 643 se précipiter de l'atmosphère dans les substances végétales qu'on brûle dans l'atmosphère. Alors l'air atmosphérique seroit un réservoir des principes acidifiant & alkalifiant où la nature puiseroit sans cesse ces principes pour les fixer dans des bases, & produire les diverses matières salines, acides & alkalines. Mais cette assertion, loin d'être une vérité démontrée, ne doit être regardée que comme une hypothèse, jusqu'à ce que les expériences dont on s'occupe en ce moment dans plusieurs laboratoires, aient permis de prononcer.
Le chapitre dix-septième & dernier de cette première partie de l'ouvrage de M. Lavoisier, contient une suite de réflexions sur la formation des sels neutres, & sur leurs bases qu'il nomme salifiables. Il y fait voir que les terres & les alkalis s'unissent aux acides sans éprouver d'altération, & qu'il n'en est pas de même des métaux. Aucun de ces corps ne peut se combiner avec les acides sans s'oxigéner; ils enlèvent l'oxigène soit à l'eau dont ils séparent l'hydrogène en gaz, soit aux acides eux-mêmes dont ils volatilisent une portion de la base unie à une portion d'oxigène. De ce dégagement naît l'effervescence qui accompagne la dissolution des métaux dans les acides. On pourroit peut-être désirer dans ce chapitre des détails plus étendus sur les dissolutions métalliques; mais M. Lavoisier vouloit mettre une grande précision dans cette partie de son Ouvrage, & celle qu'il y a mise en effet, en rend la marche plus rapide sans nuire à la clarté des principes qui y sont exposés. Ce chapitre est terminé par un dénombrement des quarante-huit substances simples qui peuvent être oxidées & acidifiées dans différens états, en y comprenant les dix-sept substances métalliques, qu'il croit devoir aussi considérer comme des acides, lorsqu'elles sont portées à un grand degré d'oxigénation. Il résulte de ce dénombrement que quarante-huit acides qui peuvent être unis à vingt-quatre bases terreuses, alkalines & métalliques, donnent 1152 sels neutres, dont la nature & les propriétés n'auroient jamais été connues avec précision si, comme l'observe M. Lavoisier, on avoit continué à leur donner 644 des noms, ou impropres, ou insignifians, comme on l'avoit fait à l'époque des premières découvertes de Chimie, & qui cependant peuvent être placés avec ordre dans la mémoire, à l'aide de la nouvelle nomenclature.
Tels sont les faits, tel est l'ordre qui les lie, telles sont les conséquences qui en découlent naturellement, consignés dans la première partie de ce Traité élémentaire. Nous les avons fait connoître assez en détail, pour que la Société pût apprécier l'ensemble du travail de M. Lavoisier, & le comparer à ce qu'étoit encore la science chimique il y a vingt ans. On a pu y voir qu'à l'aide des expériences modernes, les élémens de cette science sont aujourd'hui beaucoup plus faciles à saisir qu'ils n'étoient autrefois, parce que tout se réduit à concevoir les effets généraux du calorique, à distinguer les matières simples, bases de toutes les combinaisons possibles, à considérer leur union avec l'oxigène; c'est presque sur ces trois faits généraux que sont fondés les détails contenus dans la première partie. En y ajoutant les attractions de l'oxigène pour les différens corps, les décompositions qui résultent des effets de ces attractions, on auroit l'ensemble complet de ces Elémens. Mais M. Lavoisier a omis cet objet à dessein, & nous avons exposé ailleurs les raisons qui l'ont déterminé à prendre ce parti.
Seconde Partie.
Après avoir rendu un compte exact de la marche nouvelle que M. Lavoisier a suivie dans la première partie, qui constitue seule les élémens de la science, il ne sera pas nécessaire d'entrer dans des détails aussi étendus pour faire connoître les deux autres parties.
La seconde est entièrement destinée à présenter dans des tableaux les combinaisons salines neutres, ou les composés de deux mixtes, car on se rappellera facilement que les acides sont des mixtes formés de bases unies à l'oxigène, les oxides métalliques également formés de l'oxigène uni aux métaux, & enfin les terres & les 645 alkalis vraisemblablement des composés. Mais pour rendre cette seconde partie plus complette, M. Lavoisier a mis avant les tableaux des sels neutres, dix tableaux qui offrent les combinaisons simples dont il a été parlé dans la première partie, & qui sont destinés à servir de résumé à cette première partie. On trouve dans ces 10 tableaux, 1o. les substances simples, ou au moins celles que les Chimistes ne sont pas parvenus à décomposer, au nombre de 33, savoir la lumière, le calorique, l'oxigène, l'azote, l'hydrogène, le soufre, le phosphore, le carbone, le radical muriatique, le radical fluorique, le radical boracique, les dix-sept substances métalliques, la chaux, la magnésie, la baryte, l'alumine & la silice; 2o. les bases oxidables & acidifiables, composées au nombre de 20, qui comprennent le radical nitro-muriatique, les radicaux des douze acides végétaux, & ceux des sept acides animaux; 3o. les combinaisons de l'oxigène avec les substances simples; 4o. les combinaisons des vingt radicaux composés, avec l'oxigène; ou les acides nitro-muriatiques, les douze acides végétaux, & les sept acides animaux; 5o. les combinaisons binaires de l'azote avec les substances simples: M. Lavoisier nomme celles de ces combinaisons qui ne sont pas connues, des azotures; 6o. les combinaisons binaires de l'hydrogène avec les mêmes substances simples: M. Lavoisier désigne par le nom d'hydrures celles de ces combinaisons qui n'ont point été examinées; 7o. les combinaisons binaires du soufre avec les corps simples; excepté les acides sulfurique & sulfureux, toutes ces combinaisons sont des sulfures; 8o. celles du phosphore avec les mêmes corps; tels sont l'oxide de phosphore, les acides phosphoreux & phosphorique, & les phosphures; 9o. celles du carbone avec les substances simples, savoir l'oxide de carbone, l'acide carbonique & les carbures; 10o. enfin celles de quelques autres radicaux avec les substances simples. A ces tableaux sont jointes des observations dans lesquelles M. Lavoisier donne l'explication, & retrace sous de nouveaux points de vue, une partie des faits consignés dans la première partie.
646
Les tableaux des sels neutres sont au nombre de trente-quatre; on y trouve successivement les nitrites, les nitrates, les sulfates, les sulfites, les phosphites, les phosphates, les carbonates, les muriates, les muriates oxigénés, les nitro-muriates, les fluates, les borates, les arséniates, les molybdates, les tunstates, les tartrites, les malates, les citrates, les pyrolignites, les pyrotartrites, les pyromucites, les oxalates, les acétites, les acétates, les succinates, les benzoates, les camphorates, les gallates, les lactates, les saccholates, les formiates, les bombiates, les sebates, les lithiates & les prussiates. Le nombre de chaque classe de ces sels neutres contenus dans ces tableaux, est presque dans tous de vingt-quatre. M. Lavoisier a eu soin de disposer ces sels suivant l'ordre connu des affinités de leurs bases pour les acides. Comme la plupart de ces acides sont nouvellement découverts, l'Auteur a joint à chaque tableau des observations sur la manière de préparer ces sels, sur l'époque de leurs découvertes, sur les Chimistes à qui elles sont dues, & souvent même sur la comparaison de leur nature & de leurs propriétés. M. Lavoisier n'a point eu l'intention d'offrir, dans cette seconde partie, une histoire des sels neutres; il n'a rien dit de la forme, de la saveur, de la dissolubilité, de la décomposition des sels neutres, ni de la proportion & de l'adhérence de leurs principes. Ces détails, que l'on trouve dans les Elémens de Chimie de l'un de nous, n'entroient point dans le plan de M. Lavoisier; son but étoit de présenter une esquisse rapide de ces combinaisons, & il est très-bien rempli par les tableaux & par les courtes notices qui les accompagnent.
Troisième Partie.
La troisième partie, qui a pour titre: Description des appareils & des opérations manuelles de la Chimie, montre aussi bien que les deux premières, combien la science a acquis de moyens, & la différence qui existe entre les expériences que l'on fait aujourd'hui & celles que l'on faisoit autrefois. M. Lavoisier a rejetté cette description 647 à la fin, parce que les détails qu'elle exige, auroient détourné l'attention & trop occupé l'esprit des Lecteurs, si elle avoit été placée avec la théorie, & parce que d'ailleurs elle suppose des connoissances qu'on n'a pu acquérir qu'en lisant les deux premières parties. Quoique M. Lavoisier l'ait présentée comme une explication des planches qu'on place ordinairement à la fin d'un ouvrage, nous y avons trouvé une méthode descriptive très-claire, & des observations intéressantes sur l'usage des instrumens & sur les phénomènes que présentent les corps qu'on soumet à leur action. Sans prétendre donner ici un extrait de cette troisième partie, qui n'en est pas susceptible, nous nous bornerons à offrir un léger apperçu des principaux objets contenus dans les huit chapitres qui la composent.
Le premier traite des instrumens nécessaires pour déterminer le poids absolu & la pesanteur spécifique des corps solides & fluides; telles sont les balances exactes de différentes sensibilités, depuis celles où l'on pèse 50 à 60 livres, jusqu'à celles qui trébuchent à des 512e. de grain (M. Lavoisier y propose des poids en fractions décimales de la livre, au lieu des divisions de la livre en onces, gros & grains); tels sont encore la balance hydrostatique, les aréomètres, sur-tout celui dont se sert M. Lavoisier, & qui lui est particulier.
Dans le chapitre second, sont décrits les instrumens propres à mesurer les gaz, les cuves pneumato-chimiques à l'eau & au mercure, les différens récipiens, le ballon à peser les gaz, la machine construite par les soins de M. Lavoisier, pour mesurer le volume & connoître la quantité des gaz suivant la pression & la température qu'ils éprouvent. M. Lavoisier nomme cette ingénieuse machine gazomètre.
Le chapitre III est destiné à la description d'un instrument imaginé par M. de la Place, pour déterminer la chaleur spécifique des corps & la quantité de calorique qui se dégage dans les combustions, dans la respiration des animaux & dans toutes les opérations de la Chimie. Cette utile machine, dont nous avons déjà indiqué les 648 avantages dans la première partie, est nommée calorimètre par M. Lavoisier.
On trouve exposés, dans le quatrième chapitre, les instrumens dont on se sert dans les simples opérations mécaniques de la Chimie, telles que la trituration, la porphyrisation, le tamisage, le lavage, la filtration & la décantation.
Le cinquième chapitre contient la description des moyens & des instrumens qu'on emploie pour opérer l'écartement ou le rapprochement des molécules des corps; tels sont les vases destinés à la solution des sels, à la lixiviation, à l'évaporation, à la cristallisation, & à la distillation simple, ou évaporation en vaisseaux clos.
M. Lavoisier décrit, dans le sixième chapitre, les instrumens qui servent aux distillations composées & pneumato-chimiques, & sur-tout les appareils de Woulfe, variés de beaucoup de manières; ceux qu'on emploie dans les dissolutions métalliques; ceux qu'il a imaginés pour recueillir les produits des fermentations vineuse & putride, pour la décomposition de l'eau. Il y joint une histoire des différens luts & de leurs diverses utilités.
Les détails contenus dans le septième chapitre, font connoître les appareils dont ce Physicien s'est servi avec succès pour connoître avec exactitude les phénomènes qui ont lieu dans la combustion du phosphore, du charbon, des huiles, de l'alkool, de l'éther, du gaz hydrogène, & conséquemment dans la recomposition de l'eau, ainsi que dans l'oxidation des métaux.
Enfin le huitième & dernier chapitre de l'Ouvrage traite des instrumens & des procédés propres à exposer les corps à de hautes températures; il y est question de la fusion, des creusets, des fourneaux, de la théorie de leur construction, du moyen d'augmenter considérablement l'action du feu, en substituant à l'air atmosphérique l'air vital ou gaz oxigène.
Quand ces détails ne seroient que des descriptions simples des machines auxquelles la Chimie doit toutes ses nouvelles connoissances, ils n'en seroient pas moins utiles, & on n'en auroit pas moins d'obligation à M. 649 Lavoisier, pour avoir publié des procédés & des appareils trop peu connus, même d'une partie de ceux qui professent aujourd'hui la Chimie, comme l'a dit l'Auteur. Mais ce n'est point seulement une description sèche & aride que présente cette troisième partie; on y décrit l'usage des diverses machines, on y fait connoître la manière de s'en servir, & les phénomènes qu'elles offrent à l'observateur; souvent même des points particuliers de la théorie générale exposée dans tout l'ouvrage, portent un jour éclatant sur le résultat des opérations auxquelles servent ces instrumens. On peut considérer cette troisième partie comme une histoire des principaux appareils nécessaires aux opérations de la Chimie moderne, & sans lesquels on ne pourroit plus espérer de faire faire des progrès à cette science.
Les planches placées à la fin de l'ouvrage, ont été gravées avec soin par la personne qui nous a déjà donné la traduction de Kirwan, & qui sait allier la culture des Lettres à celle des Arts & des Sciences.
L'ouvrage est terminé par des tables où sont exposées la pesanteur du pied cube des différens gaz, la pesanteur spécifique d'un grand nombre de corps naturels, les méthodes pour convertir les fractions vulgaires en fractions décimales & réciproquement, des moyens de correction pour la pesanteur des gaz relativement à la hauteur du mercure dans le baromètre & dans le thermomètre. Ces tables deviennent aujourd'hui aussi nécessaires aux Chimistes pour obtenir des résultats exacts dans leurs expériences, que le sont les tables de logarithmes aux Géomètres & aux Astronomes, pour l'exactitude & la rapidité de leurs calculs.
Nous pensons que l'Ouvrage de M. Lavoisier mérite l'approbation de la Société, & d'être imprimé sous son privilége.
Au Louvre, le 6 Février 1789.
Signé, de Horne & de Fourcroy.
La Société Royale de Médecine ayant entendu, dans sa séance tenue au Louvre le 6 du présent mois, 650 la lecture du Rapport ci-dessus, en a entièrement adopté le contenu.
Ce que je certifie véritable. Ce 7 Février 1789.
Signé, Vicq d'Azyr, Secrétaire perpétuel.
EXTRAIT des Registres de la Société Royale d'Agriculture.
Du 5 Février 1789.
Nous avons été chargés par la Société Royale d'Agriculture, M. de Fourcroy & moi, de lui rendre compte d'un Traité élémentaire de Chimie, par M. Lavoisier.
Des Savans de l'Europe, l'un de ceux qui a le plus contribué à l'heureuse révolution que la Chimie pneumatique a éprouvée de nos jours, c'est, sans contredit, M. Lavoisier. Les Mémoires importans qu'il a publiés depuis quinze ans, les faits brillans dont on lui est spécialement redevable, toutes les expériences connues qu'il a vérifiées avec un zèle infatigable, l'élégance & la précision des appareils qu'il a imaginés, la théorie nouvelle enfin sur laquelle il a singulièrement influé, & qu'on peut vraiment regarder comme lui étant propre, faisoient desirer que M. Lavoisier réduisît ces nombreux matériaux en un corps d'ouvrage, & sur-tout qu'il en fît un ouvrage élémentaire: il étoit difficile de mieux remplir ce vœu.
Ce Traité peut servir à l'étude de la Chimie par la méthode & l'ordre qui y regnent; quant au Chimiste déjà familiarisé avec la science, il y trouvera les faits réunis & classés, ainsi que de grandes vues sur le systême de notre atmosphère, de la végétation, de l'animalisation, 651 &c. ce qui offre une vaste carrière à ses recherches.
La Chimie recule de jour en jour ses bornes; elle embrasse maintenant toutes les sciences physiques, & l'Agriculture est peut-être une de celles qui aura le plus à s'applaudir des succès de la Chimie; l'analyse étant le seul moyen de conduire sûrement à la connoissance des terres, des amendemens & des engrais: enfin la Chimie pneumatique peut seule expliquer les grands phénomènes de la végétation, la formation des différens principes des végétaux, l'étiolement des plantes, &c. c'est elle qui nous a fait connoître cette double émission d'un gaz homicide & d'un gaz vital.
Dans le petit nombre d'ouvrages qui ont été récemment publiés sur la Chimie, tout étant neuf, la nomenclature, les faits, l'application de la méthode des Géomètres à ces mêmes faits, & la théorie entière, l'analyse d'un pareil Traité seroit une tâche longue & difficile à remplir; nous nous bornerons donc à des réflexions sur ce nouvel ordre de choses, qui, au milieu de beaucoup de prosélites, a encore quelques détracteurs.
On peut établir comme vérité qu'il n'y a pas d'art mécanique, le dernier de tous, dont la nomenclature ne soit moins vicieuse, moins insignifiante, que ne l'étoit celle de l'ancienne Chimie. Pas un mot dans l'ancienne langue chimique qui n'ait été enfanté par l'amour du mystère, & quelquefois même par le charlatanisme. Glauber, Stahl, emportés par le torrent & l'espèce de mode régnante alors, introduisent, l'un, son sel admirable, l'autre, son double arcane. Un mot neuf, mot qui n'a aucune acception, peut en recevoir une, il n'en est pas de même d'un mot déjà usité.
Il falloit donc une langue nouvelle pour une nouvelle science, des mots nouveaux pour de nouveaux produits; enfin, il falloit créer des expressions pour les phénomènes que créoit journellement la Chimie. Il importoit sur-tout que cette nomenclature fût raisonnée, que le mot fixât l'idée, & que, semblable à la langue des Grecs & des Latins, les augmentatifs, les privatifs, & le changement 652 naître des idées accessoires & précises, & c'est l'objet que remplissent, par exemple, les mots soufre, sulfate, sulfite, sulfure. Tel est le but qu'ont rempli les Savans qui se sont réunis pour former cette nouvelle nomenclature, & le Traité de M. Lavoisier la rend très-intelligible.
Rien de plus imposant dans l'ouvrage de M. Lavoisier que ce nombre d'expériences ingénieuses, dont beaucoup lui appartiennent, toutes présentées avec cette précision mathématique, inconnue avant cette époque, que Rouelle avoit devinée, & qui, soumettant l'analyse à la rigueur du calcul, fait le complément de la science, en rendant la recomposition des corps aussi facile que leur décomposition.
L'ancienne Chimie parvenoit bien quelquefois à la synthèse: elle décomposoit & recomposoit l'alun, les vitriols, les sels neutres en général, elle minéralisoit & révivifioit les métaux; mais l'eau, mais l'air échappoient à son analyse. Elle les regardoit comme des corps simples & élémentaires, il étoit réservé à la Chimie pneumatique de leur faire subir la double loi de la décomposition & de la recomposition.
Il nous reste à parler de la théorie, puisque nous sommes restreints à des généralités. Cette théorie pose sur une grande masse de faits, qui lui forment un rempart solide où elle paroît inattaquable: elle ne le seroit pas, sans doute, si elle prétendoit tout expliquer, mais elle sait s'arrêter quand les faits lui manquent, ou qu'ils sont en trop petit nombre pour consolider de nouveaux points de doctrine. Tel est le caractère de sagesse qui la distingue de l'ancienne théorie, qui expliquoit tout de dix manières différentes, parce qu'au défaut de routes, il faut se pratiquer des sentiers. Dans la théorie actuelle, les faits s'enchaînent; chaque proposition est étayée d'expériences qui se pressent, & on paroît réduit à ne pouvoir pas en tirer d'autres conséquences que celles que présente cette même théorie.
Nous pensons donc que cet Ouvrage, dont plusieurs chapitres sont immédiatement applicables à la Physique 653 de terminaison devinssent autant de moyen de faire végétale, mérite l'approbation de la Société Royale d'Agriculture.
Signé, de Fourcroy & Cadet de Vaux.
Je certifie cet Extrait conforme à l'original & au jugement de la Société.
A Paris, ce 6 Février 1789.
Signé, Broussonet, Secrétaire perpétuel.
De l'Imprimerie de Chardon, rue de la Harpe. 1789.
654
Fautes à corriger, & Additions.
Page 43, lignes 4 & 9, copeaux lisez coupeaux
Page 44, ligne 9, figure 14 lis. figure 16
Page 75, ligne 14, dans un ballon e lis. dans le ballon cb.
Page 77, pén. mtreux lis. nitreux
Page 78, ligne 6, à mesure que l'acide passe ajoutez une partie se condense dans le ballon, l'autre est absorbée par l'eau.
Page 94, ligne 21, ajoutez en note au bas de la page:
On a critiqué même avec assez d'amertume cette expression hydrogène, parce qu'on a prétendu qu'elle signifioit fils de l'eau, & non pas qui engendre l'eau. Mais qu'importe, si l'expression est également juste dans les deux sens? les expériences rapportées dans ce Chapitre, prouvent que l'eau, en se décomposant, donne naissance à l'hydrogène, & sur-tout l'hydrogène donne naissance à l'eau en se combinant avec l'oxigène. On peut donc dire également que l'eau engendre l'hydrogène, & que l'hydrogène engendre l'eau.
Page 96, antépénul. Bc lis. BC
Page 118, ligne 22 & suiv. gaz hydrogène carbonisé, gaz hydrogène sulfurisé, gaz hydrogène phosphorisé lis. carboné, sulfuré, phosphoré. La même faute a pu échapper dans d'autres endroits.
Page 133, pénul. & dern. ainsi les végétaux ne contiennent ni huile, ni eau, ni acide carbonique, ajoutez la note suivante au bas de la page:
Nota. On conçoit que je suppose ici des végétaux réduits à l'état de dessication parfaite, & qu'à l'égard de l'huile, je n'entends pas parler des végétaux qui en fournissent, soit par expression à froid, soit par une chaleur qui n'excède pas celle de l'eau bouillante. Il n'est ici question que de l'huile empyreumatique qu'on obtient par la distillation à feu nud, à un degré de feu 655 supérieur à l'eau bouillante. C'est cette huile seule que j'annonce être un produit de l'opération. On peut voir ce que j'ai publié à cet égard dans le volume de l'Académie, année 1786.
Page 146, lignes 16 & 17, 397 livres 9 onces 29 grains lis. 460 livres 11 onces 6 gros 53 grains
Page 163, ligne 7, dont lis. que
Page 172, ligne 1, ammoniaque lis. ammoniac
Page 196, ligne 8, tartarique lis. tartareux
Ibid. ligne 11, pyrolignique lis. pyroligneux
Ibid. ligne 12, pyromucique lis. pyromuqueux
Ibid. ligne 13, pyrotartarique lis. pyrotartareux
Ibid. ligne 15, acétique lis. acéteux
Page 254, Supprimez du Tableau muriate oxygéné d'ammoniaque, attendu que cette combinaison n'existe pas.
Page 294, lignes 14, 15 & 16, effacez & ce même sel saturé de chaux, oxalate acidule de potasse & de chaux
Page 384, ligne 22, d'un robinet l lis. d'un robinet lm
656
Planches.
NOTES
~~~~~
[1] Partie 2, Chapitre I.
[2] Je donnerai ailleurs la définition de la liqueur qu'on nomme éther, & j'en déveloperai les propriétés. Je me contenterai de dire dans ce moment, qu'on désigne par ce nom une liqueur inflammable très-volatile, d'une pesanteur spécifique beaucoup moindre que l'eau, & même que l'esprit-de-vin.
[3] Mém. Académ. 1780, page 335.
[4] On trouvera dans la dernière partie de cet Ouvrage, le détail des procédés qu'on emploie pour séparer les différentes espèces de gaz & pour les peser.
[A]Ajout dans l'errata du tome 2:
«On a critiqué même avec assez d'amertume cette expression hydrogène, parce qu'on a prétendu qu'elle signifioit fils de l'eau, & non pas qui engendre l'eau. Mais qu'importe, si l'expression est également juste dans les deux sens? les expériences rapportées dans ce Chapitre, prouvent que l'eau, en se décomposant, donne naissance à l'hydrogène, & sur-tout l'hydrogène donne naissance à l'eau en se combinant avec l'oxigène. On peut donc dire également que l'eau engendre l'hydrogène, & que l'hydrogène engendre l'eau.»
[5] Voyez la description de cet appareil dans la troisième partie de cet Ouvrage.
[B]Ajout dans l'errata du tome 2:
Nota. On conçoit que je suppose ici des végétaux réduits à l'état de dessication parfaite, & qu'à l'égard de l'huile, je n'entends pas parler des végétaux qui en fournissent, soit par expression à froid, soit par une chaleur qui n'excede pas celle de l'eau bouillante. Il n'est ici question que de l'huile empyreumatique qu'on obtient par la distillation à feu nud, à un degré de feu supérieur à l'eau bouillante. C'est cette huile seule que j'annonce être un produit de l'opération. On peut voir ce que j'ai publié à cet égard dans le volume de l'Académie, année 1786.
[6] On regardera peut-être comme un défaut de la méthode que j'ai adoptée, de m'avoir contraint à rejetter les alkalis de la classe des sels, & je conviens que c'est un reproche qu'on peut lui faire; mais cet inconvénient se trouve compensé par de si grands avantages, que je n'ai pas cru qu'il dût m'arrêter.
[7] Voyez Mémoires de l'Académie, année 1776, page 671, & 1778, page 535.
Au lecteur
~~~~~
Ce Traité élémentaire de chimie d'Antoine de Lavoisier se compose de deux tomes. Une version complète de cette publication accompagne la publication individuelle de chacun de ces deux tomes.
La version électronique html restitue le mieux la présentation du livre papier.
L'errata de cette édition a été pris en compte.
Nous avons utilisé une typographie plus moderne que celle de la version papier en remplaçant les ſ par des s.
La ponctuation n'a pas été modifiée hormis quelques corrections mineures.
L'orthographe a été conservée. Seuls quelques mots ont été modifiés. Ils sont soulignés par des tirets. Passer la souris sur le mot pour voir le texte original.